扩展功能
文章信息
- 孟许亚, 刘杰, 王璐, 布文奂, 卢金金, 孙宏晨
- MENG Xuya, LIU Jie, WANG Lu, BU Wenhuan, LU Jinjin, SUN Hongchen
- 抗坏血酸-聚乙烯亚胺复合碳点通过高尔基体应激对MG63细胞增殖、凋亡和氧化应激的影响
- Effects of ascorbic acid-polyethyleneimine carbon dots on proliferation, apoptosis and oxidative stress of MG63 cells by Golgi stress
- 吉林大学学报(医学版), 2019, 45(06): 1218-1223
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1218-1223
- 10.13481/j.1671-587x.20190605
-
文章历史
- 收稿日期: 2019-02-17
2. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021;
3. 吉林大学口腔医院口腔病理科, 吉林 长春 130021;
4. 吉林大学口腔医院儿童口腔科, 吉林 长春 130021;
5. 中国医科大学附属口腔医院口腔病理科, 辽宁 沈阳 110000
2. Key Laboratory of Tooth Development and Bone Remodeling and Regeneration of Jilin Province, Changchun 130021, China;
3. Department of Oral Pathology, Stomatology Hospital, Jilin University, Changchun 130021, China;
4. Department of Pediatric Dentistry, Stomatology Hospital, Jilin University, Changchun 130021, China;
5. Department of Oral Pathology, Affiliated Stomatology Hospital, China Medical University, Shenyang 110000, China
碳点(carbon dots,CDs)是一种新型非金属纳米材料,尺寸多为2~5 nm,比表面积大,细胞毒性低,表面活性高,具有光致发光特性等,被广泛地应用于生物成像、医学诊断、生物传感和转基因治疗等领域[1-2]。细胞的自动调节是一种稳态机制,可以调节各种亚细胞结构在细胞内功能的相对稳定[3]。研究[4]证明:纳米材料在被细胞摄取后,会引起细胞发生一系列氧化应激反应。氧化应激是一种稳态机制,反映了细胞的自动调节能力,调节各种亚细胞结构在细胞中功能的相对稳定,可引发内质网应激、线粒体应激、高尔基体应激和溶酶体应激等[3]。目前有大量关于纳米粒子引发内质网应激[5-8]和线粒体应激[9-10]的研究。高尔基体作为一种重要的细胞器,在蛋白质、脂质和糖类的加工、修饰及转运过程中发挥重要作用,并且与内质网和线粒体的功能也存在着密切联系。高尔基体磷酸化蛋白3(Golgi phosphorylation protein 3, GOLPH3)又称GPP34 / GMX33 / MI-DAS,是一种磷酸化蛋白,通过主要位于高尔基体反面网状结构上[11]的高尔基体应激蛋白参与细胞质囊泡转运、高尔基体结构维持、受体分选、蛋白质糖基化和细胞信号转导等[11-13]。然而,关于纳米粒子引发的高尔基体应激反应目前尚无相关报道。本研究以抗坏血酸和聚乙烯亚胺为原料,合成抗坏血酸-聚乙烯亚胺复合CDs,阐明CDs进入人骨肉瘤细胞后,引起的高尔基体应激反应,以及其细胞凋亡和氧化应激的影响,为CDs作为一种非病毒载体在载基因治疗中的应用提供理论依据。
1 材料与方法 1.1 细胞系、主要试剂和仪器人骨肉瘤MG63细胞(American Type Culture Collection公司,美国)。H-DMEM培养基粉和青霉素-链霉素溶液(Gibco公司,美国)、胎牛血清(Boibio公司,澳大利亚),4-羟乙基哌嗪乙磺酸(HEPES)、MTT粉剂、胰蛋白酶粉剂、活性氧(reactive oxygen species,ROS)染剂盒、Lipofectamine® 2000转染试剂盒、TRIzol和细胞凋亡试剂盒(Invitrogen公司,美国),反转录试剂盒和实时定量PCR试剂盒(TaKaRa公司,日本),抗坏血酸和聚乙烯亚胺(相对分子质量为1 800,Sigma-Aldrich公司,美国),细胞周期试剂盒(七海生物公司,中国)。倒置荧光显微镜和照相系统(Olympus公司,日本),酶标仪(RT-6000,深圳雷杜生命科学技术有限公司),冷冻干燥机(FDU2200,Eyela公司,日本),CO2恒温培养箱(Sanyo公司,日本)。
1.2 细胞培养MG63细胞复苏后培养在含有10%胎牛血清和1%青-链霉素溶液的H-DMEM培养基中,在37℃、5%CO2条件下培养,每2~3 d更换培养基,当细胞达到90%融合后,采用胰酶消化传代。
1.3 CDs制备500 mg Vc、25 mL(100 g·L-1) PEI和13.75 mL PBS微波炉高火5min,20mL去离子水溶解,最大转速离心5 min,取上清抽滤,于磁力搅拌器上渗析7 d。
1.4 MTT法检测细胞增殖率将处于对数生长期的细胞系消化、离心和重悬后,按照每孔3 500个细胞的密度接种于96孔板,待细胞贴壁且细胞密度达到70%左右,按照0、20、40、60、80、100和120 mg·L-1CDs浓度更换培养基,每个浓度设置5个复孔,同时设置调零孔以减少误差。孵育24 h后,每孔加入20 μLMTT液(500 mg·L-1),37℃孵育4 h后弃去培养基,每孔加入150 μL二甲基亚砜(dimethylsulfoxide,DMSO),在摇床上混匀后,于酶标仪490 nm波长处测定吸光度(A)值,以A值代表细胞增殖率。
1.5 流式细胞术检测不同细胞周期细胞百分比将对数生长期的细胞消化、离心和重悬后,以每孔(15~20)×104个细胞的密度接种于6孔板。待细胞贴壁后,分为对照组和不同浓度CDs组,按1.4实验浓度对细胞进行处理。24 h后,吸弃原培养基,收集细胞。细胞沉淀用预冷的70%乙醇4℃固定2 h或过夜。1 000 g离心5 min,PBS重悬。碘化丙啶染色液配置:1 mL染色缓冲液中加入25 μL碘化丙啶储存液和20 μL RNase A,混匀。每个样品加入0.5 mL配置好的染色液,轻轻混匀,重悬细胞。37℃避光温浴30 min后,5 h内上流式细胞仪检测(激发波长为488 nm,红色荧光)不同细胞周期细胞百分比。
1.6 显微镜观察CDs在细胞内的成像将对数生长期细胞消化、离心,重悬后,以每孔(15~20)×104个细胞的密度接种于预先放有盖玻片的6孔板。待细胞贴壁后按照MTT筛选出的CDs生物安全浓度处理细胞,分别孵育1和24 h后,采用预冷的PBS冲洗,采用95%乙醇固定20 min,应用倒置荧光显微镜使用蓝色光激发进行观察和拍照。
1.7 实时定量PCR法检测基因沉默上海锐博公司设计合成siRNA-GOLPH3,产品编号为siG10118111018(GOLPH3-siRNA1)、siG10118111031(GOLPH3-siRNA2)和siG10118111044(GOLPH3-siRNA3)的3条siRNA,采用脂质体Lipofectamine® 2000转染试剂盒,按照说明书的要求转染。将MG63细胞分为空白对照组、转染阴性对照组、转染GOLPH3-siRNA组、CDs组、转染阴性对照+CDs组和转染GOLPH3-siRNA+CDs组。通过实时定量PCR法检测各组MG63细胞中GOLPH3基因的表达水平,计算基因沉默效率,确定最佳基因沉默效率。
1.8 流式细胞术检测细胞凋亡率将对数生长期细胞消化、离心和重悬后,以每孔(15~20)×104个细胞的密度接种于6孔板。将MG63细胞系分为空白对照组、转染阴性对照组、转染GOLPH3-siRNA组、CDs组、转染阴性对照+CDs组和转染GOLPH3-siRNA+CDs组,每组均设3个复孔。24 h后胰酶消化,并用之前吸出的含血清培养基终止消化,离心,PBS洗涤细胞2次,每个样本用500 μLBinding Buffer重悬细胞;加入5 μL AnnexinⅤ-FITC(绿色荧光)混匀后,加入5 μL Propidium Iodide(红色荧光)和AnnexinⅤ-FITC对细胞进行染色,1 h内上流式细胞仪检测。各种细胞凋亡率以正常细胞、坏死细胞、早期凋亡细胞和晚期凋亡细胞占细胞总数的百分比表示。
1.9 流式细胞术检测细胞中ROS水平将对数生长期细胞消化、离心和重悬后,以每孔(15~20)×104个细胞的密度接种于6孔板。待细胞贴壁后,按1.8分组进行不同处理,24 h后收集6孔板中的贴壁细胞,加入1μmol·L-1 DCEH-DA,37℃、5%CO2条件下静置0.5 h,每隔3~5 min混匀1次,然后用无血清培养基或PBS洗涤细胞3次,去除未进入细胞的DCEH-DA,收集细胞,PBS重悬后上流式细胞仪检测细胞荧光度A值, 以A值代表ROS水平。
1.10 统计学分析采用SPSS19.0统计软件进行统计学分析。各组MG63细胞增殖率、各细胞周期MG63细胞百分比及MG63细胞中ROS水平以x±s表示,各组样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 CDs的毒性和细胞增殖率不同浓度CDs分别作用细胞24、48和72 h后的结果显示:当CDs浓度一致时,随着孵育时间的延长细胞增殖率增加;当孵育时间一致时,随着CDs浓度的增加细胞增殖受到抑制。当CDs浓度 < 40 mg·L-1时,0和20mg·L-1CDs组在72 h内细胞增殖率比较差异均无统计学意义(P < 0.05)。当CDs浓度≥40 mg·L-1时,在24、48和72 h时的细胞增殖率比较差异均有统计学意义(P < 0.05)。细胞周期检测结果显示:与对照组比较,作用24h时40 mg·L-1CDs组G0/G1期细胞百分比明显升高(P < 0.01),S期细胞百分比明显降低(P < 0.01),G2/M期细胞百分比差异无统计学意义(P>0.05)。见图 1和2。
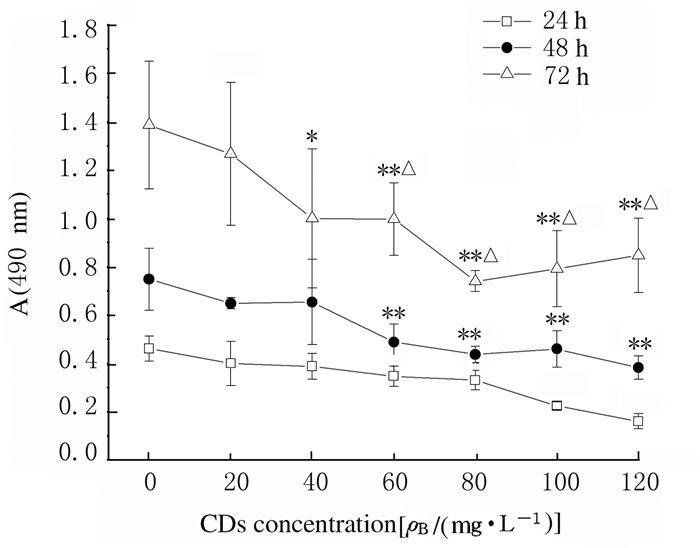
|
| *P < 0.05, **P < 0.01 vs 24 h; △P < 0.05 vs 48 h. 图 1 各组MG63细胞增殖率 Fig. 1 Proliferation rates of MG63 cells in various groups |
|
|
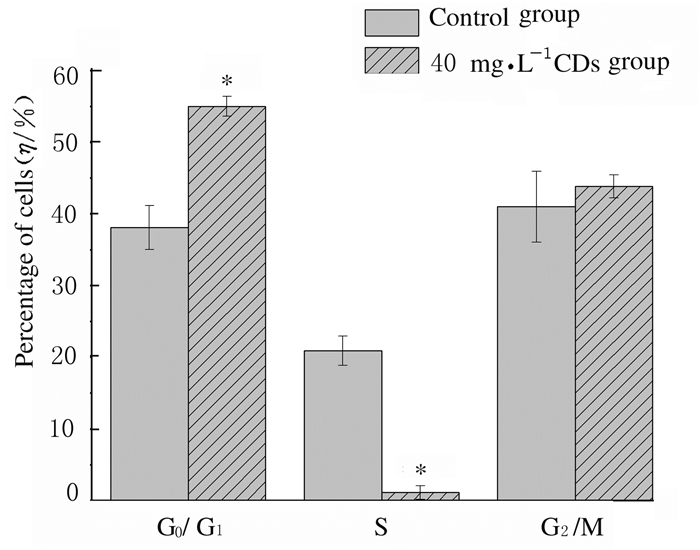
|
| *P < 0.01 compared with control group. 图 2 对照组和40mg·L-1CDs组MG63细胞在不同细胞周期的百分比 Fig. 2 Percentages of MG63 cells at different cell cycles in control group and 40 mg·L-1 CDs group |
|
|
由于CDs的光致发光特性,蓝光荧光可激发CDs发出绿光,且CDs易于被细胞摄取,因此CDs可用于细胞内成像。加入CDs 1 h后,在细胞质中可见微弱的绿色荧光,随着时间的延长,当时间达到24 h时,绿色荧光明显增强。见图 3(插页二)。

|
| A-D:Control group; E-H:40 mg·L-1 CDs group; A, B, E, F:1 h; C, D, G, H:24 h; A, C, E, G:Light field; B, D, F, H:CDs fluorescence. 图 3 碳点的细胞内成像(×200) Fig. 3 Imaging of CDs in cells(×200) |
|
|
按分组方法采用Lipofectamine-siRNA转染24 h后,实时定量RT-PCR法检测细胞中GOLPH3基因表达水平(基因沉默效率)数据显示:转染GOLPH3-siRNA2组MG63细胞在24 h时基因沉默效率最高,达到75%。见图 4。
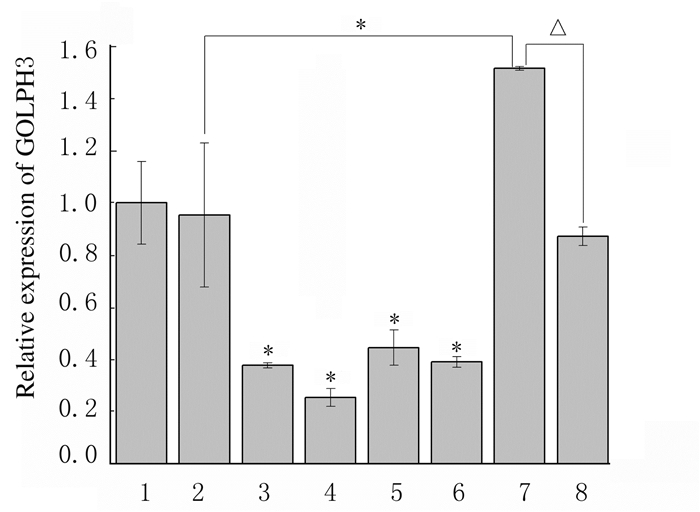
|
| 1:Blank control group; 2:Negative control transfection group; 3:GOLPH3-siRNA1 group; 4:GOLPH3-siRNA2 group; 5:GOLPH3-siRNA3 group; 6:GOLPH3-siRNA group; 7:Negative control transfection+CDs group; 8:GOLPH3-siRNA2+CDs group. *P < 0.05 vs Negative control transfection group; △P < 0.05 vs Negative control transfection+CDs group. 图 4 各组MG63细胞中GOLPH3基因表达水平 Fig. 4 Expressionlevels of GOLPH3 gene in MG63 cells in various groups |
|
|
空白对照组MG63细胞早期凋亡率为0.75%,晚期凋亡率为5.15%;CDs组MG63细胞早期凋亡率为0.94%,晚期凋亡率为21.00%;转染阴性对照组MG63细胞早期凋亡率为0.62%,晚期凋亡率为4.92%;转染阴性对照+CDs组MG63细胞早期凋亡率为1.53%,晚期凋亡率为13.63%;GOLPH3-siRNA组MG63细胞早期凋亡率为0.99%,晚期凋亡率为3.33%;转染GOLPH3-siRNA+CDs组MG63细胞早期凋亡率为1.64%,晚期凋亡率为23.06%。CDs组、转染阴性对照+CDs组和转染GOLPH3-siRNA+CDs组MG63细胞晚期凋亡率高于空白对照组、转染阴性对照组和转染GOLPH3-siRNA组。见图 5。
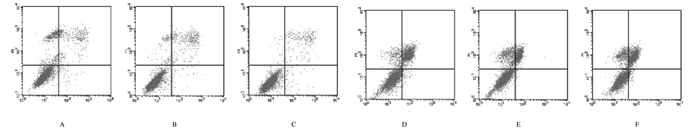
|
| A:Blank control group; B:CDs group; C: Negative control transfection group; D: Negative control transfection group+CDs group; E: GOLPH3-siRNA group; F: GOLPH3-siRNA+CDs group. 图 5 各组MG63细胞凋亡率 Fig. 5 Apoptotic rates of MG63 cells in various groups |
|
|
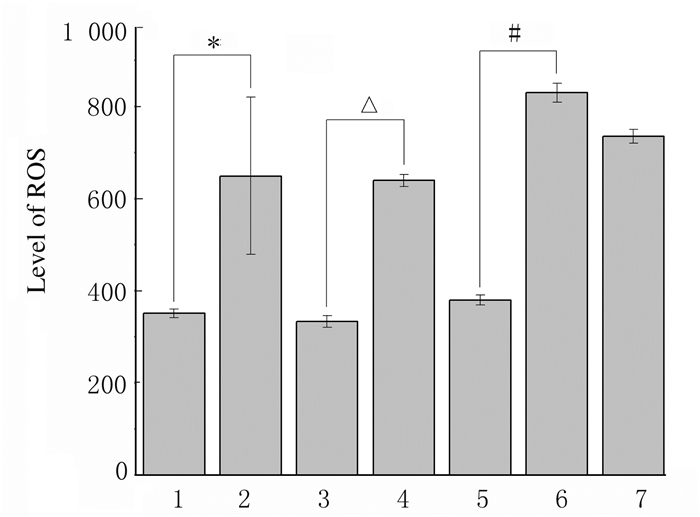
CDs组与非CDs组ROS水平比较:CDs组MG63细胞中ROS水平高于空白对照组(P<0.05),转染阴性对照+ CDs组MG63细胞中ROS水平高于转染阴性对照组(P<0.05),转染GOLPH3-siRNA+CDs组MG63细胞中ROS水平高于转染GOLPH3-siRNA组(P<0.05)。见图 6。
|
| 1:Blank control group; 2:CDs group; 3:Negative control transfection group; 4:Negative control transfection+CDs group; 5:GOLPH3-siRNA2 group; 6:GOLPH3-siRNA2+CDs group; 7:H2O2 group.*P < 0.05 vs blank control group; △P < 0.05 vs negative control transfection group; #P < 0.05 vs GOLPH3-siRNA2 group. 图 6 各组MG63细胞中ROS水平 Fig. 6 Levels of ROS in MG63 cells in various groups |
|
|
近年来随着纳米技术的发展,越来越多的纳米材料和纳米药物被应用于生物医学领域,而这些材料和药物摄取会引起细胞发生一系列连锁效应,引起应激反应。内质网应激是纳米毒理学评估的早期生物标志物,用于纳米毒理学研究[5]。多种纳米颗粒,特别是金属基纳米颗粒,可以在体内和体外诱导内质网的形态学变化并激活内质网应激途径。此外,化学物质对内质网应激的调节已被证明可改变内质网的毒性,可能是导致纳米颗粒诱导毒性的机制[14]。二氧化硅纳米粒子通过引发内质网应激反应,促进细胞凋亡[9];铜纳米粒子也具有引起线粒体应激,促进DNA损伤和肺纤维化的作用[15],但关于纳米材料引发高尔基体应激目前少有研究报道。抗坏血酸-聚乙烯亚胺复合CDs作为一种新兴的碳纳米粒子,其生物学性质主要表现为对细胞增殖、细胞周期、凋亡和氧化应激等方面的影响。因此,本研究主要从抗坏血酸-聚乙烯亚胺复合CDs的生物学性质入手,探讨高尔基体应激在其中的作用,为纳米材料的生物应用提供理论依据。
本研究合成抗坏血酸-聚乙烯亚胺复合CDs,其能迅速进入细胞,并在蓝光激发下发出绿光,提示这种新型纳米粒子可用于生物成像技术,或者作为标记物检测药物的摄取和体内分布。低浓度的纳米粒子具有抗氧化性,而高浓度的纳米粒子有较高的细胞毒性,触发细胞氧化应激和细胞死亡[16]。本研究采用MTT法检测不同浓度CDs与细胞共孵育不同时间后其对细胞增殖率的影响,当孵育时间一致时,随着CDs浓度的增加细胞增殖受到抑制;当CDs浓度一致时,随着孵育时间的延长,细胞增殖率明显增加,提示CDs的细胞毒性有明显的浓度依赖性。流式细胞术检测细胞周期结果显示:CDs可以将大部分细胞周期阻断在G0/G1期和S期,使G2/M期的细胞数量明显减少,提示CDs能有效抑制细胞有丝分裂过程。细胞凋亡和ROS水平检测结果表明:CDs能促进细胞凋亡,尤其晚期凋亡,并能增强细胞氧化应激水平。ISMAIL等[17]研究显示:ROS在一定程度上可以引发细胞凋亡,因此猜测CDs引发的细胞凋亡增加可能与ROS水平升高有关。GOLPH3作为一种高尔基体应激蛋白,参与调节高尔基体的结构和功能[12-13]及DNA损伤,具有一定的抗凋亡作用[18-20],并且能在一定程度上减少ROS的生成,发挥抗氧化作用,对细胞的存活起到保护作用。另外有研究[21]表明:GOLPH3的高表达与癌症的发生有关联,而癌症的发生与细胞的异常增殖有关联,细胞凋亡率降低。在本研究中,转染阴性对照组+CDs组和转染GOLPH3-siRNA+CDs组比较,GOLPH3对CDs引起的细胞凋亡率升高有一定的抑制作用。本研究的结果与上述结论一致。
综上所述,本研究证实了CDs具有荧光性,对MG63细胞的增殖有一定的抑制作用,并可以在一定程度上阻断细胞有丝分裂。同时,本研究从亚细胞器结构层面证明了CDs可以引起高尔基体应激反应,促进GOLPH3的高表达,GOLPH3对CDs引起的凋亡和氧化应激有一定的抑制作用,即高尔基体应激对细胞存活起到保护性作用。这一结论为纳米材料的生物应用提供了实验依据。
| [1] |
ZHU S J, MENG Q N, WANG L, et al. Highly photoluminescent carbon dots for multicolor patterning, sensors, and bioimaging[J]. Angew Chem Int Ed Engl, 2013, 52(14): 3953-3957. DOI:10.1002/anie.201300519 |
| [2] |
LIU C J, ZHANG P, ZHAI X Y, et al. Nano-carrier for gene delivery and bioimaging based on carbon dots with PEI-passivation enhanced fluorescence[J]. Biomaterials, 2012, 33(13): 3604-3613. DOI:10.1016/j.biomaterials.2012.01.052 |
| [3] |
SASAKI K, YOSHIDA H. Organelle autoregulation--stress responses in the ER, Golgi, mitochondria and lysosome[J]. J Biochem, 2015, 157(4): 185-195. DOI:10.1093/jb/mvv010 |
| [4] |
JAYARAM D T, RUNA S, KEMP M L, et al. Nanoparticle-induced oxidation of corona proteins initiates an oxidative stress response in cells[J]. Nanoscale, 2017, 9(22): 7595-7601. DOI:10.1039/C6NR09500C |
| [5] |
CHEN R, HUO L L, SHI X F, et al. Endoplasmic reticulum stress induced by zinc oxide nanoparticles is an earlier biomarker for nanotoxicological evaluation[J]. ACS Nano, 2014, 8(3): 2562-2574. DOI:10.1021/nn406184r |
| [6] |
PERSAUD I, SHANNAHAN J H, RAGHAVENDRA A J, et al. Biocorona formation contributes to silver nanoparticle induced endoplasmic reticulum stress[J]. Ecotoxicol Environ Saf, 2019, 170: 77-86. DOI:10.1016/j.ecoenv.2018.11.107 |
| [7] |
GUO C X, MA R, LIU X Y, et al. Silica nanoparticles induced endothelial apoptosis via endoplasmic reticulum stress-mitochondrial apoptotic signaling pathway[J]. Chemosphere, 2018, 210: 183-192. DOI:10.1016/j.chemosphere.2018.06.170 |
| [8] |
HUO L L, CHEN R, ZHAO L, et al. Silver nanoparticles activate endoplasmic reticulum stress signaling pathway in cell and mouse models: The role in toxicity evaluation[J]. Biomaterials, 2015, 61: 307-315. DOI:10.1016/j.biomaterials.2015.05.029 |
| [9] |
HE Q, ZHOU X J, LIU Y, et al. Titanium dioxide nanoparticles induce mouse hippocampal neuron apoptosis via oxidative stress- and calcium imbalance-mediated endoplasmic reticulum stress[J]. Environ Toxicol Pharmacol, 2018, 63: 6-15. DOI:10.1016/j.etap.2018.08.003 |
| [10] |
KACHI H, NODA M, WATAHA J C, et al. Colloidal platinum nanoparticles increase mitochondrial stress induced by resin composite components[J]. J Biomed Mater Res B Appl Biomater, 2011, 96(2): 193-198. |
| [11] |
DIPPOLD H C, NG M M, FARBER-KATZ S E, et al. GOLPH3 bridges phosphatidylinositol-4-phosphate and actomyosin to stretch and shape the golgi to promote budding[J]. Cell, 2009, 139(2): 337-351. DOI:10.1016/j.cell.2009.07.052 |
| [12] |
SECHI S, FRAPPAOLO A, BELLONI G, et al. The multiple cellular functions of the oncoprotein Golgi phosphoprotein 3[J]. Oncotarget, 2015, 6(6): 3493-3506. |
| [13] |
LI T, YOU H, ZHANG J, et al. Study of GOLPH3: a potential stress-inducible protein from golgi apparatus[J]. Mol Neurobiol, 2014, 49(3): 1449-1459. DOI:10.1007/s12035-013-8624-2 |
| [14] |
CAO Y, LONG J M, LIU L L, et al. A review of endoplasmic reticulum (ER) stress and nanoparticle (NP) exposure[J]. Life Sci, 2017, 186: 33-42. DOI:10.1016/j.lfs.2017.08.003 |
| [15] |
LERNER C A, RUTAGARAMA P, AHMAD T, et al. Electronic cigarette aerosols and copper nanoparticles induce mitochondrial stress and promote DNA fragmentation in lung fibroblasts[J]. Biochem Biophys Res Commun, 2016, 477(4): 620-625. DOI:10.1016/j.bbrc.2016.06.109 |
| [16] |
CHAKRABORTY A, JANA N R. Vitamin C-conjugated nanoparticle protects cells from oxidative stress at low doses but induces oxidative stress and cell death at high doses[J]. ACS Appl Mater Interfaces, 2017, 9(48): 41807-41817. DOI:10.1021/acsami.7b16055 |
| [17] |
KOYUNCU I, GONEL A, KOCYIGIT A, et al. Selective inhibition of carbonic anhydrase-Ⅸ by sulphonamide derivatives induces pH and reactive oxygen species-mediated apoptosis in cervical cancer HeLa cells[J]. J Enzyme Inhib Med Chem, 2018, 33(1): 1137-1149. DOI:10.1080/14756366.2018.1481403 |
| [18] |
BERGERON J J M, AU C E, THOMAS D Y, et al. Proteomics identifies golgi phosphoprotein 3(GOLPH3) with a link between golgi structure, cancer, dna damage and protection from cell death[J]. Mol Cell Proteomics, 2017, 16(12): 2048-2054. DOI:10.1074/mcp.MR117.000068 |
| [19] |
FARBER-KATZ S E, DIPPOLD H C, BUSCHMAN M D, et al. DNA damage triggers Golgi dispersal via DNA-PK and GOLPH3[J]. Cell, 2014, 156(3): 413-427. DOI:10.1016/j.cell.2013.12.023 |
| [20] |
BUSCHMAN M D, XING M K, FIELD S J. The GOLPH3 pathway regulates Golgi shape and function and is activated by DNA damage[J]. Front Neurosci, 2015, 9: 362. |
| [21] |
KUNA R S, FIELD S J. GOLPH3: a Golgi phosphatidylinositol(4)phosphate effector that directs vesicle trafficking and drives cancer[J]. J Lipid Res, 2019, 60(2): 269-275. DOI:10.1194/jlr.R088328 |
 2019, Vol. 45
2019, Vol. 45


