扩展功能
文章信息
- 潘峰, 郭夏青, 沈江宜, 苏志强
- PAN Feng, GUO Xiaqing, SHEN Jiangyi, SU Zhiqiang
- 大黄素对缺血性脑卒中模型大鼠的神经保护作用及其对ERK1/2信号通路的影响
- Neuroprotective effect of emodin on ischemic stroke model rats and its effect on ERK1/2 signaling pathway
- 吉林大学学报(医学版), 2019, 45(06): 1212-1217
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1212-1217
- 10.13481/j.1671-587x.20190604
-
文章历史
- 收稿日期: 2019-02-01
2. 河南大学淮河医院神经内科, 河南 开封 475000;
3. 河南省南阳市南石医院神经重症医学科, 河南 南阳 473000;
4. 哈尔滨医科大学第一临床医院神经内科, 黑龙江 哈尔滨 150001
2. Department of Neurology, Huaihe Hospital, Henan University, Kaifeng 475000, China;
3. Department of Intensive Care Unit, Nanshi Hospital, Nanyang City, Henan Province, Nanyang 473000, China;
4. Department of Neurology, First Clinical Hospital, Harbin Medical University, Harbin 150001, China
脑卒中分为出血性脑卒中和缺血性脑卒中,其中缺血性脑卒中为脑卒中的主要类型。治疗脑卒中的药物有溶栓药物、神经保护剂、降纤降脂药物和抗血小板抗凝剂等,获得临床批准使用的只有组织型纤维蛋白溶活剂,但组织型纤维蛋白溶活剂的时间窗窄,只对发病3 h内的脑血栓患者有效,对大部分发病超过3 h的患者治疗效果不佳,因此挑选治疗时间窗相对比较宽和具有神经保护作用的药物对改善缺血性脑卒中的治疗效果具有重要意义[1]。脑卒中的发病机制比较复杂,神经细胞凋亡是脑卒中机制研究中比较热门的领域,缺血性脑损伤可引起脑组织缺血缺氧,从而引起神经细胞凋亡坏死,造成神经功能障碍,因此减少神经细胞凋亡对缺血性脑损伤具有神经保护作用[2]。大黄素为大黄的主要成分,研究[3-4]显示其对缺血性脑损伤具有保护作用,但其作用机制尚不十分清楚。本研究探讨大黄素对缺血性脑卒中的神经保护作用及其对ERK1/2信号通路的影响,阐明大黄素对神经保护作用的可能机制。
1 材料与方法 1.1 实验动物和主要试剂健康、清洁级、7~9周龄、雌雄各半、体质量280~300 g、200只SD大鼠购自中国科学院微生物研究所,动物许可证号:SYXK(京)2014-0032。TTC染色试剂、TUNEL试剂盒、蛋白裂解液、BCA试剂盒和ECL试剂盒(美国BioFlux公司),大黄素、兔抗鼠Cleavedcaspase-3、B淋巴细胞瘤2(Bcell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2related X protein, Bax)、ERK1/2和磷酸化ERK1/2(p-ERK1/2)抗体(美国Sigma公司),线栓(北京沙东生物技术有限公司)。
1.2 大鼠分组和处理将200只大鼠随机分为假手术组、模型组和大黄素组,假手术组60只,模型组和大黄素组各70只。模型组和大黄素组大鼠建立缺血性脑卒中大鼠模型,大黄素组大鼠在建模前30 min给予大黄素(25 mg·kg-1)腹腔注射[5],假手术组和模型组大鼠建模前30 min给予等量生理盐水腹腔注射。
1.3 缺血性脑卒中大鼠模型的建立采用改良Longa大脑中动脉栓塞法建立脑缺血损伤大鼠模型[6],将大鼠水合氯醛麻醉后固定到手术台上,颈部去毛、消毒,取颈部正中切口切开颈部皮肤,钝性分离大鼠颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉和颈外动脉,颈内动脉远心端用动脉夹夹住,采用剪刀在颈总动脉结扎处远心侧剪小口,颈内动脉插入备好的线栓,松开动脉夹,线栓插入至微感阻力时停止插入,插入深度距离动脉分叉处18~20 mm,然后缝合皮肤。2 h后拔出线栓,形成再灌注。假手术组大鼠操作同上,但线栓只插入10 mm。苏醒后提起大鼠尾巴时大鼠左前肢屈曲、前行时向左侧划圈表示缺血性脑卒中模型成功建立。
1.4 各组大鼠神经功能障碍评分建模后24 h,各组大鼠采用5分制评分标准[7]进行神经功能障碍评分,无神经功能缺失症状为0分;提尾时左侧前肢屈曲不能伸展为1分;行走时呈追尾或向左侧划圈症状为2分;行走困难、躯体向左侧倾倒为3分;不能行走或处于昏迷状态为4分。0分和4分剔除,1~3分为有效模型。模型组和大黄素组分别各剔除造模失败大鼠6和7只。
1.5 TTC染色测定各组大鼠脑梗死体积建模24 h后,每组取15只大鼠,水合氯醛深度麻醉,断头处死大鼠,手术剪剪开头颅,去除颅骨,暴露并完整取出脑组织,进行TTC染色:将脑组织从前脑额部沿冠状面向后连续切片,切片厚约为2 mm,迅速放入TTC染液中孵育30 min,观察各组大鼠脑组织的染色情况,鲜红色为正常脑组织,苍白色为梗死灶。随后将切片放入多聚甲醛中固定12 h,采用Image Pro Plus 6.0软件测量各组大鼠脑梗死体积,脑梗死体积=(缺血侧面积均值总和-对侧面积均值总和)×梗死脑组织厚度。
1.6 各组大鼠脑组织含水量测定建模24 h后,每组取15只大鼠,水合氯醛麻醉,经左心室灌注冰冷PBS液后快速断头,取出脑组织,电子天平上称量脑组织湿质量,将脑组织放入烤箱中烘烤24 h,取出称量脑组织干质量;称量3次取平均值,计算各组大鼠脑组织含水量。脑组织含水量=(脑组织质量-脑组织干质量)/脑组织湿质量×100%。
1.7 免疫组织化学染色测定各组大鼠缺血侧脑组织中皮质细胞凋亡率建模24 h后,每组取15只大鼠,水合氯醛深度麻醉,打开胸腔,暴露心脏,剪开右心耳,心尖插入留置针连接注射器,匀速注射生理盐水300 mL,至右心耳流出液体为无血色,四肢和两肺变白,肝脏变黄,则改为多聚甲醛注射300 mL至大鼠颈部和四肢僵硬,内脏变白,迅速断头,取出完整脑组织,置于多聚甲醛中继续固定24 h。将脑组织脱水,石蜡包埋,切成5 μm切片,将石蜡切片脱蜡至水,加入柠檬酸盐缓冲液进行抗原修复,用含羊血清封闭液封闭2 h,加入一抗TUNEL(稀释比例1:600)过夜孵育,加入二抗(稀释比例1:1 000)孵育2 h,加入DAPI染液染色8min,加入抗淬灭剂,荧光显微镜下观察见有荧光后,200倍视野下取5处大脑缺血侧脑组织拍照,采用Image J软件计算各组大鼠皮质细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.8 Western blotting法检测各组大鼠脑组织中Cleavedcaspase-3、Bax、Bcl-2、ERK1/2和p-ERK1/2蛋表达白水平建模24 h后,每组取15只大鼠,水合氯醛深度麻醉,断头处死大鼠,手术剪剪开头颅,去除颅骨,暴露并完整取出脑组织,去除小脑和枕叶,取缺血周围脑组织皮质部分,取50 mg脑组织加入含蛋白裂解液的匀浆器中匀浆,将匀浆液移至EP管中,离心(13 000 r·min-1)15 min,取上清液,BCA法检测脑组织蛋白浓度,制备聚丙烯酰胺凝胶,经过上样、电泳、转膜和封闭,加入一抗过夜孵育,以β-actin为内参照,复温1 h,加入二抗孵育1 h,加入ECL发光液发光,采用Quantity One软件测量各组蛋白条带灰度值,计算目标蛋白表达水平。目标蛋白表达水平=目标蛋白灰度值/β-actin条带灰度值。
1.9 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠神经功能障碍评分和脑梗死体积、脑组织含水量、缺血侧脑组织中皮质细胞凋亡率、脑组织中Cleavedcaspase-3、Bax、Bcl-2、ERK1/2和p-ERK1/2蛋白表达水平均符合正态分布,以x±s表示,多组间均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠神经功能障碍评分和脑梗死体积假手术组大鼠无神经功能障碍和脑梗死灶;模型组大鼠出现明显的神经功能障碍和脑梗死灶,表明缺血性脑卒中大鼠模型建立成功;大黄素组大鼠神经功能障碍评分和脑梗死体积均明显低于模型组(P < 0.05)。见表 1和图 1(插页二)。
| (n=15, x±s) | |||||||||||||||||||||||||||||
| Group | Neurological dysfunction score | Cerebral infarction volume(V/cm3) | |||||||||||||||||||||||||||
| Model | 2.86±0.54 | 38.76±12.53 | |||||||||||||||||||||||||||
| Emodin | 1.32±0.47 | 23.51±11.62 | |||||||||||||||||||||||||||
| t | 8.331 | 3.538 | |||||||||||||||||||||||||||
| P | 0.000 | 0.000 | |||||||||||||||||||||||||||

|
| A:Sham operation group; B:Model group; C:Emodin group. 图 1 各组大鼠脑组织形态表现(TTC,×400) Fig. 1 Morphology of brain tissue of rats in various groups(TTC, ×400) |
|
|
与假手术组比较,模型组和大黄素组大鼠脑组织含水量升高(P < 0.05);与模型组比较,大黄素组大鼠脑组织含水量降低(P < 0.05)。见表 2。
| (n=15, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Water content in braintissue | ||||||||||||||||||||||||||||
| Sham operation | 75.34±1.32 | ||||||||||||||||||||||||||||
| Model | 83.41±1.45* | ||||||||||||||||||||||||||||
| Emodin | 78.58±1.33*△ | ||||||||||||||||||||||||||||
| F | 132.198 | ||||||||||||||||||||||||||||
| P | 0.000 | ||||||||||||||||||||||||||||
| * P < 0.05 compared with sham operation group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
与假手术组比较,模型组和大黄素组大鼠缺血侧脑组织中皮质细胞凋亡率升高(P < 0.05);与模型组比较,大黄素组大鼠缺血侧脑组织中皮质细胞凋亡率降低(P < 0.05)。见表 3和图 2(插页二)。
| (n=15, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Apoptotic rate | ||||||||||||||||||||||||||||
| Sham operation | 1.13±0.24 | ||||||||||||||||||||||||||||
| Model | 11.52±0.37* | ||||||||||||||||||||||||||||
| Emodin | 4.62±0.28*△ | ||||||||||||||||||||||||||||
| F | 4 609.991 | ||||||||||||||||||||||||||||
| P | 0.000 | ||||||||||||||||||||||||||||
| * P < 0.05 compared with sham operation group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||

|
| A-C:Sham operation group; D-F:Model group; G-I:Emodin group.A, D, G:DAPI; B, E, H:TUNEL; C, F, I:Merge. 图 2 各组大鼠缺血侧脑皮质细胞凋亡形态表现(TUNEL, ×400) Fig. 2 Apoptoticmorphology of cells in ischemic cerebral cortex of rats in various groups (TUNEL, ×400) |
|
|
与假手术组比较,模型组和大黄素组大鼠缺血侧脑组织Cleavedcaspase-3和Bax蛋白表达水平升高(P < 0.05),Bcl-2蛋白表达水平降低(P < 0.05);与模型组比较,大黄素组大鼠缺血侧脑组织中Cleavedcaspase-3和Bax蛋白表达水平降低(P < 0.05),Bcl-2蛋白表达水平升高(P < 0.05)。见表 4和图 3。
| (n=15, x±s) | |||||||||||||||||||||||||||||
| Group | Cleavedcaspase-3 | Bax | Bcl-2 | ||||||||||||||||||||||||||
| Sham operation | 0.23±0.07 | 0.28±0.08 | 0.43±0.11 | ||||||||||||||||||||||||||
| Model | 0.47±0.11* | 0.59±0.12* | 0.12±0.06* | ||||||||||||||||||||||||||
| Emodin | 0.32±0.09*△ | 0.41±0.10*△ | 0.25±0.08*△ | ||||||||||||||||||||||||||
| F | 26.355 | 35.406 | 49.344 | ||||||||||||||||||||||||||
| P | 0.000 | 0.000 | 0.000 | ||||||||||||||||||||||||||
| * P < 0.05 compared with sham operation group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
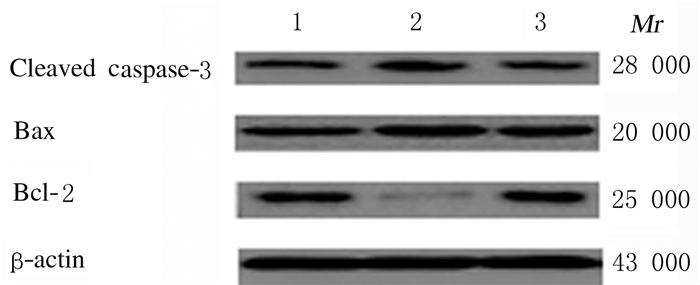
|
| Lane 1:Sham operation group; Lane 2:Model group; Lane 3:Emodin group. 图 3 Western blotting法检测各组大鼠缺血侧脑组织中Cleavedcaspase-3、Bax和Bcl-2蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of Cleavedcaspase-3, Bax and Bcl-2 proteins in ischemic brain tissue of rats in various groups detected by Western blotting method |
|
|
各组大鼠缺血侧脑组织中ERK1/2蛋白表达水平比较差异无统计学意义(P>0.05)。与假手术组比较,模型组和大黄素组大鼠缺血侧脑组织中p-ERK1/2蛋白表达水平升高(P < 0.05);与模型组比较,大黄素组大鼠缺血侧脑组织中p-ERK1/2蛋白表达水平降低(P < 0.05)。见表 5和图 4。
| (n=15, x±s) | |||||||||||||||||||||||||||||
| Group | ERK1/2 | p-ERK1/2 | |||||||||||||||||||||||||||
| Sham operation | 0.6±0.15 | 0.17±0.09 | |||||||||||||||||||||||||||
| Model | 0.73±0.13 | 0.82±0.14* | |||||||||||||||||||||||||||
| Emodin | 0.75±0.16 | 0.33±0.11*△ | |||||||||||||||||||||||||||
| F | 0.162 | 129.686 | |||||||||||||||||||||||||||
| P | 0.851 | 0.000 | |||||||||||||||||||||||||||
| * P < 0.05 compared with sham operation group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
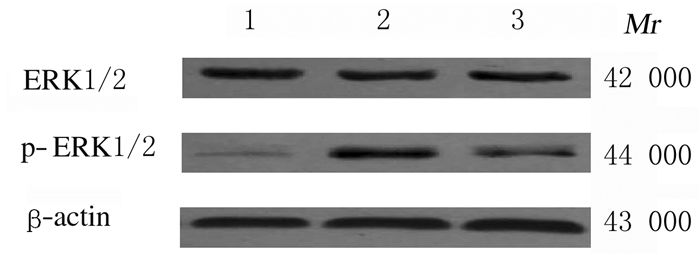
|
| Lane 1:Sham operation group; Lane 2:Model group; Lane 3:Emodin group. 图 4 Western blotting法检测各组大鼠缺血侧脑组织中ERK1/2和p-ERK1/2蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of ERK1/2 and p-ERK1/2 proteins in ischemic brain tissue of rats in various groups detected by Western blotting method |
|
|
缺血性脑卒中的发生是由于缺血引起大脑局部血流不足导致氧化应激反应和兴奋性毒性等复杂反应,激活小胶质细胞等细胞分泌趋化因子和细胞因子等炎症介质,炎症介质可升高血管内皮细胞的黏附分子,使血液来源的炎症细胞渗透到缺血性区域,浸润到缺血区域的白细胞可释放趋化因子及细胞因子,活化神经胶质细胞,破坏血脑屏障,引起脑水肿和神经细胞死亡,从而引发脑卒中[8]。神经细胞凋亡是缺血性脑卒中发生的主要机制之一,脑缺血损伤由于脑血流量中断或减少引起神经元凋亡和坏死,在比较严重的缺血和缺血中心处多发生神经元坏死,在缺血周边或比较缓和的缺血多发生神经细胞凋亡,缺血周边的神经细胞可存活多达数天,因此抑制缺血周边神经元的凋亡可有效改善脑损伤[9]。
caspase-3在细胞凋亡中具有重要作用,是凋亡的最终执行者,在凋亡的级联反应中居于核心地位[10]。细胞凋亡级联反应暴露线粒体途径和死亡受体途径,caspase-3正常情况下以无活性的酶原形式存在,在凋亡级联反应下被剪切活化为Cleaved caspase-3,因此抑制caspase-3活化可抑制细胞凋亡[11-12]。多种情况下Bax作为一非活性的单体形式存在于细胞质中,在接收到凋亡信号刺激后可发生分子构象变化,并移位插入到线粒体外膜,破坏线粒体膜,并且与抑制凋亡蛋白Bcl-2等对抗,通过影响线粒体信号通路促进细胞凋亡的发生[13-14]。Bcl-2具有抑制细胞凋亡的作用,可通过抑制谷胱甘肽外泄等控制膜电位抑制细胞凋亡;通过抑制凋亡诱导因子和细胞色素等促凋亡蛋白释放、介导线粒体外膜通透转运孔复合体的开放等阻滞凋亡进程;通过间接与胱冬肽酶作用阻断凋亡蛋白酶的激活使细胞免于死亡[15-16]。本研究结果显示:缺血性脑卒中模型大鼠出现明显的神经功能障碍和脑梗死灶,脑组织含水量升高,缺血侧脑皮质细胞凋亡率升高,缺血侧脑组织中Cleavedcaspase-3和Bax蛋白表达水平升高,Bcl-2蛋白表达水平降低, 表明脑缺血可引起脑组织水肿,促凋亡蛋白Bax表达水平升高,抗凋亡蛋白Bcl-2水平降低,Caspase-3被活化,从而引起神经元凋亡,导致神经功能障碍。既往研究[12]显示:Bcl-2家族蛋白可通过与孔蛋白相互作用,在线粒体膜上形成线粒体信号通路,使大量钙离子(Ca2+)内流,造成线粒体内膜膨胀,最终导致内膜破裂。而此过程中,抗凋亡因子Bcl-2可与抗凋亡蛋白形成异二聚体,保护细胞不进入凋亡程序,同时抑制Caspase激活,保护细胞不发生凋亡。
ERK1/2信号通路在细胞增殖和凋亡等过程中发挥重要作用[18-19],在神经系统发育和脑组织损伤过程中发挥重要作用,脑缺血损伤可激活ERK1/2信号通路,使ERK1/2磷酸化,p-ERK1/2可介导神经细胞炎症反应和神经细胞凋亡,药物作用可通过抑制ERK1/2信号通路活化,从而抑制神经细胞凋亡发挥神经保护作用[20]。本研究结果显示:缺血性脑卒中模型大鼠脑组织中p-ERK1/2蛋白表达水平升高,表明脑缺血可激活ERK1/2信号通路,激活的ERK1/2信号通路介导神经细胞凋亡,导致神经功能障碍的发生。
大黄为凉血、泻火药,具有抗毛细血管凝血、止血和抗炎等作用,大黄的主要有效成分为大黄素,其相对分子质量为270230,可以穿透血脑屏障,不溶于水,可通过多种信号通路在多种疾病的治疗中发挥重要作用。罗素等[21]发现:大黄素可通过抑制p38MAPK和ERK1/2在类风湿性关节炎成纤维样滑膜细胞中的表达发挥治疗类风湿性关节炎的作用;研究[22-23]显示:大黄素可通过抑制结肠癌细胞株HT-29细胞中p38和JNK磷酸化降低HT-29细胞中白细胞介素8(interleukin-8, IL-8)分泌, 大黄素对缺血性脑损伤具有神经保护作用,但其通过何种信号通路发挥作用尚不十分清楚。本研究结果显示:与模型组比较,大黄素组大鼠脑组织含水量降低,缺血侧脑组织皮质细胞凋亡率降低,缺血侧脑组织中Cleavedcaspase-3、Bax和p-ERK1/2蛋白表达水平降低,Bcl-2蛋白表达水平升高,表明大黄素可能通过抑制ERK1/2信号通路的激活,抑制神经细胞凋亡,减轻脑水肿,降低脑皮质细胞凋亡率,从而减轻脑损伤,降低神经功能障碍,发挥神经保护作用。
综上所述,大黄素对缺血性脑卒中具有神经保护作用,其机制可能为大黄素通过抑制ERK1/2信号通路减轻神经细胞凋亡。
| [1] |
SYLAJA P N, PANDIAN J D, KAUL S, et al. Ischemic stroke profile, risk factors, and outcomes in india[J]. Stroke, 2019, 49(1): 219-222. |
| [2] |
YANG H J, XI X X, ZHAO B, et al. KLF4 protects brain microvascular endothelial cells from ischemic stroke induced apoptosis by transcriptionally activating MALAT1[J]. Biochem Biophys Res Commun, 2018, 495(3): 2376-2382. DOI:10.1016/j.bbrc.2017.11.205 |
| [3] |
MA Y, XIA X, CHENG J M, et al. Emodin inhibits inducible nitric oxide synthase in a rat model of craniocerebral explosive injury[J]. Neurochem Res, 2014, 39(9): 1809-1816. DOI:10.1007/s11064-014-1395-y |
| [4] |
GUO H L, SHEN X R, XU Y, et al. Emodin prevents hypoxic-ischemic neuronal injury: Involvement of the activin A pathway[J]. Neural Regen Res, 2013, 8(15): 1360-1367. |
| [5] |
谭力, 王联英, 向海鹰, 等. 大黄素对脑缺血再灌注大鼠的保护作用及机制研究[J]. 中西医结合心脑血管病杂志, 2010, 8(9): 1100-1101. DOI:10.3969/j.issn.1672-1349.2010.09.043 |
| [6] |
LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. DOI:10.1161/01.STR.20.1.84 |
| [7] |
TALKE P, BICKLER P E. Effects of dexmedetomidine on hypoxia-evoked glutamate release and glutamate receptor activity in hippocampal slices[J]. Anesthesiology, 1996, 85(3): 551-557. DOI:10.1097/00000542-199609000-00014 |
| [8] |
BALAGANAPATHY P, BAIK S H, MALLILANKARAMAN K, et al. Interplay between Notch and p53 promotes neuronal cell death in ischemic stroke[J]. J Cereb Blood Flow Metab, 2018, 38(10): 1781-1795. DOI:10.1177/0271678X17715956 |
| [9] |
CHANG Q Y, LIN Y W, HSIEH C L. Acupuncture and neuroregeneration in ischemic stroke[J]. Neural Regen Res, 2018, 13(4): 573-583. DOI:10.4103/1673-5374.230272 |
| [10] |
ZHAO T F, FU Y X, SUN H, et al. Ligustrazine suppresses neuron apoptosis via the Bax/Bcl-2 and caspase-3 pathway in PC12 cells and in rats with vascular dementia[J]. IUBMB Life, 2018, 70(1): 60-70. DOI:10.1002/iub.1704 |
| [11] |
WEN H L, WU Z, HU H D, et al. The anti-tumor effect of pachymic acid on osteosarcoma cells by inducing PTEN and Caspase 3/7-dependent apoptosis[J]. J Nat Med, 2018, 72(1): 57-63. DOI:10.1007/s11418-017-1117-2 |
| [12] |
PANNEER SELVAM S, ROTH B M, NGANGA R, et al. Balance between senescence and apoptosis is regulated by telomere damage-induced association between p16 and caspase-3[J]. J Biol Chem, 2018, 293(25): 9784-9800. DOI:10.1074/jbc.RA118.003506 |
| [13] |
DANIELE S, PIETROBONO D, COSTA B, et al. Bax activation blocks self-renewal and induces apoptosis of human glioblastoma stem cells[J]. ACS Chem Neurosci, 2018, 9(1): 85-99. |
| [14] |
GUO X W, XIANG C X, ZHANG Z T, et al. Displacement of bax by BMF mediates STARD133'UTR-induced breast cancer cellsapoptosisin an miRNA-depedent manner[J]. Mol Pharm, 2018, 15(1): 63-71. |
| [15] |
EDLICH F. BCL-2 proteins andapoptosis: Recent insights and unknowns[J]. Biochem Biophys Res Commun, 2018, 500(1): 26-34. DOI:10.1016/j.bbrc.2017.06.190 |
| [16] |
PEÑA-BLANCOA, GARCÍA-SÁEZ A J. Bax, Bak and beyond-mitochondrial performance in apoptosis[J]. FEBS J, 2018, 285(3): 416-431. DOI:10.1111/febs.14186 |
| [17] |
张雯, 宋俊科, 杜冠华. 缺血再灌注损伤与细胞凋亡信号转导通路[J]. 中国药学杂志, 2015, 50(7): 565-569. |
| [18] |
PARK H, AHN S H, JUNG Y, et al. Leptin suppresses glutamate-induced? apoptosisthrough regulation of ERK1/2 signaling pathways in rat primary astrocytes[J]. Cell Physiol Biochem, 2017, 44(6): 2117-2128. DOI:10.1159/000485950 |
| [19] |
ELUKA-OKOLUDOH E, EWUNKEM A J, THORPE S, et al. Diepoxybutane-inducedapoptosis is mediated through the ERK1/2 pathway[J]. Hum Exp Toxicol, 2018, 37(10): 1080-1091. DOI:10.1177/0960327118755255 |
| [20] |
苏洲, 田小军, 王玉梅, 等. 依达拉奉对急性缺血性脑卒中患者丝裂原活化蛋白激酶/细胞外调节蛋白激酶信号通路蛋白表达的影响[J]. 中华老年医学杂志, 2018, 37(12): 1372-1375. DOI:10.3760/cma.j.issn.0254-9026.2018.12.019 |
| [21] |
罗素, 荣晓凤, 彭菲菲. 大黄素对TNF-α诱导的成纤维样滑膜细胞株MH7A细胞ERK1/2和p38MAPK的影响[J]. 免疫学杂志, 2017, 33(2): 113-117. |
| [22] |
王青, 周联, 董燕, 等. 大黄素对HT-29细胞MAPKs信号通路活化及IL-8分泌的影响[J]. 现代生物医学进展, 2011, 11(11): 2087-2089. |
| [23] |
杨海蕾, 陈晨, 屈秋民.社区脑卒中高危人群颈动脉粥样硬化与缺血性脑卒中的关系[J/OL].西安交通大学学报: 医学版, 2019[2019-11-18].http://kns.cnki.net/kcms/detail/61.1399.R.20191009.1055.006.htm
|
 2019, Vol. 45
2019, Vol. 45


