扩展功能
文章信息
- 杨丽娟, 夏雪怡, 王振江, 吴殿秀, 葛贺, 张莹, 林珈羽, 赵鹏, 荆琦, 张瀚元, 刘艳波
- YANG Lijuan, XIA Xueyi, WANG Zhenjiang, WU Dianxiu, GE He, ZHANG Ying, LIN Jiayu, ZHAO Peng, JING Qi, ZHANG Hanyuan, LIU Yanbo
- 17β-雌二醇对失血性休克家兔肠系膜微循环的改善作用及其机制
- Improvement effect of 17β-estradiol on intestinal mucosal microcirculation in rabbits with hemorrhagic shock and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1199-1205
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1199-1205
- 10.13481/j.1671-587x.20190602
-
文章历史
- 收稿日期: 2019-03-08
2. 北华大学护理学院, 吉林 吉林 132013;
3. 北华大学附属医院病理科, 吉林 吉林 132013
2. College of Nursing, Beihua University, Jilin 132013, China;
3. Department of Pathology, Affiliated Hospital, Beihua University, Jilin 132013, China
失血性休克(hemorrhagic shock,HS)的治疗一直是临床研究的热点,随着医学研究的不断深入,现有研究[1-2]表明在HS的初始阶段,肠是血液供应最先急剧减少的器官之一,进而引发缺血性或缺血再灌注性损伤;休克时细胞产生大量炎症因子和细胞因子,使病情更加严重,治疗更加复杂,部分患者的休克是不可逆的,病死率较高。目前临床治疗改善指征不再单一观察血压的回升,而微循环的恢复更加重要。如何尽早改善微循环,增加组织细胞的血液供应,是治疗休克的关键因素[3-4]。国内外研究[5-7]显示:17β-雌二醇具有改善急性脊髓损伤、骨周围血管微循环的作用,并能够减轻组织水肿和减少肠道细菌移位,但关于17β-雌二醇对HS肠系膜微循环改善作用及其相关机制的报道很少。本研究通过观察HS家兔肠系膜微循环变化,探讨血清中白细胞介素6(interleukin-6, IL-6)和乳酸水平的变化及组织中IL-6的表达和CD68巨噬细胞浸润情况,阐明17β-雌二醇对HS家兔肠系膜微循环的改善作用及其相关机制,为临床HS的辅助治疗提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器家兔32只,雌雄各半,体质量2.5~3.0 kg,4~6月龄,由吉林大学实验动物中心提供,动物合格证号:SCXK(吉)2016-0004。Anti-IL-6(NBP1-42846)为美国Novus Biologicals公司产品,Anti-CD68(sc-70761)由美国Santa Cruz Blotechnology公司生产,雌激素(CK-E80165R)试剂盒购自上海叶源生物公司,IL-6(JL12966)为江莱生物有限公司产品,乳酸试剂盒(LD:S019-2)为南京建成生物有限公司产品,17β-雌二醇购自上海麦克林公司(C10006919),山莨菪碱为江苏大红鹰恒顺药业有限公司产品。BI-2000医学图像分析系统(成都泰盟电子有限公司),Olympus显微镜成像系统(日本Olympus公司),Infinite 200分光光度计(奥地利TECAN公司),Centrifuge 5424高速离心机(德国Eppendorf公司)。
1.2 动物模型制备32只家兔随机分为模型组、生理盐水治疗组、山莨菪碱治疗组和17β-雌二醇预防组,每组8只。4组家兔均进行HS模型制备,休克Ⅱ期1 h后,分别采用不同的治疗方法:模型组家兔不进行治疗;生理盐水治疗组家兔不用药物干预,只给予生理盐水;山莨菪碱治疗组家兔休克Ⅱ期1 h后,静点山莨菪碱2.5 mg·kg-1,80滴·min-1;17β-雌二醇预防组家兔实验前1周,每隔1 d背部皮下注射500 μg 17β-雌二醇(采用二甲基亚砜配制)。术前12 h动物禁食,25%氨基甲酸乙酯耳缘静脉注射全身麻醉,行气管切开术,保持呼吸道通畅;采用Chaudry方法[8]制备失血性休克模型(采用颈动脉-颈静脉模型,从颈动脉放血,颈静脉输液,减少对家兔的创伤),静脉通路建立后,进行全身肝素化,2~3 mg·kg-1,留存休克前、休克Ⅱ期1 h、治疗后2 h的颈动脉血液样本。在家兔腹部左侧面切开约5 cm的切口,找到一段肠系膜(一般为回盲部肠系膜,因为此处肠系膜无蠕动),放在恒温(37.0℃±0.5℃)盛有生理盐水的恒温灌流盒中,将肠系膜平铺在圆形有机玻璃的凸形观察台上(抻拉肠袢时,动作要轻柔、缓慢,否则会直接造成动物疼痛性休克),采用BI-2000医学图像分析系统在显微镜下(×16)进行肠系膜微循环观察。对比家兔不同时期肠系膜微循环血流动力学的变化。
家兔安静5 min后,在颈动脉三通处接50 mL注射器,迅速放血至血压降至40 mmHg,并通过回输和抽血维持血压约为40 mmHg。维持1 h后,分别从颈静脉输血、输液进行治疗。模型组:不进行治疗;生理盐水治疗组:血液回输+补液(失血量的2倍);山莨菪碱治疗组:血液回输+2.5 mg·kg-1山莨菪碱+补液(失血量的2倍);17β-雌二醇预防组:血液回输+补液(失血量的2倍)。
1.3 各组家兔肠系膜微循环情况观察采用微循环仪观察各组家兔肠系膜血管和血管壁的变化、血流流态和血细胞的聚集情况。血液流态以权分值定量计算[9],即线形:0.00,线粒形:0.05,粒形:0.10,缓粒形:0.40,粒摆形:1.00,停滞形:1.50。流速快则权分值小,流速慢则权分值大。
1.4 各组家兔肠黏膜损伤观察实验结束后,家兔放血,取一段回肠(回盲部向上10 cm处取),4%甲醛固定,石蜡包埋,切片厚5 μm,HE染色,光学显微镜对比观察各组家兔肠黏膜的变化。采用Chiu氏6级评分法[10]评价家兔肠黏膜损伤程度:0分为正常黏膜,1分为绒毛顶端上皮下间隙增大,2分为上皮层和固有层中度分离,3分为绒毛两侧有大量分离伴有部分绒毛顶端破损,4分为绒毛破损伴有固有层毛细血管大量暴露,5分为固有层破坏、出血及溃疡。
1.5 免疫组织化学染色检测各组家兔肠黏膜组织中IL-6和CD68巨噬细胞阳性表达率采用双盲法阅片,由2名病理医师独立完成。免疫组织化学切片先在100倍镜选取热区,评分标准:①细胞染色强度。无染色0分,淡黄色1分,棕黄色2分,深褐色3分;②细胞阳性率。400倍光镜下随机选择5个视野,每个视野计数100个细胞,观察阳性细胞所占百分比。无阳性细胞为0分,阳性细胞数<25%判定为1分,26%~50%为2分,51%~74%为3分,>75%为4分。上述2项相加为最终判定标准,阴性:<2分;阳性:≥2分。
1.6 各组家兔血清17β-雌二醇、乳酸和IL-6水平检测各个节点留取血液样本,3 000 r·min-1离心10 min,留存血清。采用ELISA法分别在450、530和450 nm波长处测定各孔吸光度(A)值,检测各组家兔血清17β-雌二醇、乳酸和IL-6水平。
1.7 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组家兔肠黏膜血液流态,Chiu氏评分,CD68巨噬细胞阳性表达率及IL-6阳性表达率,血清17β-雌二醇、乳酸和IL-6水平均符合正态分布,以x±s表示,组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组家兔肠系膜微循环变化正常状态下家兔(血压95~125 mmHg,即各组家兔休克前均可观察到)肠系膜微循环血管壁光滑,壁薄,终末小血管血液充盈,丰富,血液呈线流,速度快,颜色鲜红,见图 1A(插页一);休克Ⅰ期(各组动物复制HS模型时可观察到,但是观察时间短暂,直接进入休克Ⅱ期),肠系膜微循环血流速度明显变慢,流态呈粒形或缓粒形,血液颜色变淡,血管充盈度差,血管壁清楚可见,终末小血管已出现断流现象,见图 1B(插页一);休克Ⅱ期1 h后,血管呈扩张状态,模型组家兔微循环血流完全瘀滞,流态呈停滞形,血液颜色发黑,呈缺氧状态,并黏附聚集,血管壁增厚、变形,见图 1C(插页一),终末小血管彻底断流;17β-雌二醇预防组家兔血液流态和血管变化总体优于模型组,还隐约可见终末小血管,血液黏附聚集在血管壁的程度较其他组别轻,见图 1D(插页一);治疗2 h后,生理盐水治疗组家兔肠系膜微循环血液流态部分呈粒流状态,终末小血管个数少;17β-雌二醇预防组家兔肠系膜微循环逐渐恢复,治疗过程中可见血液再灌注,淤积在血管内和血管壁上的血液团块被冲走,血管充盈,血液流态恢复,终末小血管逐渐恢复血流,见图 1E和F(插页一);山莨菪碱治疗组和17β-雌二醇预防组家兔血液流态明显优于生理盐水治疗组(P<0.05)。各组家兔肠系膜微循环各期血液流态见表 1。
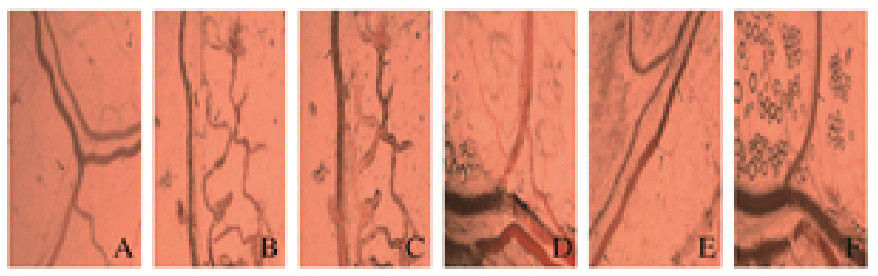
|
| A: Normal state; B: Hemorrhagic shock Ⅰ period; C: Model group(1 h after shock Ⅱ period); D: 17β-estradiol prevention group(1 h after shock Ⅱ period); E: Saline treatment group(2 h after treatment); F: 17β-estradiol prevention group(2 h after treatment). 图 1 微循环各时间点各组家兔肠系膜状态 Fig. 1 States of intestinal mucosa of rabbits in various groups at each time point of microcirculation |
|
|
| (n=8, x±s) | |||||||||||||||||||||||||||||
| Group | Blood flow state | ||||||||||||||||||||||||||||
| Pre-HS | 1 h after shock Ⅱ period | 2 h after treatement | |||||||||||||||||||||||||||
| Model | 0.02±0.03 | 1.40±0.28 | - | ||||||||||||||||||||||||||
| Saline treatment | 0.03±0.03 | 1.40±0.22 | 0.98±0.39 | ||||||||||||||||||||||||||
| Anisodamine treatment | 0.03±0.03 | 1.30±0.27 | 0.38±0.39* | ||||||||||||||||||||||||||
| 17β-estradiol prevention | 0.02±0.03 | 1.08±0.46 | 0.32±0.41* | ||||||||||||||||||||||||||
| * P < 0.05 vs saline treatment group;“-”: No data. | |||||||||||||||||||||||||||||
HE染色后光学显微镜下观察各组家兔肠黏膜的病理形态改变:模型组家兔可见黏膜腺体萎缩,绒毛柱状上皮细胞胞浆粉染、糜烂,大量细胞脱落,肠腔内散落的组织较多,见图 2A(插页一);生理盐水治疗组家兔可见肠黏膜上皮部分脱落、断裂,绒毛结构不完整,肠腔内有较多脱落的黏膜组织,见图 2B(插页一);山莨菪碱治疗组家兔可见腺体轻度萎缩,绒毛轻度水肿,固有层轻度分离,见图 2C(插页一);17β-雌二醇预防组家兔可见肠黏膜腺体大致正常,绒毛、固有层水肿。Chiu氏评分法评分:模型组家兔(4.14±0.69)分,生理盐水治疗组家兔(3.43±0.53)分,山莨菪碱治疗组家兔(2.43±0.54)分,17β-雌二醇预防组家兔(2.14±0.69)分;模型组家兔Chiu氏评分高于其他3组(P<0.05),生理盐水治疗组家兔Chiu氏评分高于17β-雌二醇预防组和山莨菪碱治疗组(P<0.05)。
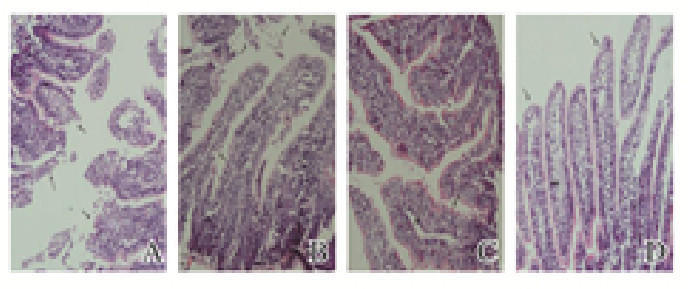
|
| A: Model group; B: Saline treatment group; C: Anisodamine treatment group; D: 17β-estradiol prevention group. 图 2 各组家兔肠黏膜组织形态表现(HE,×200) Fig. 2 Morphology of intestinal mucosa tissue of rabbits in various groups (HE, ×200) |
|
|
免疫组织化学结果显示:细胞浆表达棕黄色或棕黄色颗粒为阳性,IL-6主要分布在肠黏膜的黏膜层和黏膜下层。模型组和生理盐水治疗组家兔肠黏膜着色较深,属于强阳性,主要分布在黏膜下层、黏膜层和固有层,其IL-6阳性表达率明显高于山莨菪碱治疗组和17β-雌二醇预防组(P<0.05);山莨菪碱治疗组家兔肠黏膜组织中IL-6表达部位和17β-雌二醇预防组相近,主要在黏膜下层(P>0.05)。见图 3(插页一)和表 2。
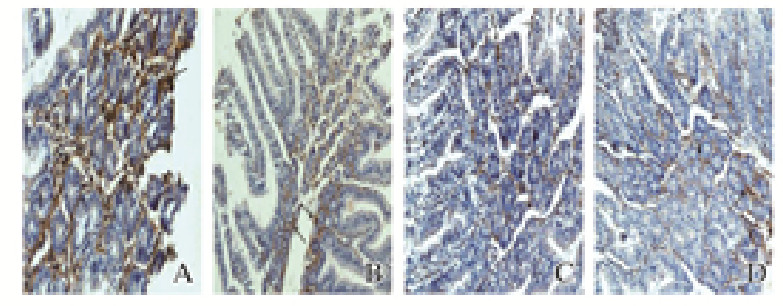
|
| A: Model group; B: Saline treatment group; C: Anisodamine treatment group; D:17β-estradiol prevention group. 图 3 各组家兔肠黏膜组织中IL-6的表达情况(免疫组织化学,×200) Fig. 3 Expressions of IL-6 in intestinal mucosa tissue of rabbits in various groups (Immunohistochemistry, ×200) |
|
|
| (n=8, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | IL-6 | CD68 | |||||||||||||||||||||||||||
| Model | 45.60±10.90 | 37.00±5.83 | |||||||||||||||||||||||||||
| Saline treatment | 25.60±5.60* | 18.40±6.56* | |||||||||||||||||||||||||||
| Anisodamine treatment | 14.60±6.77* | 13.00±4.36* | |||||||||||||||||||||||||||
| 17β-estradiol prevention | 15.80±5.26*△ | 11.40±5.94*△ | |||||||||||||||||||||||||||
| * P < 0.05 vs model group;△ P < 0.05 vs saline treatment group. | |||||||||||||||||||||||||||||
CD68阳性表达为胞浆棕黄色或棕黄色颗粒,CD68巨噬细胞主要浸润在固有层、黏膜下层和腺体层间质。模型组和生理盐水治疗组CD68巨噬细胞浸润程度强(P<0.05),主要集中在固有层及腺体层;山莨菪碱治疗组CD68的浸润程度强于17β-雌二醇预防组,但组间CD68巨噬细胞阳性表达率比较差异无统计学意义(P>0.05);17β-雌二醇预防组家兔肠黏膜组织中CD68巨噬细胞主要浸润在腺体层间质。见图 4(插页一)和表 2。
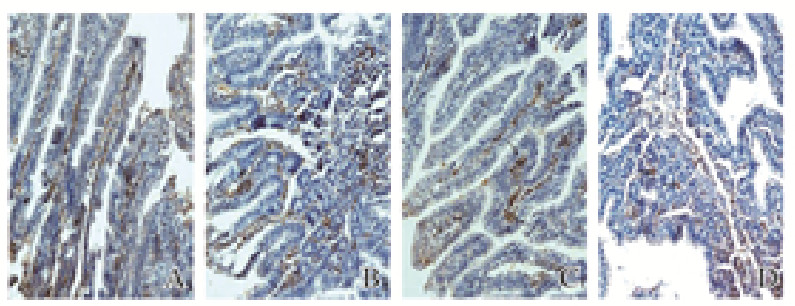
|
| A: Model group; B: Saline treatment group; C: Anisodamine treatment group; D:17β-estradiol prevention group. 图 4 各组家兔肠黏膜组织中CD68巨噬细胞浸润情况(免疫组织化学,×200) Fig. 4 Infiltration of CD68 macrophages in intestinal mucosa tissue of rabbits in various groups(Immunohistochemistry, ×200) |
|
|
17β-雌二醇预防组家兔血清17β-雌二醇水平明显高于其他组(P<0.05);实验前各组家兔血清乳酸水平比较差异无统计学意义(P>0.05),休克Ⅱ期1 h后,各组家兔血清乳酸水平明显升高,17β-雌二醇预防组家兔血清乳酸水平低于其他组(P<0.05);治疗后2 h,山莨菪碱治疗组和17β-雌二醇预防组家兔血清乳酸水平低于模型组(P<0.05)。实验前各组家兔血清IL-6水平比较差异无统计学意义(P>0.05),休克Ⅱ期1 h后,各组家兔血清IL-6水平明显升高,17β-雌二醇预防组家兔IL-6水平低于其他3组(P<0.05));治疗后2 h,山莨菪碱治疗组和17β-雌二醇预防组家兔IL-6水平低于生理盐水治疗组(P<0.05)。见表 3。
| (n=8, x±s) | |||||||||||||||||||||||||||||
| Groups | 17β-estradiol [ ρB/ (ng·L-1)] |
Lactic acid [cB/(mol·L-1)] | IL-6 [ρB/ (ng·L-1)] | ||||||||||||||||||||||||||
| Pre-HS | 1 h after shock Ⅱperiod | 2 h after treatment | Pre-HS | 1 h after shock Ⅱperiod | 2 h after treatment | ||||||||||||||||||||||||
| Model | 31.80±3.67 | 2.49±0.54 | 15.91±2.85 | 7.85±2.98 | 25.93±1.19 | - | - | ||||||||||||||||||||||
| Saline treatment | 32.04±5.77 | 2.58±0.91 | 15.09±3.47 | 7.97±1.26 | 24.75±1.06 | 6.42±2.63 | 23.70±2.11 | ||||||||||||||||||||||
| Anisodamine treatment | 29.23±8.63 | 2.04±0.99 | 16.99±3.03 | 7.34±3.30 | 23.85±2.11 | 4.89±1.30 | 20.09±2.62 | ||||||||||||||||||||||
| 17β-estradiol prevention | 44.48±8.79*△# | 1.81±0.95 | 15.49±2.36 | 5.11±1.89*△# | 21.01±2.12*△# | 3.57±1.43*# | 18.49±1.42△# | ||||||||||||||||||||||
| * P < 0.05 vs model group; △ P < 0.05 vs saline treatment group; # P < 0.05 vs anisodamine treatment group. “-”: No data. | |||||||||||||||||||||||||||||
HS为临床常见的急危重症,是创伤患者死亡的重要原因之一[11-13]。近些年对HS的研究取得了长足的进步,但重症休克的病死率仍居高不下。研究[3-4]表明:休克的发生发展伴随着微循环明显改变及大量炎症因子的渗出,针对这些病理生理改变的治疗研究正在不断深入。
雌激素是人体重要甾体激素,除维持女性生殖器官的发育与生理功能外,也参与机体代谢,影响多种细胞的修复和增殖,具有多种生物学活性。MATIUSHIN等[14]在1992年首次提出17β-雌二醇能够增强心肌收缩性、增加腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)生成、抑制脂质过氧化以及溶酶体酶的释放,使实验动物对HS的耐受性提高等。17β-雌二醇能维持创伤失血性休克(traumatic hemorrhagic shock, THS)脾脏的免疫功能,亦能减轻缺氧所带来的免疫抑制,维持THS红细胞的变形能力,保证其携氧的功能[15]。因此,17β-雌二醇可降低多器官功能衰竭的发生率。目前,国内外对雌激素在休克中的作用研究主要集中在免疫功能方面,对其改善微循环的具体作用及其机制尚未见报道。本研究通过BI-2000微循环观察仪观察HS过程中各组家兔肠系膜微循环发现:17β-雌二醇预防组和山莨菪碱治疗组家兔在HS治疗2 h后血液动力学改变明显优于生理盐水治疗组和模型组,说明17β-雌二醇有改善微循环的作用,其作用机制可能通过以下几方面来实现。
3.1 减少乳酸的生成乳酸是反映组织灌注和缺血程度的敏感指标[16]。本研究结果显示:17β-雌二醇预防组家兔在休克Ⅱ期1 h后血清乳酸水平较其他组低,但差异无统计学意义;休克治疗2 h后家兔乳酸水平较其他组低。17β-雌二醇通过雌激素受体(estrogen receptor,ER)及其相关的p38丝裂原活化蛋白激酶(mitogen-activated protein kinases, p38 MAPK)/血红素加氧酶1(heme oxygenase-1, HO-1)上调、改善线粒体功能、降低内质网应激与氧化应激及细胞凋亡等有关因素,保证了细胞的氧利用功能[17-18]。17β-雌二醇在HS时保证了红细胞的有效携氧能力[9]。上述研究均表明:HS时,17β-雌二醇可以改善细胞的氧供和氧利用,改善微循环,使得血清中乳酸水平降低。
3.2 对肠黏膜的保护作用本研究结果显示:17β-雌二醇预防组家兔肠黏膜只有轻度水肿,评分优于模型组和生理盐水治疗组;并且通过镜下观察肠系膜微循环在HS过程中血液流态的变化发现:17β-雌二醇预防组家兔血液流态在休克治疗2 h后权分值高于生理盐水治疗组。人和家兔体内的肠道平滑肌细胞及血管内皮细胞均含有特异的17β-雌二醇高亲合力受体,通过ER可介导血管扩张效应,如一氧化氮是较强的血管松弛因子,17β-雌二醇可以上调原生型一氧化氮合成酶活性,使其释放增加,来改善微循环,减轻肠黏膜损伤[19-20]。研究[21]表明:缺血再灌注损伤时,17β-雌二醇可增强微血管对苯肾上腺素和乙酰胆碱的应答,从而有助于再灌注期微血管功能的早期恢复。
3.3 抑制炎症因子的释放本研究结果显示:17β-雌二醇预防组家兔血清IL-6水平明显低于模型组和生理盐水治疗组;17β-雌二醇预防组家兔肠黏膜组织中IL-6和CD68巨噬细胞阳性表达率明显低于模型组和生理盐水治疗组。因为当HS发生时,肠黏膜的屏障功能下降,肠道细菌、内毒素可出现移位,进而进入血液循环,导致炎症反应。IL-6是目前发现的功能最广泛的炎性细胞因子之一,在炎症反应中具有致炎和抗炎的双向功能。HS时,内毒素可刺激单核-巨噬细胞浸润到炎症区,激活后释放大量细胞因子(包括IL-6),加重肠黏膜损伤,是直接反映休克严重程度的一种指标。CD68是巨噬细胞最可靠的标志物,所以本研究通过观察巨噬细胞在肠黏膜的浸润情况、IL-6在肠黏膜的表达情况以及IL-6在血清中水平变化,探讨17β-雌二醇是否通过抑制炎症因子的释放,改善肠黏膜微循环。研究[22]表明17β-雌二醇可降低肠道细菌位移的发生率,因此会降低炎症反应,炎症因子释放减少。CHEN等[23]研究显示:17β-雌二醇通过下调血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)和血管紧张素Ⅱ 1型受体(angiotensin Ⅱ type 1 receptor,AT1R)对肠道起保护作用,减轻肠道的损伤,降低炎症反应程度。
综上所述,17β-雌二醇对HS家兔肠黏膜有一定的保护作用,可改善肠系膜微循环,使其尽快复苏。随着对休克发生发展机制认识的不断深入,微循环已成为关注点,活体微循环观察是研究微循环血流动力学最基本的方法之一。但是由于本研究的肠系膜微循环是通过体外活体观察的,如要应用到临床进行无创或微创观察,还需相应的体内医疗仪器精准、敏感检测设备的开发及应用,其临床应用前景广泛。微循环检测加之改善微循环药物的应用,可以达到更好治疗效果。
| [1] |
MCKINLEY T O, MCCARROLL T, METZGER C, et al. Shock volume: patient-specific cumulative hypoperfusion predicts organ dysfunction in a prospective cohort of multiply injured patients[J]. J Trauma Acute Care Surg, 2018, 85(1S Suppl 2): S84-S91. |
| [2] |
GAO XY, TAO Q, ZHOU X, et al. Lactated ringer' solution may be superior to saline-based 6% hydroxyethyl starch 130/0.4 for early resuscitation within 12 hours from hemorrhagic shock[J]. J Invest Surg, 2018, 1-8. |
| [3] |
刘大为. 休克治疗:行走于微循环与细胞之间[J]. 中华危重病急救医学, 2013, 25(1): 2-4. |
| [4] |
王建枝, 钱睿哲. 病理生理学[M]. 9版. 北京: 人民卫生出版社, 2018: 168-181.
|
| [5] |
KNÖFERL M W, ANGELE M K, SCHWACHA M G, et al. Preservation of splenic immune functions by female sex hormones after trauma-hemorrhage[J]. Crit Care Med, 2002, 30(4): 888-893. |
| [6] |
LIU Z F, MU S Q, WANG X. Effect of estrogen on recovering the injured nervous system[J]. Pak J Pharm Sci, 2015, 28(4 Suppl): 1471-1475. |
| [7] |
PRISBY R D. Mechanical, hormonal and metabolic influences on blood vessels, blood flow and bone[J]. J Endocrinol, 2017, 235(3): R77-R100. DOI:10.1530/JOE-16-0666 |
| [8] |
CHAUDRY I H. Rat and mouse of hypovolemic-traumatic shock.Pathophysiology of shock, sepsis and organ failure[M]. Berlin: Springer-Verlag, 1993: 371.
|
| [9] |
CHIU C J, MCARDLE A H, BROWN R, et al. Intestinal mucosal lesion in low flow states[J]. Arch Surg, 1970, 101(4): 478-83. |
| [10] |
牛桂萍. 葛根素注射液对失血性休克家兔肠系膜微循环的影响[J]. 齐齐哈尔医学院学报, 2009, 30(12): 1427-1428. DOI:10.3969/j.issn.1002-1256.2009.12.008 |
| [11] |
JACOB M, KUMAR P. The challenge in management of hemorrhagic shock in trauma[J]. Med J Armed Forces India, 2014, 70(2): 163-169. |
| [12] |
STERZ J, BRITZ V, MÜNZBERG M, et al. Weighting of orthopaedics & trauma surgery in the medical state examination-comparison of the written examination with the national catalogue of learning objectives in surgery[J]. Z Orthop Unfall, 2018, 156(4): 393-398. DOI:10.1055/s-0044-100930 |
| [13] |
WAGENER B M, HU P J, OH J Y, et al. Correction:Role of heme in lung bacterial infection after trauma hemorrhage and stored red blood cell transfusion: a preclinical experimental study[J]. PLoS Med, 2019, 16(11): e1002991. DOI:10.1371/journal.pmed.1002991 |
| [14] |
MATIUSHIN A I. The protective role of estradiol under extreme conditions[J]. Biull Eksp Biol Med, 1992, 114(11): 497-500. |
| [15] |
MACHIEDO G W, ZAETS S, BEREZINA T, et al. Red blood cell damage after trauma-hemorrhage is modulated by gender[J]. J Trauma, 2004, 56(4): 837-844. DOI:10.1097/01.TA.0000058128.04007.90 |
| [16] |
李大鹏, 王永清, 张永军, 等. 创伤性失血性休克大鼠血乳酸水平动态测定及其临床价值推定[J]. 实用医药杂志, 2015, 32(9): 831-833. |
| [17] |
HSU J T, CHEN T H, CHIANG K C, et al. Role of p38 MAPK pathway in 17β-estradiol mediated attenuation of hemorrhagic shock-induced hepatic injury[J]. J Appl Physiol, 2015, 118(2): 187-192. DOI:10.1152/japplphysiol.00464.2014 |
| [18] |
SHEN S Q, ZHANG Y, XIONG C L. The protective effects of 17β-estradiol on hepatic ischemia-reperfusion injury in rat model, associated with regulation of heat-shock protein expression[J]. J Surg Res, 2007, 140(1): 67-76. |
| [19] |
冯丁雅, 赵自刚, 牛春雨. 雌激素减轻失血性休克器官损伤的作用与机制[J]. 中国病理生理杂志, 2018, 34(2): 364-370. DOI:10.3969/j.issn.1000-4718.2018.02.028 |
| [20] |
MENDELSOHN M E, KARAS R H. The protective effects of estrogen on the cardiovascular system[J]. N Engl J Med, 1999, 340(23): 1801-1811. DOI:10.1056/NEJM199906103402306 |
| [21] |
FERRER M, MEYER M, OSOL G. Estrogen replacement increases beta-adrenoceptor-mediated relaxation of rat mesenteric arteries[J]. J Vasc Res, 1996, 33(2): 124-131. DOI:10.1159/000159140 |
| [22] |
盛志勇, 李国平. 雌激素对创伤失血性休克肠道肠道细菌位移的影响[J]. 江西医学院学报, 2005, 45(2): 29-31. DOI:10.3969/j.issn.1000-2294.2005.02.009 |
| [23] |
CHEN J G, YANG S L, HU S H, et al. Estrogen prevents intestinal inflammation after trauma-hemorrhage via downregulation of angiotensin Ⅱ and angiotensin Ⅱ subtype Ⅰ receptor[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 295(5): G1131-G1137. |
 2019, Vol. 45
2019, Vol. 45


