扩展功能
文章信息
- 许会静, 刘晴, 闫冰, 刘微, 张磊, 郭健, 姜琳, 李淼, 孙美艳, 李艳
- XU Huijing, LIU Qing, YAN Bing, LIU Wei, ZHANG Lei, GUO Jian, JIANG Lin, LI miao, SUN Meiyan, LI Yan
- AQP4真核表达载体的构建和AQP4-M23蛋白在中国仓鼠肺细胞系V79中的表达
- Construction of eukaryotic expression vector of AQP4 and expression of AQP4-M23 protein in Chinese hamster lung cell line V79
- 吉林大学学报(医学版), 2019, 45(06): 1193-1198
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1193-1198
- 10.13481/j.1671-587x.20190601
-
文章历史
- 收稿日期: 2019-03-06
2. 吉林大学中日联谊医院神经外科, 吉林 长春 130033;
3. 吉林医药学院抗体中心, 吉林 吉林 132013
2. Department of Neurology, China-Japan Union Hospital, Jilin University, Changchun 130033, China;
3. Center of Antibody, Jilin Medical College, Jilin 132013, China
视神经脊髓炎(neuromyelitis optica,NMO)是一种特发性中枢神经系统炎性脱髓鞘疾病,典型特征为反复发作,病变主要侵犯视神经和脊髓,早期很少侵犯脑组织[1]。研究[2-5]表明:NMO的主要发病原因是在患者血清和脑脊液中出现了针对髓鞘星形胶质细胞膜上的水通道蛋白4(aquaporin 4,AQP4)的自身抗体NMO-IgG,NMO-IgG与AQP4结合导致星形胶质细胞膜上水通道蛋白(aquaporin, AQP)功能障碍而发病。因此阻断NMO-IgG与星形胶质细胞膜表面AQP4结合成为治疗NMO的新策略。基于这一策略, 研究者[6-7]合成了一种具有高亲和力、非致病性的单克隆抗体aquaporumab,其可以与致病性NMO-IgG抗体竞争性结合AQP4,从而达到缓解疾病的目的;但这些抗体可能激活补体系统产生NMO类似的病理变化,从而减弱其保护作用。因此,目前亟待研发毒性小、阻断效果明显的小分子化合物,尤其是直接作用于星型胶质细胞表面AQP4进而阻断NMO-IgG与AQP4结合的小分子化合物。NMO患者血清中NMO-IgG自身抗体能识别AQP4的3种胞外区多克隆混合物,研究者[8]利用表达AQP4的CHO细胞和重组单克隆抗体rAb-53通过检测辣根过氧化物酶催化红色荧光物质建立了筛选NMO小分子阻断剂的方法。CHO细胞生长缓慢、易粘连,因此以集群形式存在,其筛选效率和质量有一定的局限性。目前,国内外利用NMO患者血清通过电化学发光技术建立筛选NMO小分子阻断剂方法的研究尚未见报道。本研究构建表达hAQP4-M23的真核表达载体,并转染至生长迅速、不易粘连的V79细胞中,建立筛选NMO小分子阻断剂的V79-AQP4细胞系,为建立筛选NMO小分子阻断剂的筛选方法、分离出具有生物活性的天然小分子阻断剂和开发治疗NMO药物奠定基础。
1 材料与方法 1.1 细胞、质粒、主要试剂和仪器NMO患者血清样本来自北京宣武医院、辽宁省人民医院和吉林大学中日联谊医院。pGEMHE-hAQP4-M23质粒和V79细胞为意大利巴里大学Antonio Frigeri教授惠赠。DMEM高糖培养基(美国Sigma公司),pmCherry-N1(美国Clontech公司),脂质体LipofectamineTM2000(美国Invitrogen公司),TRIzol RNA分离试剂和逆转录试剂盒(日本TaKaRa公司),FITC荧光标记羊抗人IgG(武汉博士德公司)。细胞培养箱(美国Thermo公司), PCR仪(东胜创新科技仪器有限公司), Olympus DP 70显微镜(日本Olympus公司)。
1.2 引物设计和合成根据人类AQP4-M23编码区序列设计特异性引物,引物两端分别加上NheⅠ和BamHⅠ酶切位点和保护碱基,同时在设计下游引物时去掉终止密码子。上游引物P1:5′-CTAGCTAGCATGGTGGCTTTCAAAGGG-3′,下游引物P2:5′-CGGGATCCCGTACTGAAGACAATACCTC-3′。
1.3 pmCherry-N1 -hAQP4-M23真核表达载体构建和鉴定以pGEMHE-hAQP4-M23质粒为模板,P1和P2为引物,PCR扩增获得hAQP4-M23基因片段,并对PCR产物进行纯化。将表达载体pmCherry-N1和hAQP4-M23的PCR纯化产物分别用Nhe Ⅰ和BamH Ⅰ双酶切。酶切片段经Quick T4 DNA ligation室温连接,转化大肠杆菌DH5α,接种于培养板过夜培养,挑克隆,提质粒,经酶切和测序鉴定,阳性克隆命名为pmCherry-N1-hAQP4-M23重组质粒,应用去内毒素的质粒大量提取试剂盒提取质粒用于转染。
1.4 稳定表达hAQP4-M23的V79细胞系的建立将V79细胞随机分为对照组(未转染重组质粒的V79细胞)和转染组(转染重组质粒的V79细胞)。转染步骤按照LipofectamineTM2000说明书操作,将构建的载体pmCherry-N1-hAQP4-M23稳定转染入V79细胞。24 h后采用含G418(1 g·L-1)的完全培养基筛选培养。大多数未转染细胞在筛选过程中死亡,剩余细胞继续生长成单个克隆。待细胞达到60%以上汇合度后,取部分转染细胞进行RT-PCR实验,采用荧光实验检测hAQP4-M23基因的表达。
1.5 荧光显微镜检测2组细胞中hAQP4-M23基因的荧光表达因hAQP4-M23蛋白在细胞膜上形成典型的正交矩陈颗粒(OAP)结构,该结构在显微镜下呈现点状聚集状态,且蛋白C末端融合mCherry表达红色荧光,因此可直接在荧光显微镜下观察2组细胞膜是否清晰表达点状红色荧光。
1.6 RT-PCR法检测2组细胞中hAQP4-M23基因表达选取稳定转染的V79-AQP4细胞,按照TRIzol说明书提供的实验步骤提取细胞总RNA,利用PrimeScript® RT Reagent Kit,以提取的总RNA为模板逆转录反应合成cDNA。再以此cDNA为模板,进行PCR扩增,PCR产物经1%琼脂糖凝胶电泳检测,观察电泳结果是否与已知hAQP4-M23片段大小一致。
1.7 细胞免疫荧光法检测2组细胞中hAQP4-M23活性选取NMO患者血清中抗AQP4的抗体,通过细胞免疫荧光Triton X-100作用通透细胞膜10 min。3% BSA封闭液室温封闭30 min后加入患者血清,37℃孵育1 h。采用含钙离子(Ca2+)和镁离子(Mg2+)的PBS溶液检测2组细胞中hAQP4-M23的活性,具体方法:将稳定转染的细胞接种于6孔培养板中,PBS溶液(含Ca2+和Mg2+)洗涤细胞3次,以体积比为0.1%的溶液洗涤细胞3次,加入FITC标记的羊抗人二抗(1:200)室温孵育30 min。采用PBS溶液(含Ca2+和Mg2+)洗涤细胞3次。荧光显微镜观察对照组和转染组细胞的荧光形态及强度是否一致。
1.8 水通透性法检测2组细胞中hAQP4-M23活性本研究的水通透性测定使用钙黄绿素(calcein)荧光淬灭的方法:稳定转染的V79细胞铺于96孔培养板中,PBS(含Ca2+和Mg2+)洗涤2次后,加入calcein-AM(5 μmol·L-1),室温孵育15 min。弃去calcein,PBS(含Ca2+和Mg2+)洗涤2次后,加入50 μL等渗(300 mOsm)PBS溶液。Fluorstar荧光测定5.5 s后,自动向孔中加入50 μL高渗溶液,使孔中液体渗透压达到500 mOsm,继续测定30 s,生成全程曲线。荧光值从加液开始到淬灭最低为止所用的时间用τ表示,其倒数1/τ表示细胞的水通透性,以水通透性代表 2组细胞中hAQP4-M23的活性。
1.9 统计学分析采用SPSS 13.0统计软件进行统计学分析。对照组和转染组细胞中hAQP4-M23活性以x±s表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
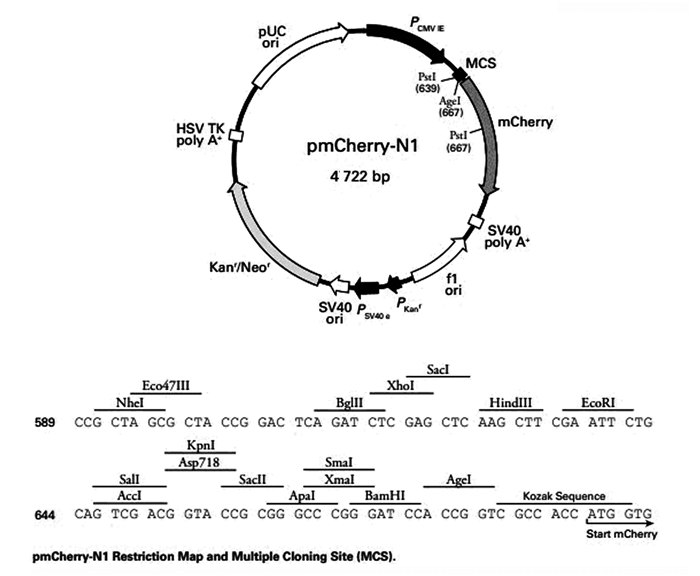
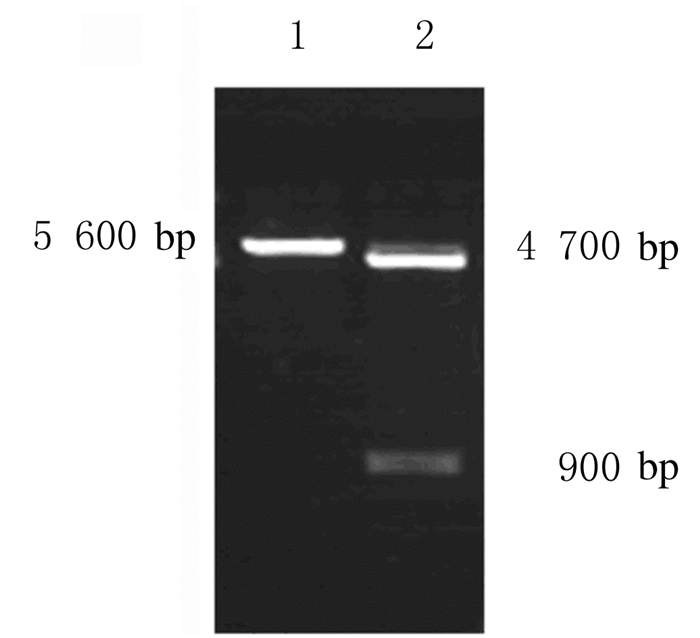
2 结果 2.1 pmCherry-N1-hAQP4-M23重组质粒的酶切鉴定采用Bam H Ⅰ单酶切鉴定,结果显示在5 600 bp处有1条清晰条带,与pmCherry-N1-hAQP4-M23大小一致,pmCherry-N1载体图谱见图 1;采用Nhe Ⅰ和Bam H Ⅰ进行双酶切鉴定,结果显示在4 700和900 bp处有2条清晰的电泳条带,分别与载体pmCherry-N1(图 1)和hAQP4-M23的大小一致,见图 2。
|
| 图 1 pmCherry-N1载体图谱 Fig. 1 Map of pmCherry-N1 vector |
|
|
|
| Lane 1:BamH Ⅰ single enzyme; Lane 2:Nhe Ⅰ and BamH Ⅰ double enzymes. 图 2 pmCherry-N1-hAQP4-M23酶切琼脂糖凝胶电泳图 Fig. 2 Agarose gel electrophoregram of enzyme digestion of pmCherry-N1-hAQP4-M23 |
|
|
测序结果显示pmCherry-N1-hAQP4-M23片段大小为900 bp,Blast对比分析结果显示:测序结果与GenBank中hAQP4-M23序列完全一致,表明hAQP4-M23基因成功克隆至载体pmCherry-N1中。
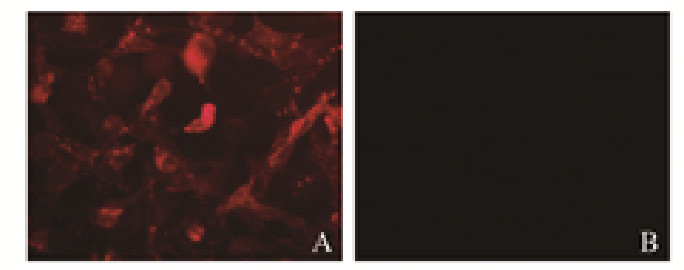
2.3 荧光显微镜检测2组细胞中hAQP4-M23基因的荧光表达将真核表达载体pmCherry-N1-hAQP4-M2转染至V79细胞中,应用荧光显微镜观察,转染组V79-AQP4细胞膜清晰表达红色荧光,镜下所见点状荧光聚集部位为AQP4-M23蛋白在细胞膜上形成的典型OAP结构(图 3A,见插页一);对照组细胞中未见红色荧光(图 3B,见插页一)。表明hAQP4-M23基因成功表达。
|
| A:Transfection group; B:Control group. 图 3 pmCherry-N1-hAQP4-M23转染V79细胞后2组细胞中hAQP4-M23基因荧光表达 Fig. 3 Fluorescence expressions of hAQP4-M23 in V79 cells in two groups after transfected with pmCherry-N1-hAQP4-M2 |
|
|
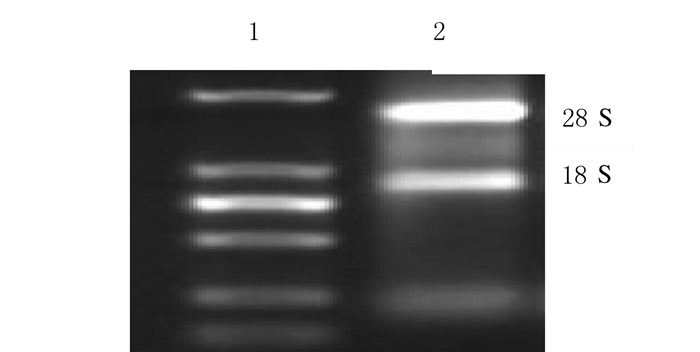
TRIzol法提取V79-AQP4细胞总RNA进行电泳检测,结果可见清晰RNA条带,见图 4。RT-PCR产物经琼脂糖电泳检测,结果可见与已知hAQP4-M23片段大小一致的清晰泳带,见图 5。表明稳定转染的V79-AQP4细胞在分子水平成功表达hAQP4-M23。
|
| Lane 1:RNA marker; Lane 2:V79-AQP4 cells. 图 4 V79-AQP4细胞中RNA琼脂糖凝胶电泳图 Fig. 4 Agarose gel electrophoregram of RNA in V79-AQP4 cells |
|
|

|
| Lane 1:V79-AQP4;Lane 2:hAQP4-M23. 图 5 V79-AQP4基因PCR扩增电泳图 Fig. 5 Electrophoregram of PCR amplification of V79-AQP4 gene |
|
|
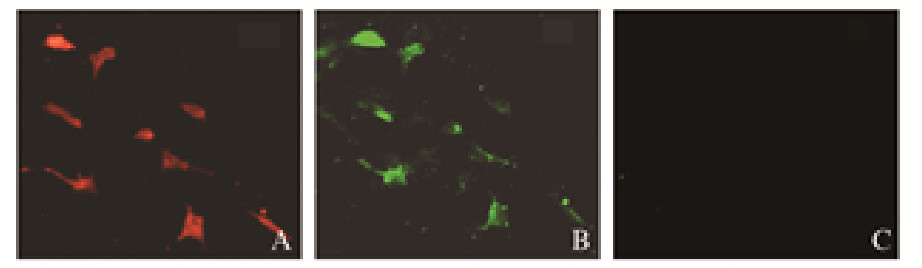
加入NMO患者血清和FITC标记羊抗人抗体的转染组细胞膜呈现绿色荧光,且存在正交列阵结构样的颗粒,并且荧光的形态与mCherry所发荧光高度一致(图 6A和B,见插页一),加入NMO患者血清和FITC标记羊抗人抗体的对照组细胞中无任何荧光(图 6C, 见插页一)。表明转染组细胞膜能与患者血清中成分结合,且hAQP4-M23具有较高活性。
|
| A: Transfection group (without serum of NMO patients); B: Transfection group (with serum of NMO patients); C: Control group (with serum of NMO patients). 图 6 细胞免疫荧光法检测各组V79-AQP4细胞中hAQP4-M23活性 Fig. 6 Activities of hAQP4-M23 in V79-AQP4 cells in various group detected by cell immunofluorescence method |
|
|
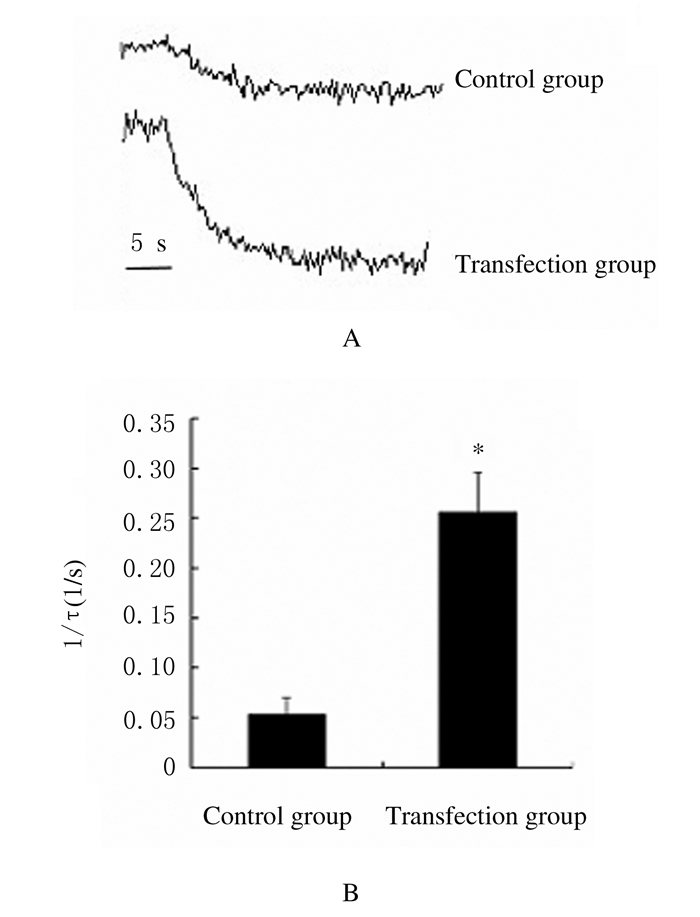
转染组细胞的calcein荧光值变化速率明显高于对照组(图 7A),calcein荧光值变化曲线1/τ表示细胞的水通透性。细胞渗透压在300~500 mOsm时,转染组细胞水通透性明显高于对照组(P < 0.05),表明V79-AQP4细胞膜透水性明显增加(图 7B), 即hAQP4-M23具有较高活性。
|
| *P < 0.05 vs control group.A: Curves of calcein fluorescence; B:Water permeability of cells. 图 7 水通透性法检测V79-AQP4细胞中hAQP4-M23活性 Fig. 7 Activities of hAQP4-M23 in V79-AQP4 cells detected by Osmotic water permeability assay |
|
|
AQP是一类特异性快速转运水分子的细胞膜通道类蛋白质, 其中AQP4在中枢神经系统星型胶质细胞膜上表达最丰富,其对维持脑内微环境稳定、调节神经纤维传导、诱导再生和自身免疫应答有重要作用[9-10]。AQP4主要有M1和M23 2个亚型,M23型在脑组织中含量最丰富,参与细胞膜上OAP的形成;而OAP对控制血-脑屏障通透性和NMO的病理过程具有重要作用[11]。
研究[12]表明:NMO病理过程主要是患者血清和脑脊液中NMO-IgG与AQP4-M23结合后激活补体系统,引起星形胶质细胞的毒性反应而发病。目前,NMO的主要治疗方案包括采用免疫抑制剂(糖皮质激素和硫唑嘌呤等)、免疫调节剂(利妥昔单抗和托珠单抗)、补体阻滞剂(依库珠单抗)[13-15]、血浆置换[16-17]和非致病性重组抗AQP4单克隆抗体[18-19]等方法。传统的糖皮质激素治疗主要是针对急性复发期的炎性反应,但对视网膜视神经节细胞的存活产生负面影响,且长期激素治疗不良反应较多[20]。硫唑嘌呤等抗代谢类免疫抑制剂也存在较多的不良反应,长期使用还会增加肿瘤发生的概率[21]。血浆交换治疗对于缓解患者的急性期症状有一定疗效,但并不能减轻神经功能缺损程度,且会引起贫血、血小板减少和增加感染等不良反应[22-23]。非致病性重组抗AQP4单克隆抗体虽能减轻补体或细胞介导的细胞毒反应,但抗体类药物存在生产工艺复杂、质量控制难度较大和成本高等缺点[18]。可见这些治疗方案存在特异性差和不良反应多的缺点,无法从根本上阻止NMO-IgG与AQP4结合引发的一系列病理过程。因此,目前亟待研发毒性小、可阻断NMO-IgG与AQP4结合的高特异性小分子化合物,这样不仅能有效地阻断由于抗原抗体结合诱发的一系列炎症反应,还可以与目前已经存在的针对NMO-IgG的药物联合应用,以达到更好的治疗效果。
本研究通过PCR扩增获得hAQP4-M23基因,并成功构建了pmCherry-N1-hAQP4-M23重组表达质粒,进而建立了表达hAQP4-M23的V79-AQP4细胞系。采用水通透性实验检测AQP4-M23蛋白活性结果表明:V79-AQP4细胞系表达较高活性AQP4-M23蛋白,成功建立了有效可行的小分子化合物阻断剂的细胞筛选模型。本课题组后续实验将利用该细胞模型对600种中药(约含有40 000种天然小分子化合物的组分库)进行筛选,得到活性确切的组分,并将活性组分进行处理分析以获得天然活性小分子化合物阻断剂。另外,本课题组后续实验拟在前期工作基础上明确具有阻断活性的天然小分子化合物的生物学活性和作用机制,为新药开发和指导NMO临床用药提供理论依据。
| [1] |
CROUT T M, PARKS L P, MAJITHIA V. Neuromyelitis optica (Devic's syndrome): an appraisal[J]. Curr Rheumatol Rep, 2016, 18(8): 54. DOI:10.1007/s11926-016-0599-3 |
| [2] |
BERNARD-VALNET R, LIBLAU R S, VUKUSIC S, et al. Neuromyelitis optica:A positive appraisal of seronegative cases[J]. Eur J Neurol, 2015, 22(12): 1511-1518. DOI:10.1111/ene.12679 |
| [3] |
RINGELSTEIN M, METZ I, RUPRECHT K, et al. Contribution of spinal cord biopsy to diagnosis of aquaporin-4 antibody positive neuromyelitis optica spectrum disorder[J]. Mult Scler, 2014, 20(7): 882-888. DOI:10.1177/1352458513510981 |
| [4] |
韩冰, 朱辉, 刘晶瑶. AQP4与NMO-IgG在视神经脊髓炎谱系疾病发病机制中的作用[J]. 中风与神经疾病杂志, 2017, 34(11): 1045-1046. |
| [5] |
SON M, KIM D, PARK K S, et al. Detection of aquaporin-4 antibody using aquaporin-4 extracellular loop-based carbon nanotube biosensor for the diagnosis of neuromyelitis optica[J]. Biosens Bioelectron, 2016, 78: 87-91. DOI:10.1016/j.bios.2015.11.029 |
| [6] |
TRADTRANTIP L, ZHANG H, SAADOUN S, et al. Anti-aquaporin-4 monoclonal antibody blocker therapy for neuromyelitis optica[J]. Ann Neurol, 2012, 71(3): 314-322. DOI:10.1002/ana.22657 |
| [7] |
KUROSAWA K, MISU T, TAKAI Y, et al. Severely exacerbated neuromyelitis optica rat model with extensive astrocytopathy by high affinity anti-aquaporin-4 monoclonal antibody[J]. Acta Neuropathol Commun, 2015, 3: 82. DOI:10.1186/s40478-015-0259-2 |
| [8] |
PHUAN P W, ANDERSON M O, TRADTRANTIP L, et al. A small-molecule screen yields idiotype-specific blockers of neuromyelitis optica immunoglobulin G binding to aquaporin-4[J]. J Biol Chem, 2012, 287(44): 36837-36844. DOI:10.1074/jbc.M112.408716 |
| [9] |
NAGELHUS E A, OTTERSEN O P. Physiological roles of aquaporin-4 in brain[J]. Physiol Rev, 2013, 93(4): 1543-1562. DOI:10.1152/physrev.00011.2013 |
| [10] |
谢屿平, 卢娉霞, 曹颖平. 视神经脊髓炎免疫学发病机制研究进展[J]. 国际检验医学杂志, 2019, 40(1): 107-111. DOI:10.3969/j.issn.1673-4130.2019.01.028 |
| [11] |
SAINI H, FERNANDEZ G, KERR D, et al. Differential expression of aquaporin-4 isoforms localizes with neuromyelitis optica disease activity[J]. J Neuroimmunol, 2010, 221(1/2): 68-72. |
| [12] |
PISANI F, SPARANEO A, TORTORELLA C, et al. Aquaporin-4 autoantibodies in neuromyelitis optica: AQP4 isoform-dependent sensitivity and specificity[J]. PLoS One, 2013, 8(11): e79185. DOI:10.1371/journal.pone.0079185 |
| [13] |
黄华生, 高玉娟, 韦仕荣, 等. 视神经脊髓炎谱系疾病缓解期修饰治疗的研究进展[J]. 卒中与神经疾病, 2016, 23(4): 293-298. DOI:10.3969/j.issn.1007-0478.2016.04.023 |
| [14] |
LEVIN M H, BENNETT J L, VERKMAN A S. Optic neuritis in neuromyelitis optica[J]. Prog Retin Eye Res, 2013, 36: 159-171. DOI:10.1016/j.preteyeres.2013.03.001 |
| [15] |
CARPANINI S M, TORVELL M, MORGAN B P. Therapeutic inhibition of the complement system in diseases of the central nervous system[J]. Front Immunol, 2019, 4(10): 362. |
| [16] |
KUMAR R, PAUL B S, SINGH G, et al. Therapeutic efficacy of plasma exchange in neuromyelitis optica[J]. Ann Indian Acad Neurol, 2018, 21(2): 140-143. DOI:10.4103/aian.AIAN_330_17 |
| [17] |
张玉凤, 杨佳. 血浆置换在神经脊髓炎相关视神经炎中的应用效果及影响因素分析[J]. 临床和实验医学杂志, 2018, 17(21): 2319-2323. DOI:10.3969/j.issn.1671-4695.2018.21.022 |
| [18] |
MIYAZAKI-KOMINE K, TAKAI Y, HUANG P, et al. High avidity chimeric monoclonal antibodies against the extracellular domains of human aquaporin-4 competing with the neuromyelitis optica autoantibody, NMO-IgG[J]. Br J Pharmacol, 2016, 173(1): 103-114. DOI:10.1111/bph.13340 |
| [19] |
TALLANTYRE E C, WHITTAM D H, JOLLES S, et al. Correction to: Secondary antibody deficiency: a complication of anti-CD20 therapy for neuroinflammation[J]. J Neurol, 2018, 265(5): 1123. DOI:10.1007/s00415-018-8833-8 |
| [20] |
MORROW M J, WINGERCHUK D. Neuromyelitis optica[J]. J Neuro Ophthalmol, 2012, 32(2): 154-166. DOI:10.1097/WNO.0b013e31825662f1 |
| [21] |
BIENIA B, BALABANOV R. Immunotherapy of neuromyelitis optica[J]. Autoimmune Dis, 2013, 741490. |
| [22] |
BONNAN M, VALENTINO R, OLINDO S, et al. Plasma exchange in severe spinal attacks associated with neuromyelitis optica spectrum disorder[J]. Mult Scler, 2009, 15(4): 487-492. DOI:10.1177/1352458508100837 |
| [23] |
HUANG T L, LIN K H, WANG J K, et al. Treatment strategies for neuromyelitis optica[J]. Ci Ji Yi Xue Za Zhi, 2018, 30(4): 204-208. |
 2019, Vol. 45
2019, Vol. 45


