扩展功能
文章信息
- 华进, 程志彬, 林春霖, 戴起宝, 朱广伟
- HUA Jin, CHENG Zhibin, LIN Chunlin, DAI Qibao, ZHU Guangwei
- 一种高效稳定的磷酸钙转染293T细胞方法的建立及评价
- Establishment and evaluation of a highly efficient and stable calcium phosphate transfection method for 293T cells
- 吉林大学学报(医学版), 2019, 45(05): 1177-1181
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1177-1181
- 10.13481/j.1671-587x.20190535
-
文章历史
- 收稿日期: 2019-01-19
2. 福建医科大学消化道恶性肿瘤教育部重点实验室, 福建 福州 350005
2. Key Laboratory of Gastrointestinal Cancer, Ministry of Education, Fujian Medical University, Fuzhou 350005 China
目前,将质粒DNA导入动物细胞的方法有很多,最常用的方法包括脂质体转染、电转法、显微注射法和磷酸钙共沉淀法等[1]。虽然脂质体转染方法已经普遍使用,且具有性质稳定和转染效率高等优点,但是价格较为昂贵;而磷酸钙转染的方法使用成本较低,对具体体系加以优化后,能够达到较好的转染效率,特别是对于293T细胞来说,与脂质体的转染效率无明显差异[2]。随着慢病毒感染技术的进一步发展,各种分子生物学技术及基因技术的改进,生命科学研究领域越来越多地应用到慢病毒包装技术,因此,建立起经济高效的293T细胞的转染方法至关重要。1973年,GRAHAM等[3]首次报道磷酸钙转染法。经过科学家的改进,磷酸钙转染法适用于大部分真核细胞DNA的转染,是一种高效经济且对细胞毒性小的真核细胞转染方法[4],其利用细胞的内吞作用将附着于细胞表面的磷酸钙-DNA沉淀复合物颗粒吸收到细胞内部,进而转染到细胞内部的DNA质粒等可以稳定地表达[5-7];但在实际应用过程中磷酸钙转染法会因转染条件、操作、细胞种类、试剂配置掌握和转染程序不同等会影响其转染效率[8-10]。由于脂质体转染试剂的应用使DNA质粒等转染细胞的效率明显提高[11-12],但其缺点是试剂昂贵。293T细胞是由人源肾上皮细胞系衍生所得,其作为工具细胞,具有生长繁殖速度快,营养要求低,可进行体外大规模培养的特点。随着现代分子生物学和病毒技术的发展,实验需要大量具有转染DNA质粒的293T细胞,以获得进一步研究的工具[13-15],因此高效的293T细胞的磷酸钙转染方法的建立具有重要的实际应用意义。本研究通过改良磷酸钙转染法(实验法)与传统磷酸钙转染法(传统法)从293T细胞的接种密度、质粒DNA的情况以及转染的方法进行研究,确定最佳的转染条件,建立一种高效、稳定的DNA磷酸钙转染方法。
1 材料与方法 1.1 载体、细胞、主要试剂和仪器反转录病毒表达载体pCDH-GFP-3xflag-TRAF6由本实验室构建保存;人胚肾细胞293T由福建医科大学消化道肿瘤重点实验室提供;DMEM、RPMI 1640、Opti-MEM培养基和胎牛血清(美国Gibco公司),NaCl[上海国药(集团)化学试剂有限公司],葡萄糖和KCl2[中国医药(集团)上海化学试剂公司],CaCl2·2H2O和Na2HPO4·12H2O[生物工程(上海)股份有限公司],HEPES(台湾VWR公司),单抗兔抗flag单克隆抗体(1:1000, 中国BOSIS公司),单抗小鼠抗β-actin(1:2000,美国Cell Signaling公司)。凝胶成像系统购于英国Syngene公司,无菌洁净工作台购于苏州净化设备有限公司,SHP-150型生化培养箱购于上海精宏实验设备有限公司,ZEISS Axiocam512倒置荧光显微镜购于德国Leica Microsystems公司。
1.2 细胞培养用DMEM培养基,并添加10%胎牛血清,在37℃、5%CO2培养箱中培养293T细胞。转染前1 d 293T细胞传代,重新种板,转染前细胞汇合度为40%~60%。
1.3 质粒来源和转染效率的计算本课题组构建了pCDH-GFP-3xflag-TRAF6质粒,由于质粒能够编码GFP蛋白,该蛋白在荧光显微镜下能够被激发出绿色荧光,可以作为比较转染效率的计数标志。荧光显微镜下观察转染24和48 h后293T细胞编码绿色荧光蛋白的细胞数目,计算其占相同视野下总的293T细胞数目的百分率,即为转染效率。
1.4 传统磷酸钙转染法转染293T细胞转染前1 h换新鲜无血清培养基,在5 mL的圆底试管底部加入25 μL摩尔浓度为2.5 mmol·L-1 CaCl2水溶液和2 μg pCDH-GFP-3xflag-TRAF6质粒,加入无菌水至220 μL,小心混匀,且在剧烈吹打下加入220 μL HEPES缓冲液;圆底试管垂直放在混旋器上混旋10 s,室温静置30 min;逐滴加入293T细胞,轻轻晃动混匀;8~12 h换含血清培养基,转染24和48 h后荧光显微镜下观察绿色荧光。相同方法处理pCDH-GFP-vector质粒。
1.5 改良磷酸钙转染法转染293T细胞染前1 h 293T细胞更换37℃预热的无血清培养基,在1.5 mL EP管中加入220 μL无菌水;在水中央加入2 μg pCDH-GFP-3xflag-TRAF6质粒;25 μL摩尔浓度为2.5mmol·L-1的CaCl2水溶液小心地加到EP管的底部,沿管壁小心逐滴加入250 μL HEPES缓冲液至液面;在CaCl2与上层溶液之间形成的分层处,用200 μL移液枪轻柔吹打,扰乱分界;室温放置30 min;逐滴加入293T细胞,轻轻晃动混匀;8~12 h换含血清培养基,24和48 h后荧光显微镜下观察绿色荧光。相同方法处理pCDH-GFP-vector质粒。
1.6 细胞转染效率的检测在相同的培养条件下,本实验独立重复3次,每次分别用上述2种方法进行实验;应用荧光倒置显微镜观察绿色荧光,确定转染效率;转染24和48 h后,在200倍视野下任取3个不重复视野,计算编码绿色荧光蛋白的细胞占相同视野中总的293T细胞数目的百分率即为转染效率。
1.7 Real-time PCR法检测293T细胞中肿瘤坏死因子受体相关因子6(TRAF6) mRNA表达水平pCDH-GFP-3xflag-TRAF6质粒转染293T细胞24和48 h后分别提取RNA,逆转录得到cDNA,各取逆转录得到的cDNA模板2.5μL, 在96微孔板上进行PCR反应,每孔取3个复孔对照,取平均值。应用ABI StepOne Real-Time PCR System (Applied Biosystems)仪器进行操作,试剂采用SYBR Premix Ex Taq Kit (日本TaKaRa公司)试剂盒。引物均委托福州铂尚生物技术有限公司合成。TRAF6引物:上游引物5′-TGGATGCCAAACCAGAGC-3′,下游引物5′-TCAAAGCGGGTGGAGACC-3′;GAPDH引物:上游引物5′-TGCACCACCAACTGCTTAGC-3′,下游引物5′-AGCTCAGGGATGACCTTGCC-3′。PCR反应条件:95℃、1 min,95℃、15 s,60℃、30 s,共40个循环。每对引物(基因)在每个模板中设3个重复孔,得到的Ct值取平均值;ΔCt=每个目的基因的Ct平均值-对应模板的内参基因(GAPDH)的Ct平均值,实验重复3次。ΔΔCt=实验组ΔCt值-对照组ΔCt值, 实验组和对照组中待测基因的倍数关系以2-ΔΔCt表示。
1.8 Western blotting法检测pCDH-GFP-3xflag-TRAF6质粒转染后293T细胞中flag蛋白表达水平293T细胞样本中加入细胞裂解液,待细胞完全裂解后提取细胞蛋白,BCA蛋白定量,样品使用10%SDS-聚丙烯酰胺凝胶电泳分离,每孔上样30 μg蛋白;电泳后转膜,缓冲液封闭,TBST洗涤3次,每次10 min,加入稀释好的单抗兔抗flag单克隆抗体和小鼠抗β-actin;4℃孵育过夜,TBST洗3次,每次15 min;加入稀释好的二抗,室温2 h,TBST洗涤3次,每次15 min。用ECL发光试剂盒进行化学发光检测,凝胶成像系统分析拍照,以β-actin为内参。
1.9 统计学分析采用GraphPad Prism 5统计软件进行统计学分析。2种转染方法的转染效率、TRAF6 mRNA和flag蛋白表达水平以x±s表示,2组间样本均数比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
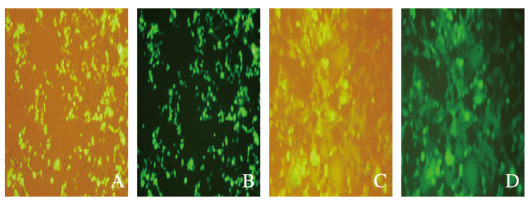
2 结果 2.1 荧光显微镜观察2种转染方法的转染效率转染24和48 h后,与传统磷酸钙转染法(49.3%± 7.02%和64.7%±11.9%)比较,改良磷酸钙转染法转染效率(69.3%±8.02%和94.3%±5.03%)明显升高(P < 0.05)。见图 1和2(插页六)。

|
| A, B: Traditional calcium phosphate transfection method; C, D:Improved calcium phosphate transfection method. 图 1 荧光显微镜观察2种磷酸钙转染方法转染293T细胞后24h时转染效率(×200) Fig. 1 Transfection efficiencies of two kinds of calcium phosphate transfection methods 24 h after transfection of 293T cells observed by fluorescence microscope (X200)(seen on page 1179 in paragraph) |
|
|
|
| A. B:Traditional calcium phosphate transfection method C, D:Improved calcium phosphate transfection method. 图 2 荧光显微镜观察2种磷酸钙转染方法转染293T细胞后48h时转染效率(×200) Fig. 2 Transfection efficiencies of two kinds of calcium phosphate transfection methods 48 h after transfection of 293T cells observed by fluorescence microscope (X200)(seen on page 1179 in paragraph) |
|
|
转染24和48 h后,改良磷酸钙转染法转染293T细胞中TRAF6 mRNA表达水平明显高于传统磷酸钙转染法(P<0.01)。见表 1。
| (n=3) | |||
| Method | TRAF6 mRNA | ||
| pCDH-GFP-vector | pCDH-GFP-3xflag-TRAF6 24 h(x±s) | pCDH-GFP-3xflag-TRAF6 48 h(x±s) | |
| Traditional calcium phosphate transfection | 1 | 2.4±0.3 | 3.0±0.9 |
| Improved calcium phosphate transfection | 1 | 3.3±0.4* | 5.4±0.6* |
| * P<0.01 compared with traditional calcium phosphate transfection method. | |||
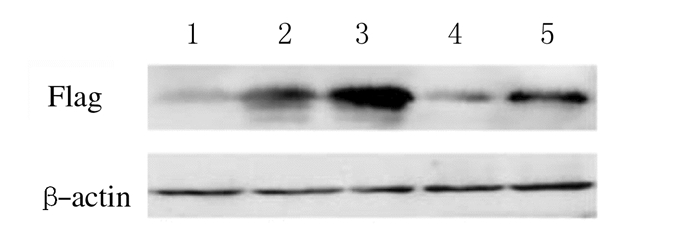
转染24和48 h后,改良磷酸钙转染法转染293T细胞中flag蛋白表达水平明显高于传统磷酸钙转染法(P<0.01)。见图 3和表 2。
| (n=3) | |||
| Method | Flag protein | ||
| pCDH-GFP-vector | pCDH-GFP-3xflag-TRAF6 24 h(x±s) | pCDH-GFP-3xflag-TRAF6 48 h(x±s) | |
| Traditional calcium phosphate transfection | 1 | 2.2±0.2 | 3.5±0.4 |
| Improved calcium phosphate transfection | 1 | 3.4±0.8* | 6.2±0.6* |
| * P<0.01 compared with traditional calcium phosphate transfection method. | |||
影响磷酸钙转染法转染效率的因素很多,如试剂配置的浓度和pH值等[16-17],因此本研究严格掌握实验试剂的配置方法,特别是pH值的大小和试剂的剂量要求。转染操作步骤严格按照参考文献[2]和本研究步骤。操作的不同点:①传统法要求混旋操作步骤,而本研究的操作步骤无混旋;②本研究操作只要求普通的EP管,传统法要求用圆底试管;③2种方法在质粒DNA、H2O、HEPES和CaCl2的加样方法中存在差别。转染24和48 h后荧光显微镜观察显示:传统磷酸钙转染法转染效率明显低于改良磷酸钙转染法转染效率,表明改良的磷酸钙转染法效率更高。
本研究构建的pCDH-GFP-3xflag-TRAF6质粒能够表达TRAF6 mRNA和flag标签蛋白。Real-time PCR法和Western blotting法分别检测2种转染方法转染后24和48 h293T细胞中TRAF6 mRNA和flag蛋白表达水平,结果显示2种方法转染效率不同。本研究结果表明:转染24和48 h,改良磷酸钙转染法转染后293T细胞中TRAF6 mRNA和flag蛋白相对表达水平明显高于传统磷酸钙转染法,表明改良磷酸钙转染法优于传统磷酸钙转染法。
|
| Lane 1: pCDH-GFP-vector; Lane 2, 4: pCDH-GFP-3axflag-TRAF6 24 h; Lane 3, 5: pCDH-GFP-3xflag-TRAF6 48 h; Lane 2, 3: Improved calcium phosphate transfection method; Lane 4, 5: Tranditional calcium phosphate transfection method. 图 3 Western blotting法检测2种磷酸钙转染法转染pCDH-GFP-3xflag-TRAF6质粒后293T细胞中flag蛋白表达水平 Fig. 3 Electrophoregram of expressions of flag protein in 293T cells after transfection of pCDH-GFP-3xflag-TRAF6 plasmid by two kinds of calcium phosphate transfection methods detected by Western blotting method |
|
|
综上所述,在传统磷酸钙转染法的基础上,经本研究改良的磷酸钙转染法具有更高的转染效率,且无特殊试管及设备的要求,更容易操作,为大规模的病毒包装提供更经济的方法学选择。
| [1] | RECILLAS T F. Multiple strategies for gene transfer, expression, knockdown, and chromatin influence in mammalian cell lines and transgenic animals[J]. Mol Biotechnol, 2006, 34(3): 337–354. DOI:10.1385/MB:34:3:337 |
| [2] | 唐蓓. 一种稳定且高效的磷酸钙293T细胞转染法[J]. 生物技术, 2011, 21(1): 49–51. |
| [3] | GRAHAM F L, VAN DER E B A J. A new technique for the assay of infectivity of human adenovirus 5 DNA[J]. Virology, 1973, 52(2): 456–467. |
| [4] | ZHAO D, WANG C Q, ZHUO R X, et al. Modification of nanostructured calcium carbonate for efficient gene delivery[J]. Colloid Surface B, 2014, 118: 111–116. DOI:10.1016/j.colsurfb.2014.03.007 |
| [5] | CHENUET S, MARTINET D, BESUCHET S N, et al. Calcium phosphate transfection generates mammalian recombinant cell lines with higher specific productivity than polyfection[J]. Biotechnol Bioeng, 2008, 101(5): 937–945. DOI:10.1002/bit.21972 |
| [6] | ALAM J, COOK J L. Reporter genes:application to the study of mammalian gene transcription[J]. Anal Biochem, 1990, 188(2): 245–254. DOI:10.1016/0003-2697(90)90601-5 |
| [7] | KWON M, FIRESTEIN B L. DNA transfection:calcium phosphate method[J]. Methods Mol Biol, 2013, 1018: 107–110. |
| [8] | DUDEK H, GHOSH A, GREENBERG M E. Calcium phosphate transfection of DNA into neurons in primary culture[J]. Curr Protoc Neurosci, 1998, 3(1): 3.11.1–3.11.6. DOI:10.1002/0471142301.ns0311s03 |
| [9] | GUO L, WANG L, YANG R, et al. Optimizing conditions for calcium phosphate mediated transient transfection[J]. Saudi J Biol Sci, 2017, 24(3): 622–629. DOI:10.1016/j.sjbs.2017.01.034 |
| [10] | SUN M, BERNARD L P, DIBONA V L, et al. Calcium phosphate transfection of primary hippocampal neurons[J]. J Vis Exp, 2013(81): e50808. DOI:10.3791/50808 |
| [11] | INOH Y, MIE N G, MATSUSHITA K, et al. Gene transfection efficiency into dendritic cells is influenced by the size of cationic liposomes/DNA complexes[J]. Eur J Pharm Sci, 2017, 102: 230–236. DOI:10.1016/j.ejps.2017.03.023 |
| [12] | VILLA-DIAZ L G, GARCIA PEREZ J L, KREBSBACH P H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix[J]. Stem Cells Dev, 2010, 19(12): 1949–1957. DOI:10.1089/scd.2009.0505 |
| [13] | SWIFT S, LORENS J, ACHACOSO P. Rapid production of retroviruses for efficient gene delivery to mammalian cells using 293T cell-based systems[J]. Curr Protoc Immunol, 1999: 10.17.14–10.17.29. DOI:10.1002/0471142735.im1017cs31 |
| [14] | MAO Y Y, YAN R H, LI A, et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells[J]. Int J Med Sci, 2015, 12(5): 407–415. DOI:10.7150/ijms.11270 |
| [15] | ALBRECHT C, HOSINER S, TICHY B, et al. Comparison of lentiviral packaging mixes and producer cell lines for RNAi applications[J]. Mol Biotechnol, 2015, 57(6): 499–505. DOI:10.1007/s12033-015-9843-8 |
| [16] | RIPPE A, BRENNER A, LEFFERT L. DNA-mediated gene transfer into adult rat hepatocytes in primary culture[J]. Mol Cell Biol, 1990, 10(2): 689–695. DOI:10.1128/MCB.10.2.689 |
| [17] | ZHOU Q, WANG Y, XIANG J J, et al. Stabilized calcium phosphate hybrid nanocomposite using a benzoxaborole-containing polymer for pH-responsive siRNA delivery[J]. Biomater Sci, 2018, 6(12): 3178–3188. DOI:10.1039/C8BM00575C |
 2019, Vol. 45
2019, Vol. 45


