扩展功能
文章信息
- 王爽, 康丽花, 关萌, 王磊, 李贝贝, 赵月, 宋艳秋, 杨婷婷
- WANG Shuang, KANG Lihua, GUAN Meng, WANG Lei, LI Beibei, ZHAO Yue, SONG Yanqiu, YANG Tingting
- 甲磺酸阿帕替尼联合化疗在晚期乳腺癌患者治疗中的临床应用
- Clinical application of apatinib mesylate combined with chemotherapy in treatment of patients with advanced breast cancer
- 吉林大学学报(医学版), 2019, 45(05): 1152-1158
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1152-1158
- 10.13481/j.1671-587x.20190530
-
文章历史
- 收稿日期: 2019-01-18
2. 吉林大学第一医院神经内科, 吉林 长春 130021
2. Department of Neurology, First Hospital, Jilin University, Changchun 130021, China
晚期乳腺癌是一种无法治愈性疾病[1],尤其经过多线药物治疗后,普遍存在耐药和无进展生存期(progression-free survival, PFS)逐渐缩短等问题,使得晚期乳腺癌的治疗面临巨大挑战,严重影响患者的生活质量和生存时间[2]。近年来,通过改善肿瘤微环境逆转耐药的个体化靶向治疗已逐渐应用于临床,抗血管生成药物是研究热点之一[3]。其中,甲磺酸阿帕替尼(简称阿帕替尼)作为我国自主研发的抗血管生成小分子酪氨酸激酶抑制剂[4],已被国家食品药品监督管理总局批准用于晚期胃腺癌或胃-食管结合部腺癌患者三线及以上治疗[5],临床试验[6]也已证实其在肺癌及肝癌中的疗效,但应用于乳腺癌治疗的研究国外无相关报道,国内研究也较少,且研究设计主要以单药治疗或某一分子亚型治疗为主。本研究针对的患者群体为各种分子亚型、且为三线及以上治疗的晚期乳腺癌患者,治疗方案为阿帕替尼联合化疗,主要研究阿帕替尼联合化疗治疗晚期乳腺癌的疗效和安全性,旨在探索针对肿瘤细胞和肿瘤微环境的双重干预在乳腺癌各种亚型治疗中的意义。
1 资料与方法 1.1 研究对象选择2017年3月—2018年5月在吉林大学第一医院肿瘤中心住院部接受阿帕替尼治疗的晚期乳腺癌患者25例作为研究对象。根据美国癌症联合委员会(AJCC)乳腺癌TNM分期及分子分型标准,通过临床或影像学证据发现有远处转移灶者判定为晚期乳腺癌;乳腺癌分子分型:①三阴型(基底样型),ER阴性、PR阴性和HER-2阴性;②Luminal型,ER阳性和(或)PR阳性,HER-2阴性;③HER-2阳性型,ER、PR阴性和(或)阳性,HER-2阳性。纳入标准:①经病理学及影像学确诊为晚期乳腺癌的患者,即经组织病理学确诊为乳腺癌,免疫组织化学明确分子分型,且影像学表现有远处转移的病灶;②根据实体瘤疗效评价标准1.1(RECIST 1.1)至少有1个可测量病灶;③多线治疗失败者[7],即出现复发转移后接受过二线及以上治疗方案,治疗失败,疾病发生进展;④未使用过其他抗血管生成药物;⑤美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0~2分;⑥无药物不可控制的高血压、Ⅱ级及以上冠心病、心律失常及心功能不全。所有患者均自愿服用阿帕替尼,采用阿帕替尼联合治疗,患者及家属均已签署相关知情同意书。排除标准:①口服阿帕替尼不足1个月者;②未进行疗效评估者。
1.2 治疗方法本研究入组的25例晚期乳腺癌患者均应用阿帕替尼联合化疗,治疗方案及剂量见表 1,其中紫杉类药物(紫杉醇、多西他赛和白蛋白紫杉醇)联合阿帕替尼治疗者10例(40%),长春瑞滨联合阿帕替尼治疗者7例(28%),卡培他滨联合阿帕替尼治疗者2例(8%),多西他赛和曲妥珠单抗联合阿帕替尼治疗者2例(8%),长春瑞滨和曲妥珠单抗联合阿帕替尼治疗者1例(4%),异环磷酰胺联合阿帕替尼治疗者1例(4%),依托泊苷联合阿帕替尼治疗者1例(4%),伊利替康联合阿帕替尼治疗者1例(4%)。因无法耐受化疗,紫杉类联合阿帕替尼组中改为氟维司群内分泌治疗联合阿帕替尼治疗者1例(4%),单药阿帕替尼治疗者5例(20%)。
| Treatment regimen and dosage | n(η/%) |
| Initial treatment regimen | |
| Apatinib+Taxane | 10(40) |
| Apatinib+Vinorelbine | 7(28) |
| Apatinib+Capecitabine | 2(8) |
| Apatinib+Taxane+Trastuzumab | 2(8) |
| Abapatinib+Vinorelbine+Trastuzum | 1(4) |
| Abapatinib+Isophosphamide | 1(4) |
| Abapatinib+Etoposide | 1(4) |
| Change of treatment regimen | |
| Apatinib+chemotherapy→apatinib | 5(20) |
| Apatinib+chemotherapy→apatinib+endocrinotherapy | 1(4) |
| Initial dose(mg) | |
| 500 | 4(16) |
| 425 | 8(32) |
| 250 | 13(52) |
| Sustain dose(mg) | |
| 500 | 2(8) |
| 425 | 7(28) |
| 250 | 16(64) |
| Dosage reduction(mg) | |
| 500→250 | 2(8) |
| 425→250 | 1(4) |
各种化疗药物及内分泌药物用法:紫杉醇175 mg·m-2,d1,静脉注射,21 d为一个周期;多西他赛75 mg·m-2,d1, 静脉注射,21 d为一个周期;白蛋白紫杉醇150 mg·m-2,d1和d8,静脉注射,21 d为一个周期;长春瑞滨25 mg·m-2,d1和d8,静脉注射,21 d为一个周期;卡培他滨1 250 mg·m-2,口服,每日2次,d1~14,21 d为一个周期;曲妥珠单抗首个疗程按照8 mg·kg-1,d1,静脉注射,之后每个疗程按照6 mg·kg-1,d1,静脉注射,21 d为一个周期;异环磷酰胺3 g·m-2,d1~3, 静脉注射,21 d为一个周期;依托泊苷100 mg,口服,d1~14,21 d为一个周期;伊立替康80 mg·m-2,d1、d8和d15,28 d为一个周期。氟维司群首月500 mg,d0、d15和d28, 肌肉注射,此后每28 d 500 mg,肌肉注射。
阿帕替尼用量按照患者ECOG评分0、1和2分,分别给予500、425和250 mg,每日1次口服,其中起始剂量为500 mg者4例(16%),425 mg者8例(32%),250 mg者13例(52%);维持剂量500 mg者2例(8%),425 mg者7例(28%),250 mg者16例(64%)。当出现3或4级不良反应时可减量,有3例患者(12%)减量,其中1例(4%)从425 mg降到250 mg,2例(8%)从500 mg降至250 mg。持续用药至病情进展、无法耐受不良反应或患者要求停药为止。
1.3 疗效评价标准及不良反应评价标准疗效评价按照RECIST 1.1评价标准[8]分为:完全缓解(completely response,CR),所有靶病灶消失,全部病理性淋巴结(靶结节和非靶结节)短直径必须减少至<10 mm;部分缓解(partial response,PR),靶病灶直径之和比基线水平减少至少30%;疾病进展(progressive disease,PD),以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参考,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照),除此以外,必须满足直径之和的绝对值增加至少5 mm,或出现1个或多个新发病灶;疾病稳定(stable disease, SD),靶病灶减小的程度未达到PR水平,增加的程度也未达到PD水平,介于两者之间,研究时可以直径之和的最小值作为参考。当实体瘤的直径之和达到CR、PR和SD时评定为药物有效,可以继续服用;当增加达到PD标准时评定为PD,停止用药。
PFS为自开始当前治疗直至PD、失访或死亡的时间。总有效率(overall response rate,ORR)为肿瘤缩小达到CR和PR的患者比例。临床获益率(clinical benefit rate,CBR)为肿瘤缩小达到CR、PR和SD,且维持时间超过6个月的患者比例。
不良反应评价按照国家通用研究所毒副反应标准4.0(National Cancer Institute Common Toxicity Criteria Version4.0, NCI-CTC4.0)[9]进行评估,分为1~4级。当不良反应等级达到3或4级,积极对症处理后症状未减轻者,建议停止用药。
1.4 随访采用电话和定期复诊的随访形式,要求患者每周测量血压1次,每3周复查血常规、肝肾功能和尿常规等实验室指标,每6周行CT或增强CT扫描。随访内容:目前治疗情况、疾病出现进展的时间、目前生存情况和生存时间,随访截止时间为2018年12月31日,无失访病例,随访时间为2~18个月,中位随访时间为9个月,95%可信区间(confidence limit, CI)为8.06~9.94个月。
1.5 统计学分析采用SPSS 23.0统计软件进行统计学分析。采用Fisher确切概率法分析不同年龄、ECOG评分、病理类型、转移部位、既往治疗线数、起始量、维持剂量及是否联合化疗患者之间近期疗效的差异,采用Kaplan-Meier法计算中位无进展生存时间(median progression-free survival, mPFS)。以P<0.05为差异有统计学意义。
2 结果 2.1 一般资料① 本组患者均为女性,年龄30~68岁,中位年龄52岁。②ECOG评分0或1分者15例(60%),2分者10例(40%)。③三阴型5例(20%),Luminal型12例(48%),HER-2阳性8例(32%)。④有肺脏、肝脏和脑部等重要脏器转移者19例(76%),其他部位(骨、胸壁、原位或对侧乳腺、单侧或双侧锁骨上下淋巴结、纵隔淋巴结和骨髓)转移6例(24%)。⑤阿帕替尼作为三线治疗者5例(20%),四线治疗者7例(28%),五线及以上者13例(52%)。见表 2。
| Feature | n(η/%) |
| Age(year) | |
| <50 | 11(44) |
| ≥50 | 14(56) |
| ECOG | |
| 0-1 | 15(60) |
| 2 | 10(40) |
| Pathological type | |
| Triple-negative | 5(20) |
| Luminal | 12(48) |
| HER-2 positive | 8(32) |
| Number of therapy lines | |
| 3 | 5(20) |
| 4 | 7(28) |
| ≥5 | 13(52) |
| Metastatic site | |
| Liver/Lung/Brain | 19(76) |
| Others | 6(24) |
对25例患者进行近期疗效评价:CR 0例,PR 3例(12%), SD 10例(40%),PD 12例(48%);ORR为12%(3/25),95%CI为0%~20%;CBR为52%(13/25),95%CI为31%~72%。①治疗线数评价:阿帕替尼三线治疗的5例患者中,SD 2例,PD 3例,CBR为40%(2/5),95%CI为5%~85%;四线治疗的7例患者中,PR 2例,SD 2例,PD 3例, CBR为57%(4/7),95%CI为18%~90%;五线及以上治疗的13例患者中,PR 1例,SD 6例,PD 6例,CBR为54%(7/13),95%CI为25%~81%。②病理类型评价:三阴型患者共5例,SD3例,PD 2例,CBR为60%(3/5),95%CI为15%~95%;Luminal型患者共12例,PR 1例,SD 2例,PD 9例,CBR为25%(3/12),95%CI为5%~57%;HER-2阳性型患者共8例,PR 2例,SD 5例,PD 1例,CBR为88%(7/8),95%CI为47%~100%。见表 3。Fisher确切概率法检验结果显示:50岁以上患者组近期疗效优于50岁以下患者组(P<0.05),其余不同ECOG评分、病理类型、转移部位、既往治疗线数、起始量、维持剂量及是否联合化疗之间近期疗效比较差异无统计学意义(P>0.05)。见表 4。
| Group | Total (n) |
PR+SD≥6 months (n) |
PD (n) |
CBR(η/%) | |
| Rate | 95%CI* | ||||
| Number of therapy lines | |||||
| 3 | 5 | 2 | 3 | 40 | 5-85 |
| 4 | 7 | 4 | 3 | 57 | 18-90 |
| ≥5 | 13 | 7 | 6 | 54 | 25-81 |
| Pathological type | |||||
| Triple-negative | 5 | 3 | 2 | 60 | 15-95 |
| Luminal | 12 | 3 | 9 | 25 | 5-57 |
| HER-2 positive | 8 | 7 | 1 | 88 | 47-100 |
| *95%CI was obtained by look-up table method. | |||||
| [n(η/%)] | ||||
| Feature | PR+SD ≥6 months |
PD | χ2 | P* |
| Age(year) | ||||
| <50 | 3(27) | 8(73) | - | 0.017 |
| ≥50 | 11(79) | 3(21) | ||
| ECOG | ||||
| 0-1 | 9(60) | 6(40) | - | 0.697 |
| 2 | 5(50) | 5(50) | ||
| Pathological type | ||||
| Triple-negative | 3(60) | 2(40) | 2.721 | 0.267 |
| Luminal | 6(43) | 8(57) | ||
| HER-2 positive | 5(83) | 1(17) | ||
| Number of therapy lines | ||||
| 3 | 2(40) | 3(60) | 0.809 | 0.865 |
| 4 | 4(57) | 3(43) | ||
| ≥5 | 8(62) | 5(38) | ||
| Metastatic site | ||||
| Liver/Lung/Brain | 11(55) | 9(45) | - | 1.000 |
| Others | 3(60) | 2(40) | ||
| Initial dose(mg) | ||||
| 500 | 3(75) | 1(25) | 0.769 | 0.749 |
| 425 | 4(50) | 4(50) | ||
| 250 | 7(54) | 6(46) | ||
| Sustain dose(mg) | ||||
| 500 | 2(100) | 0(0) | 1.753 | 0.472 |
| 425 | 3(43) | 4(57) | ||
| 250 | 9(56) | 7(44) | ||
| Change of treatment regimen | ||||
| Apatinib+chemotherapy | 8(42) | 11(58) | - | 0.097 |
| Others | 5(80) | 1(20) | ||
| *P value was obtained by Fisher test.“-”:No data. | ||||
采用Kaplan-Meier法对25例复发转移乳腺癌患者进行生存分析,mPFS为6.00(95%CI:5.18~6.82)个月。见图 1。
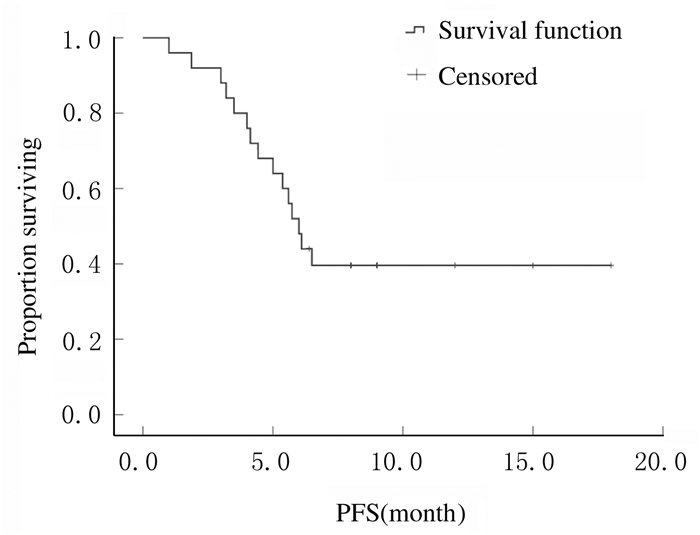
|
| 图 1 阿帕替尼治疗后晚期乳腺癌患者生存曲线 Fig. 1 Survival curves of patients with advanced breast cancer after apatinib treatment |
|
|
对25例晚期乳腺癌患者进行不良反应评价,主要出现的不良反应为乏力、食欲不振、恶心、腹泻、血压升高、口腔溃疡、手足综合征、肝功能异常和低蛋白血症等。见表 5。当患者出现3或4级手足综合征、高血压、蛋白尿和腹泻时,阿帕替尼减量至250 mg·d-1或暂停用药后症状减轻。血液学毒性考虑由于化疗药所致,经停药、改变治疗或对症支持治疗后好转。25例可评价患者中不良反应发生例数较多,但多为1或2级不良反应,经对症支持治疗后均可耐受。
| [n(η/%)] | |||
| Adverse reaction | Grade 1-2 | Grade 3-4 | Total |
| Fatigue | 14(56) | 7(28) | 20(80) |
| Hypoproteinemia | 15(48) | 0(0) | 15(60) |
| Hand-foot syndrome | 10(40) | 5(20) | 15(60) |
| Hepatic insufficiency | 14(56) | 1(4) | 15(60) |
| Anemia | 13(52) | 0(0) | 13(52) |
| Anepithymia | 11(44) | 0(0) | 11(44) |
| Hypertension | 9(36) | 1(4) | 10(40) |
| Diarrhea | 8(32) | 0(0) | 8(32) |
| Proteinuria | 7(28) | 0(0) | 7(28) |
抗血管生成治疗是针对肿瘤微环境治疗的一个重要领域[10],在既往研究中阿帕替尼单药治疗晚期转移性三阴型乳腺癌疾病控制率和客观缓解率分别为25.0%和10.7%,mPFS和OS分别为3.3和10.6个月。单药治疗晚期非三阴性乳腺癌患者的临床研究[11-12]也得出类似结果。
不同于以往阿帕替尼单药治疗的研究,本研究针对多线治疗失败的耐药乳腺癌患者给予阿帕替尼联合化疗,对入组的25例患者疗效进行分析显示:客观缓解率为12%,CBR为52%,mPFS达6个月,且耐受性良好。既往研究报道三线及以上治疗失败的复发转移性乳腺癌患者,应用单药化疗客观缓解率约为10%,mPFS约为4个月,而阿帕替尼联合治疗的mPFS有所延长,对存在耐药的晚期乳腺癌患者也有良好的疗效[13-14]。
亚组分析:入组患者均为接受过多线治疗的晚期乳腺癌患者,五线及以上治疗患者的CBR达到54%,提示即使出现多药耐药,联合应用抗血管生成药物和抗肿瘤药物仍可取得较好疗效。本研究初步分析不同分子亚型对该治疗方案的反应性,其中三阴亚型CBR为60%,mPFS为6.1个月,高于既往研究[11-12]报道中阿帕替尼单药治疗的CBR(10.7%)和mPFS(3.3个月);非三阴型晚期乳腺癌患者的CBR为50%,mPFS为5.7个月,同样高于既往单药研究[11-12]中CBR(16.7%)和mPFS(4个月)。不同分子亚型的疗效较以往单药治疗均有所提高。其中值得关注的是HER-2阳性患者的疗效,根据患者病情或经济情况联合化疗或抗HER-2治疗,CBR高达88%(7/8),提示对于出现耐药的HER-2阳性患者,阿帕替尼联合治疗仍有效。由此可见,阿帕替尼联合治疗对所有亚型乳腺癌患者均呈现较好的疗效。转移部位:10例患者存在软组织转移,经治疗后软组织转移病灶均表现一定程度的缩小,胸壁广泛结节转移也呈现病变改善及范围缩小。其中1例HER-2阳性患者使用多西他赛联合曲妥珠单抗方案治疗,2个疗程后胸壁肿物无缩小,且肿块出现红肿、增大趋势,加用阿帕替尼2个疗程后肿块红肿明显缓解,缩小达到PR。包含阿帕替尼的化疗方案可明显改善由脑转移本身或脑放疗后引起的脑水肿[15]。5例脑转移伴脑水肿患者,在阿帕替尼治疗后症状均明显改善,2例患者经影像学检查证实病灶缩小,水肿明显减退。其中1例HER-2阳性脑转移患者在接受脑部放疗10个月后出现进行性失语、肢体活动障碍和间歇性抽搐,颅脑MRI检查显示大范围脑周水肿。高剂量甾体类药物和脱水治疗均无改善,加用阿帕替尼后,仅10 d所有不适症状消失,5周后MRI检查结果提示水肿明显吸收。以上2个病例分析结果显示:阿帕替尼对脑转移的颅内水肿有缓解作用。结合既往研究[16-17]及本研究推测:阿帕替尼在晚期乳腺癌患者的治疗中显示出良好的疗效,尤其对一些特定转移部位疗效显著,可明显改善患者的生活质量,使肿瘤得到长时间控制。
本研究结果显示:10例评价为SD的患者有3例靶病灶有所缩小,但未达到30%,按照RECIST1.1标准只能评价为SD,但影像学检查结果显现出病灶坏死、空洞改变或边缘规整等迹象,对于这类患者仅用RECIST1.1标准评价长径变化不甚全面[17],在继续治疗过程中需要探讨更精确和适用性更强的评价标准[18]。
本研究评价了25例晚期乳腺癌患者的不良反应及安全性,不良反应事件发生种类及发生率与既往阿帕替尼临床研究报道基本相符,未发现新的及不可控的不良反应,多为1或2级不良反应,对症支持治疗后可耐受。也有部分患者不良反应达到3级,暂停用药或减量后积极治疗均可缓解,无不良反应相关性死亡,治疗毒性基本可控,安全性较高。乏力和食欲不振等不良反应的症状明显影响患者生活质量,且无较直接有效的治疗方法,仅能通过减量予以改善。由于阿帕替尼多用于多线治疗后晚期乳腺癌患者,身体状态及对药物耐受性相对较差,不良事件发生率及等级较高,若将阿帕替尼在治疗中的应用线数提前,可能会有所改善[19-20]。因此在治疗过程中除认真监测药物毒性外,也要关注患者的生活质量,积极对症支持治疗,调整治疗方案及剂量,提高患者依从性以保证治疗效果及安全性[21]。
综上所述,阿帕替尼在多线治疗耐药的复发转移性乳腺癌中有确切的应用价值,尤其是联合治疗可提高疗效,不良反应可耐受,安全性高,可作为晚期乳腺癌治疗的优选方案。本研究是对阿帕替尼联合治疗在晚期乳腺癌患者中应用的探索性研究,样本量相对较小,本课题后期将继续扩大样本量进一步论证其远期疗效及安全性评价。
| [1] | 徐兵河, 王树森, 江泽飞, 等. 中国晚期乳腺癌维持治疗专家共识[J]. 中华普通外科学文献:电子版, 2018, 12(1): 1–5. |
| [2] | 高德宗. 激素受体阳性晚期转移性乳腺癌的内分泌治疗[J]. 中华乳腺病杂志:电子版, 2018, 12(2): 69–72. |
| [3] | LIN M I, SESSA W C. Antiangiogenic therapy:creating a unique "window"of opportunity[J]. Cancer Cell, 2004, 6(6): 529–531. DOI:10.1016/s1535-6108(04)00340-x |
| [4] | 朱安婕, 袁芃. 抗血管生成酪氨酸激酶抑制剂在晚期乳腺癌中的应用[J]. 中华乳腺病杂志:电子版, 2018, 12(4): 234–237. |
| [5] | 王雅婕, 胡毅. 甲磺酸阿帕替尼治疗晚期恶性肿瘤的研究进展[J]. 解放军医学院学报, 2018, 39(6): 542–545,553. DOI:10.3969/j.issn.2095-5227.2018.06.021 |
| [6] | XUE J, ASTERE M, ZHONG M, et al. Efficacy and safety of apatinib treatment for gastric cancer, hepatocellular carcinoma and non-small cell lung cancer:a meta-analysis[J]. Oncotargets Ther, 2018, 11: 6119–6128. DOI:10.2147/OTT.S172717 |
| [7] | 桑蝶, 张频, 李青, 等. 白蛋白结合型紫杉醇治疗多线化疗失败乳腺癌的疗效及安全性分析[J]. 临床药物治疗杂志, 2018, 16(7): 28–33. DOI:10.3969/j.issn.1672-3384.2018.07.006 |
| [8] | EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours:Revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228–247. DOI:10.1016/j.ejca.2008.10.026 |
| [9] | HUGHES R. NCI-CTC vs TNS:which tool is better for grading the severity of chemotherapy-induced peripheral neuropathy?[J]. Nat Clin Pract Neurol, 2008, 4(2): 68–69. DOI:10.1038/ncpneuro0740 |
| [10] | ZHOU Z, YAO H, HU H. Disrupting tumor angiogenesis and "the hunger games" for breast cancer[J]. Adv Exp Med Biol, 2017, 1026: 171–195. |
| [11] | HU X C, CAO J, HU W W, et al. Multicenter phase Ⅱ study of Apatinib in non-triple-negative metastatic breast cancer[J]. BMC Cancer, 2014, 14: 820. DOI:10.1186/1471-2407-14-820 |
| [12] | HU X, ZHANG J, XU B, et al. Multicenter phase Ⅱ study of apatinib, a novel VEGFR inhibitor in heavily pretrnted patients with metastatic triple-negative breast cancer[J]. Int J Cancer, 2014, 135(8): 1961–1969. DOI:10.1002/ijc.28829 |
| [13] | SEIDMAN A D. Gemcitabine as single-agent therapy in the management of advanced breast cancer[J]. Oncology(Williston Park), 2001, 153(2 Suppl 3): 11–14. |
| [14] | FUMOLEAU P, BLUM J L, REICHARDT P. Weekly vinorelbine is an effective palliative regimen after failure with anthracyclinels and taxanes in metastatic breast carcinoma[J]. Cancer, 2003, 98(6): 1325–1326. DOI:10.1002/cncr.11577 |
| [15] | SONG Y Q, LIU B L, GUAN M, et al. Successful treatment using apatinib in intractable brain edema:A case report and literatures review[J]. Cancer Biol Ther, 2018, 19(12): 1093–1096. DOI:10.1080/15384047.2018.1491502 |
| [16] | 马莉, 刘妍妍, 糜志远. 阿帕替尼治疗乳腺癌的研究进展[J]. 大医生, 2018(4): 160–162. |
| [17] | ZHANG H J. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Devel Ther, 2015, 9: 6075–6081. |
| [18] | 陈玲娟, 伍钢, 董晓荣, 等. 阿帕替尼二线及二线以上治疗晚期肺癌26例[J]. 医药导报, 2018, 37(5): 551–554. |
| [19] | 时佳琪, 刘超, 张艳桥, 等. 甲磺酸阿帕替尼治疗恶性肿瘤的临床不良反应分析[J]. 中国肿瘤临床, 2018(4): 191–195. DOI:10.3969/j.issn.1000-8179.2018.04.269 |
| [20] | QIN S K. Apatinib in Chinese patients with advanced hepatocellular carcinoma:A phase Ⅱ randomized, open-label trial[J]. J Clin Oncol, 2014, 32(15_Suppl): 4019. DOI:10.1200/jco.2014.32.15_suppl.4019 |
| [21] | LI J, QIN S K, XU J M, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer:Results from a randomized, placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219–3225. DOI:10.1200/JCO.2013.48.8585 |
 2019, Vol. 45
2019, Vol. 45


