扩展功能
文章信息
- 刘恒, 孙凡, 徐倩倩, 高燕军, 马征, 窦志杰
- LIU Heng, SUN Fan, XU Qianqian, GAO Yanjun, MA Zheng, DOU Zhijie
- 黄芩苷对脑小血管病模型大鼠认知功能及脑内血管内皮生长因子和内皮抑素表达水平的影响
- Effects of baicalin on cognitive function and expression levels of vascular endothelial growth factor and endostatin in cerebral small vessel disease model rats
- 吉林大学学报(医学版), 2019, 45(05): 1080-1085
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1080-1085
- 10.13481/j.1671-587x.20190519
-
文章历史
- 收稿日期: 2018-11-01
脑小血管病(cerebral small vessel disease, CSVD)是一组脑部小血管病变导致的临床、影像学、病理表现和认知改变的综合征[1]。20%的脑卒中可由CSVD导致, 其是血管性痴呆和混合性痴呆的主要原因[2-3],临床上CSVD的治疗方法包括血栓溶解疗法、抗血小板聚集药、抗高血压药和抗胆固醇血症药等[4-5]。黄芩苷是黄芩的有效成分之一,黄芩苷对脑缺血再灌注损伤和心肌缺血再灌注损伤等具有保护作用[6-7]。研究[8]显示:血管内皮生长因子(vascular endothelial growth factor,VEGF)是反映脑组织损伤后修复的标志物,能有效促进脑组织缺血区血管内皮细胞的增生与修复,恢复脑组织灌注,改善神经细胞生长的微环境,促进神经功能的恢复,有效改善周围神经元和神经胶质细胞的损伤状态。研究[9]表明:内皮抑制素(endostatin, ES)能引起血管内皮细胞的细胞生长周期阻滞和凋亡, 对血管内皮细胞具有特异性抑制作用。CSVD的治疗尚未完善,本研究探讨黄芩苷对CSVD模型大鼠的治疗作用及其对脑内VEGF和ES表达及认知功能的影响,阐明黄芩苷调节CSVD模型大鼠脑中VEGF和ES表达的作用机制,为黄芩苷临床应用提供科学依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器70只健康成年雄性SD大鼠,SPF级,体质量250~300 g,购自上海斯莱实验动物中心,动物合格证号:SCXK(沪)2013-0008。维持实验动物设施在屏障环境标准,室温18℃~26℃,保持室温温差不超过4℃;维持相对湿度为40%~70%,光照每12 h替换;饲养条件均符合中国国家标准GB14925-2010规定。黄芩苷,批号: 021608102,购自美国Sigma公司;戊巴比妥钠,批号:20161114,购自天津市科密欧化学试剂有限公司;鼠抗人VEGF单克隆抗体、山羊抗人ES多克隆抗体和鼠抗人GADPH单克隆抗体均购自美国Santa Cruz公司;RT-PCR试剂盒购自美国Promega公司。ABI7500型定量PCR仪购自美国Applied Biosystems公司。
1.2 CSVD模型的制备大鼠CSVD模型构建参照文献[10-11]方法,采用同种系微栓子体外注入法。自体血栓制备:大鼠左心室采血,于80℃干燥箱内完全干燥,将干燥血凝块研细,过200 μm筛孔制成栓子。造模时以盐水配成10 g·L-1混悬液。大鼠以腹腔内注射1.5%戊巴比妥钠(3 mg·kg-1)进行麻醉,取仰卧位固定,去除颈部皮毛,进行常规皮肤表面消毒后于正中切口,钝性分离并暴露左侧颈总、颈内和颈外动脉,暂时夹闭颈总动脉近心端,并结扎颈外动脉的远心端,由颈外动脉的近心端逆行推注0.3 mL混悬液入颈内动脉。立即打开颈总动脉恢复血流供应使栓子通过颈内动脉入大脑前、中动脉及其侧支,并结扎颈外动脉的近心端,颈前切口缝合并表面消毒。以大鼠出现痫样发作、肢体瘫痪及异常运动确定为造模成功,同时记录大鼠死亡情况,54只造模大鼠中4只大鼠手术中死亡,2只大鼠手术后死亡,造模成功率为88%。剩余48只大鼠造模成功。
1.3 实验动物分组和给药48只造模成功的大鼠随机分为模型组、低剂量(50 mg·kg-1)和高剂量(100 mg·kg-1)黄芩苷组,每组16只,腹腔注射给药,共4周,并以假手术16只大鼠作为对照组。低和高剂量黄芩苷组大鼠术后次日给予50和100 mg·kg-1黄芩苷,对照组和模型组大鼠给予等量生理盐水,黄芩苷剂量及给药时间参考文献[12]设定。
1.4 Morris水迷宫实验各组大鼠分别于制模7、14和28 d时采用Morris水迷宫实验进行学习记忆功能检查。水迷宫是直径为120 cm圆筒, 周围涂黑色, 水为不透明乳白色, 实验时水深40 cm, 池壁四周分别标有A(东)、B(南)、C(西)和D(北)4个入水点, 将水池等分为4个象限, 分别在每个区正中离池壁33 cm处放置一个直径9 cm、高39 cm的圆形透明平台, 平台顶部低于水面1 cm。Morris水迷宫实验检测项目: ①逃避实验。将实验大鼠面向水池壁分别从A、B、C和D入水点放入水中, 记录其在2 min内寻找并爬上平台所需时间(逃避潜伏期); 若2 min内未找到平台, 实验者则将大鼠引导至平台上, 停留10 s后放回笼中, 此时逃避潜伏期计为120 s, 每只大鼠1 d内重复测试4次, 取其平均值纳入后续分析,潜伏期以平均值表示,单位为s。②空间探索实验。首先将水池内4个平台撤除, 然后将各组大鼠面向水池壁分别从A、B、C和D入水点放入水中, 观察大鼠在2 min内跨越原平台所在区域的次数, 每只大鼠1 d内重复测试2次, 取其平均值纳入后续分析作为穿越平台次数,单位为每分钟次数。
1.5 大鼠大脑海马组织中VEGF和ES mRNA表达水平的测定造模后24 h,大鼠腹腔注射1.5%戊巴比妥麻醉致死,取大鼠大脑海马组织研磨后,加入TRIzol进行裂解,采用RNA提取试剂盒分离提取大脑海马组织总mRNA。测定总mRNA浓度,采用cDNA合成试剂盒合成模板cDNA并进行RT-PCR法检测VEGF和ES mRNA的表达水平。RT-PCR法检测引物序列:VEGF,上游引物: 5′-CATAGCTTGAACGACG-3′,下游引物: 5′-GCTAGGCTTCGGAGAGACC-3′;ES,上游引物: 5′-TCCACCCGCTACGACCACCT-3′,下游引物: 5′-CCATAGCCACCATCGCACCGTGG-3′。定量PCR扩增仪检测VEGF和ESmRNA表达水平。qRT-PCR扩增体系为10 μL,反应条件: 50℃、2 min;95℃、10 min;95℃、15 s;60℃、1 min,35个循环。采用2-ΔΔCt法计算VEGF和ESmRNA相对表达水平。
1.6 大鼠大脑海马组织中VEGF和ES蛋白表达水平的测定造模后24 h,1.5%戊巴比妥麻醉处死大鼠,取大脑海马组织于蛋白裂解缓冲液中匀浆, 分离提取大鼠大脑海马组织总蛋白。蛋白于SDS-PAGE胶上进行电泳分离并转膜。5%脱脂牛奶封闭,于4℃摇床中Ⅰ抗(1:1 000)孵育过夜,PBS洗膜3次,Ⅱ抗(1:5000)孵育1.5 h, PBS洗膜3次,ECL化学发光试剂盒显像。应用AlphaView SA软件分析各样本与β-actin蛋白灰度的比值,为蛋白相对表达水平。
1.7 HE染色冠状切片观察大鼠大脑海马组织形态表现造模后24 h,大鼠腹腔注射1.5%戊巴比妥麻醉致死,取大脑视交叉前后2 mm冠状切片组织块置于10%甲醛溶液中固定,进行常规石蜡切片,切片厚度为4 μm,HE染色,中性树胶封片后于LEICA DMLB型光学显微镜下观察大鼠大脑海马组织形态表现。
1.8 免疫组织化学法检测各组大鼠大脑海马组织中VEGF和ES蛋白表达水平常规脱蜡脱水。按照说明书采用链霉菌抗生物素蛋白-过氧化物酶(SP)法进行染色。以PBS代替一抗作为阴性对照。VEGF和ES一抗浓度为1:100。二氨基联苯胺(DAB)显色, 苏木素复染, 中性树胶封片后于LEICA DMLB型光学显微镜下观察大鼠大脑海马区组织形态表现。光学显微镜下选取5个不重复视野,用NIS-Elements Software BR分析系统计算各个视野下VEGF和ES蛋白平均吸光度(A)值,以黄色颗粒为阳性表达。
1.9 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠水迷宫逃避潜伏期、水迷宫穿越平台次数、大脑海马组织中VEGF和ES mRNA及蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠Morris水迷宫逃避潜伏期和穿越平台次数与对照组比较,模型组大鼠在造模7、14和28 d后Morris水迷宫逃避潜伏期明显延长(P < 0.01),穿越平台次数明显减少(P < 0.01);与模型组比较,低和高剂量黄芩苷组大鼠在造模7、14和28 d后Morris水迷宫逃避潜伏期明显缩短(P < 0.01),穿越平台次数明显增加(P < 0.05或P < 0.01)。见表 1。
| (n=16, x±s) | ||||||||
| Group | Dose(mg·kg-1) | Escape latency(t/s) | Number of crossing platform(min-1) | |||||
| (t/d) 7 | 14 | 28 | (t/d) 7 | 14 | 28 | |||
| Control | 0 | 13.508±5.409 | 14.311±5.512 | 13.853±3.558 | 7.236±1.061 | 8.095±2.344 | 7.099±1.774 | |
| Model | 0 | 50.375±4.735* | 47.535±7.975* | 44.910±5.236* | 1.804±1.166* | 1.946±1.863* | 2.792±1.042* | |
| Low doseofbaicalin | 50 | 48.329±5.323 | 39.305±6.377△ | 28.321±4.798△ | 2.563±1.278 | 3.644±1.683△ | 4.867±1.065△ | |
| High dose of baicalin | 100 | 49.762±4.496 | 30.222±7.157△ | 19.771±4.903△ | 2.509±1.484 | 3.877±1.888△ | 6.082±1.443△△ | |
| * P < 0.01 compared with control group;△P < 0.05,△△ P < 0.01 compared with model group. | ||||||||
与对照组比较,模型组大鼠大脑海马组织中VEGF mRNA表达水平明显降低(P < 0.01),ES mRNA表达水平明显升高(P < 0.01)。与模型组比较,低和高剂量黄芩苷组大鼠大脑海马组织中VEGF mRNA表达水平明显升高(P < 0.05或P < 0.01),ES mRNA表达水平明显降低(P < 0.05或P < 0.01)。见表 2。
| (n=16, x±s) | |||
| Group | Dose(mg·kg-1) | VEGF mRNA | ES mRNA |
| Control | 0 | 1.596±0.030 | 0.397±0.019 |
| Model | 0 | 1.003±0.007* | 1.001±0.004* |
| Low dose of baicalin | 50 | 1.306±0.082△ | 0.779±0.022△ |
| High dose of baicalin | 100 | 1.583±0.025△△ | 0.521±0.039△△ |
| * P < 0.01 compared with control group;△P < 0.05,△△ P < 0.01 compared with model group. | |||
与对照组比较,模型组大鼠大脑海马组织中VEGF蛋白表达水平明显降低(P < 0.01),ES蛋白表达水平明显升高(P < 0.01)。与模型组比较,低和高剂量黄芩苷组大鼠大脑海马组织中VEGF蛋白表达水平明显升高(P < 0.05或P < 0.01),ES蛋白表达水平明显降低(P < 0.05或P < 0.01),且高剂量黄芩苷组效果更明显。见图 1和表 3。

|
| Lane 1:Control group; Lane 2: Model group; Lane 3: Low dose of baicalin group; Lane 4: High dose of baicalin group. 图 1 各组大鼠大脑海马组织中VEGF和ES蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of VEGF and ES proteins in hippocampus tissue of brain of rats in various groups |
|
|
| (n=16, x±s) | |||
| Group | Dose(mg·kg-1) | VEGF protein | ES protein |
| Control | 0 | 0.812±0.024 | 0.361±0.041 |
| Model | 0 | 0.321±0.021* | 0.822±0.031* |
| Low dose of baicalin | 50 | 0.493±0.021△△ | 0.531±0.017△ |
| High dose of baicalin | 100 | 0.782±0.032△△ | 0.447±0.041△△ |
| * P < 0.01 compared with control group;△P < 0.05,△△ P < 0.01 compared with model group. | |||
HE染色结果显示:对照组大鼠脑组织未见结构异常。模型组大鼠大脑海马区齿状回(dentate gyrus,DG)均可见病灶、淡染和组织结构紊乱;部分样本见神经组织坏死、脑皮质神经元胞体缩小、尼氏小体消失和细胞间隙增宽。低剂量黄芩苷组大鼠大脑海马区淡染,组织结构紊乱程度较模型组有所改善,部分样本可见大脑白质结构破坏;也可观察到神经组织坏死、大脑皮质神经元胞体缩小和细胞间隙增宽等情况,病变程度较模型组轻。高剂量黄芩苷组大鼠大脑海马区淡染和组织结构紊乱程度较模型组有所改善,部分样本可见大脑白质结构破坏;部分区域有神经组织坏死、神经元胞体缩小和细胞间隙增宽等情况; 病变程度较模型组和低剂量黄芩苷组轻。见图 2(插页五)。
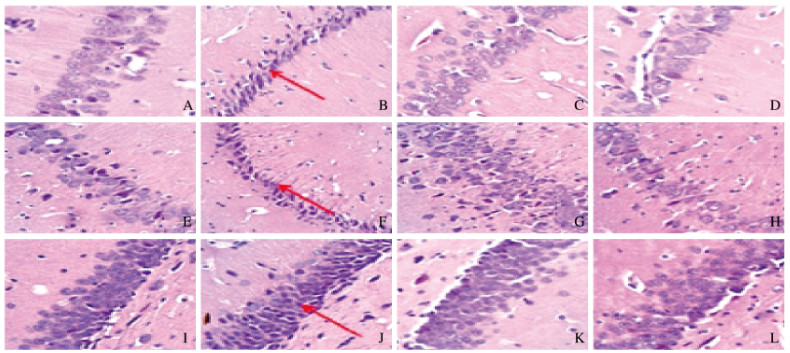
|
| A, E, I:Control group; B, F, J: Model group; C, G, K: Low dose of baicalin group; D, H, L: High dose of baicalin group; A-D:CA1; E-H:CA3; I-L:DG. The arrows indicated the intracellular spaces. 图 2 各组大鼠大脑海马组织HE染色结果(×400) Fig. 2 HE staining results of hippocampus tissue of brain of rats in various groups(×400) |
|
|
与对照组比较,模型组大鼠大脑海马组织中VEGF蛋白表达水平明显降低(P < 0.01),VEGF棕黄色淡染;大鼠大脑海马组织中ES蛋白表达水平明显升高(P < 0.01),ES棕黄色深染。与模型组比较,黄芩苷组大鼠大脑海马组织中VEGF蛋白表达水平明显升高(P < 0.01),ES蛋白表达水平明显降低(P < 0.01),且高剂量黄芩苷组效果最明显。见图 3(插页五)和表 4。

|
| A-D:Bar=200 μm; E-H:Bar=40 μm; A, E:Control group; B, F: Model group; C, G: Low dose of baicalin group; D, H: High dose of baicalin group. 图 3 各组大鼠大脑海马组织中VEGF表达情况 Fig. 3 Expressions of VEGF in hippocampus tissue of brain of rats in various groups |
|
|
| (n=16, x±s) | |||
| Group | Dose(mg·kg-1) | VEGF protein | ES protein |
| Control | 0 | 79.112±8.091 | 20.987±3.987 |
| Model | 0 | 23.221±9.033* | 58.089±8.956* |
| Low dose of baicalin | 50 | 35.232±8.053△ | 36.786±9.056△ |
| High dose of baicalin | 100 | 62.446±10.806△ | 27.998±8.094△ |
| * P < 0.01 compared with control group;△P < 0.05 compared with model group. | |||
CSVD主要累及颅内小动脉、微动脉、小静脉和毛细血管等,占全部缺血性脑卒中病因的25%~ 30%。94%的80岁以上老年人群中存在脑白质高信号[13]。脑微出血检出率高达36%。CSVD的主要临床表现有缺血性或出血性卒中、精神情感异常、认知功能下降和生理功能障碍等。研究[14]显示:CSVD分为散发型和遗传型2种类型,病理学表现主要为血管壁平滑肌细胞脱失、纤维样变、管壁增厚、管腔变窄、淀粉样物质沉淀和微小血管粥样硬化等。在导致认知功能障碍的病因中,血管性因素最为常见,除颅内大血管病变外,CSVD也可导致不同方面、不同程度的认知功能障碍。对CSVD与认知功能障碍关系的研究很多,本研究采用同种系微栓子体外注入法复制大鼠CSVD模型,造模后大鼠呈现痫样发作、肢体瘫痪及异常运动,Morris水迷宫实验检测结果显示:CSVD模型大鼠逃避潜伏期明显增加,而穿越平台次数明显减少,可见模型大鼠认知功能明显下降;HE染色结果显示:大脑海马区结构紊乱,神经细胞坏死,符合CSVD病理学表现,均证实造模成功,并具有CSVD的病理特征。
VEGF通路的作用主要为在保存现有血管的同时促进新血管生成,但在VEGF表达水平远高于抗血管内皮细胞生长因子的情形下,会导致血管异常。VEGF激增可导致促血管内皮细胞生长因子和抗血管内皮细胞生长因子表达水平失衡。VEGF与受体结合,产生一系列细胞信号级联反应。VEGF还能使新血管生长分化,促进肿瘤生长[15]。ES能特异性抑制血管内皮细胞在碱性成纤维细胞生长因子(bFGF)诱导下的增殖, 抑制内皮细胞的迁移, 诱导内皮细胞凋亡, 但对非内皮细胞(平滑肌细胞、3T3成纤维细胞和Lewis肺癌细胞等)均无抑制作用[16]。ES能抑制人脐静脉内皮细胞穿透人工基底膜的能力, 且其抑制效果呈剂量依赖关系。目前, 多种实验均证实ES对生长的血管产生抑制作用, 而对静止的血管组织不起作用[17-18],推测大脑组织中VEGF及ES表达的改变会造成脑小血管的改变。本研究结果显示:模型组大鼠大脑海马组织中VEGF表达水平明显降低,而ES表达水平明显升高,表明2种因子的改变均与脑小血管的病理特征有关联。
研究[19]显示:黄芩与栀子联合应用对脑缺血大鼠起到保护作用,其作用机制可能为其控制脑缺血时炎性因子的释放有关。研究[20]显示:黄芩苷能够较好地改善大鼠脑缺血再灌注所致的行为学障碍,并且可以降低梗死率及大脑一氧化氮(NOS)的活性,有效减轻自由基对大鼠脑组织的损伤。本研究结果显示:高剂量黄芩苷对CSVD模型大鼠的认知功能具有较好的改善作用,可提高大鼠水迷宫逃避潜伏期和穿越平台次数,并能改善大鼠大脑海马区病变程度。高剂量黄芩苷可以从基因和蛋白水平提升VEGF的表达,减少ES的表达,即对受损的血管起到修复作用,促进血管再生,对病灶区起到改善作用,因此对CSVD有治疗作用。
综上所述,黄芩已广泛用于中医临床治疗,但其作用机制尚未明确。本研究为黄芩苷用于临床治疗CSVD提供了科学依据,黄芩中的有效成分黄芩苷或可用于其他血管病变的治疗,但仍需更多的证据支持。
| [1] | WEI WM, CHEN Y, LEI D, et al. Plasma brain natriuretic peptide is a biomarker for screening ischemic cerebral small vessel disease in patients with hypertension[J]. Medicine (Baltimore), 2018, 97(35): e12088. DOI:10.1097/MD.0000000000012088 |
| [2] | STASZEWSKI J, SKROBOWSKA E, PIUSIÑSKA-MACOCH R, et al. Cerebral and extracerebral vasoreactivity in patients with different clinical manifestations of cerebral small-vessel disease:data from the significance of hemodynamic and hemostatic factors in the course of different manifestations of cerebral small-vessel disease study[J]. J Ultrasound Med, 2019, 38(4): 975–987. DOI:10.1002/jum.14782 |
| [3] | FENG C, TANG NL, HUANG H, et al. 25-hydroxy vitamin D level is associated with total MRI burden of cerebral small vessel disease in ischemic stroke patients[J]. Int J Neurosci, 2019, 129(1): 49–54. DOI:10.1080/00207454.2018.1503182 |
| [4] | YANG S N, YUAN J L, QIN W, et al. Twenty-four-hour ambulatory blood pressure variability is associated with total magnetic resonance imaging burden of cerebral small-vessel disease[J]. Clin Interv Aging, 2018, 13: 1419–1427. DOI:10.2147/CIA.S171261 |
| [5] | LIU Y, BRAIDY N, POLJAK A, et al. Cerebral small vessel disease and the risk of Alzheimer's disease:A systematic review[J]. Ageing Res Rev, 2018, 8(47): 41–48. |
| [6] | 肖意川, 张许, 柯培雄, 等. 黄芩苷在心血管疾病中的药理作用研究新进展[J]. 广东医学, 2018, 39(24): 3587–3590. DOI:10.3969/j.issn.1001-9448.2018.24.001 |
| [7] | 李津津. 中药黄芩药理作用的研究进展[J]. 内蒙古中医药, 2018, 37(10): 117–118. DOI:10.3969/j.issn.1006-0979.2018.10.079 |
| [8] | 张贵强. 脑小血管病患者血浆血管内皮生长因子水平的变化及意义[J]. 中国实用神经疾病杂志, 2018, 21(14): 1547–1551. |
| [9] | SUN E L, HAN R F, LU B X. Gene therapy of renal cancer using recombinant adeno-associated virus encoding human endostatin[J]. Oncol Lett, 2018, 16(3): 2789–2796. |
| [10] | 肖云月, 徐艳, 魏欣, 等. 粒细胞集落刺激因子对脑小血管病大鼠神经保护机制的研究[J]. 中国临床神经科学, 2016, 24(1): 1–6. |
| [11] | TANG J, XIAO W Z, LI Q H, et al. A cyclooxygenase-2 inhibitor reduces vascular wall thickness and ameliorates cognitive impairment in a cerebral small vessel diseases rat model[J]. Curr Alzheimer Res, 2015, 12(7): 704–710. DOI:10.2174/1567205012666150710104924 |
| [12] | 刘寒, 张欢欢, 康亚国, 等. 黄芩苷与栀子苷组合物对脑缺血损伤大鼠5-LOX/CysLTs/CysLT通路的影响[J]. 中成药, 2018, 40(5): 1020–1025. DOI:10.3969/j.issn.1001-1528.2018.05.003 |
| [13] | 高圆圆, 徐运. 脑小血管病的诊断和治疗[J]. 国际脑血管病杂志, 2017, 25(3): 233–238. DOI:10.3760/cma.j.issn.1673-4165.2017.03.008 |
| [14] | 张书凡, 罗煜凡, 吴丹红. 脑小血管病与认知功能障碍[J]. 上海医药, 2018, 39(17): 9–12, 21. DOI:10.3969/j.issn.1006-1533.2018.17.004 |
| [15] | 秦艳霞, 刘再高, 郑杰, 等. 脑复康方联合高压氧治疗脑小血管病致认知功能障碍疗效及对血清VEGF、BDNF、hs-CRP的影响[J]. 现代中西医结合杂志, 2018, 27(19): 2099–2102. DOI:10.3969/j.issn.1008-8849.2018.19.013 |
| [16] | YANG L, MAO BY, LIU N. Angiogenesis function of sali- droside in myocardium of rats with myocardial ischemia[J]. Int J Clin Exp Med, 2017, 10(3): 4957–4962. |
| [17] | EL-KENAWI AE, EL-REMESSY AB. Angiogenesis inhibitors in cancer therapy:Mechanistic perspective on classification and treatment rationales[J]. Br J Pharmacol, 2013, 170(4): 712–729. DOI:10.1111/bph.12344 |
| [18] | 刘梅梅, 丁慧, 尹晓静, 等. 多囊卵巢综合征患者血清血管内皮生长因子、内皮抑素水平及对卵巢间质血流的影响研究[J]. 中国全科医学, 2017, 20(4): 448–453. DOI:10.3969/j.issn.1007-9572.2017.04.014 |
| [19] | 郑勇凤, 王佳婧, 傅超美, 等. 黄芩的化学成分与药理作用研究进展[J]. 中成药, 2016, 38(1): 141–147. |
| [20] | 张前, 杨浩, 陈博, 等. 黄芩苷防治中枢神经系统疾病的研究进展[J]. 中国药师, 2017, 20(2): 327–331. DOI:10.3969/j.issn.1008-049X.2017.02.039 |
 2019, Vol. 45
2019, Vol. 45


