扩展功能
文章信息
- 刘粉霞, 陈丽, 孙宁, 吴亚薇
- LIU Fenxia, CHEN Li, SUN Ning, WU Yawei
- 幽门螺旋杆菌毒力因子CagA介导的ERK信号通路活化对胃癌细胞增殖和凋亡的影响
- Effect of Helicobacter pylori virulence factor CagA-mediated activation of ERK signaling pathway on proliferation and apoptosis of gastric cancer cells
- 吉林大学学报(医学版), 2019, 45(05): 1063-1068
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1063-1068
- 10.13481/j.1671-587x.20190516
-
文章历史
- 收稿日期: 2018-10-30
2. 河南中医药大学基础医学院, 河南 郑州 450002
2. School of Basic Medical Sciences, Henan University of Traditional Chinese Medicine, Zhengzhou 450002, China
细胞毒素相关基因A蛋白(cytotoxin associated gene A protein,CagA)是由幽门螺旋杆菌产生的毒力因子之一,可使胃上皮细胞发生转化而致癌变,是一种高毒力蛋白。幽门螺旋杆菌可感染胃组织并可吸附在胃上皮细胞上,然后通过细菌Ⅳ型分泌系统将毒力因子CagA注入到胃上皮细胞,通过调控细胞信号通路参与胃癌的发生发展[1]。胞外信号调节激酶(extracellular regulated protein kinase,ERK)是将信号从细胞表面受体传导到细胞核的关键激酶,是一种重要的细胞转导信号通路,在胃癌的发生发展进程中ERK信号通路被异常激活[2]。幽门螺旋杆菌感染可加快ERK信号通路异常激活,参与胃癌的发生发展[3],但尚未有相关研究表明两者间调控是否影响胃癌细胞,且CagA是否介导ERK信号通路活化及其对胃癌细胞的影响尚不明确。本研究主要探讨CagA对胃癌AGS细胞生长活性的影响及其与ERK信号通路激活的关系,阐明CagA致癌机制,为是否能够通过调控信号外信号调节激酶进而影响胃癌细胞活动的研究提供理论依据。
1 材料与方法 1.1 细胞株、主要试剂和仪器Helicobacter pylori GZ7东亚菌株和人胃癌AGS细胞株(美国ATCC细胞库)。LipofectaineTM2000、pMD18-T/CagA原核克隆载体、pcDNA3.1/GFP和pcDNA3.1/Myc-His(-)真核表达载体(美国Invitrogen公司);ERK抑制剂U0126(美国Sigma公司),质粒DNA提取试剂盒(美国MO Bio Laboratories公司),羊抗鼠二抗、CagA、磷酸化ERK(p-ERK)、总ERK(T-ERK)、B淋巴细胞瘤-2 (Bcl-2)、Bcl-2相关X蛋白(Bax)和激活型caspase-3(cleavedcaspase-3)单克隆抗体及GAPDH抗体(美国Santa Cruz公司),胎牛血清、Opti-MEM培养液和ECL发光液(美国Gibco公司)。FACSCalibur型流式细胞仪和细胞凋亡检测试剂盒(美国BD公司)。
1.2 pcDNA3.1/CagA真核表达载体的构建提取pMD18-T/CagA-GZ7质粒DNA为模板,设计带酶切位点的引物,高保真DNA聚合酶进行PCR扩增CagA基因,将CagA用连接酶连接入pcDNA3.1/Myc-His(-)真核表达载体,转化感受态E.coli DH5a,提取质粒DNA,对阳性克隆质粒DNA进行酶切,经生工生物工程(上海)股份有限公司测序,测序正确的质粒为GZ7/CagA。
1.3 细胞分组及处理将生长状态良好的胃癌细胞分为空白对照组(空载体转染)、CagA转染组(GZ7/CagA转染)和CagA+ERKi组(ERK1/2抑制剂预处理+GZ7/CagA转染),接种到6孔板中,待细胞贴壁生长后,CagA+ERKi组胃癌细胞加入ERK1/2抑制剂U0126(浓度为10 μmol·L-1),空白对照组和CagA转染组胃癌细胞加入0.1%DMSO作为对照,预处理2 h后空白对照组胃癌细胞加入空载体、CagA转染组和CagA + ERKi组胃癌细胞加入GZ7/CagA转染胃癌细胞,CagA+ERKi组胃癌细胞补充U0126使浓度维持在10 μmol·L-1,置入培养箱中培养,用于细胞生长和细胞凋亡率检测。
1.4 Wertern blotting法检测各组细胞中CagA、p-ERK、T-ERK、Bcl-2、Bax和cleavedcaspase-3蛋白表达水平提取上述3组胃癌细胞总蛋白,采用Western blotting法测定CagA、p-ERK、T-ERK、Bcl-2、Bax和cleavedcaspase-3蛋白表达水平:BCA法定量总蛋白,SDS-PAGE电泳,蛋白转至PVDF膜,脱脂奶粉封闭,以CagA单克隆抗体、p-ERK单克隆抗体、T-ERK单克隆抗体、Bcl-2单克隆抗体、Bax单克隆抗体和cleavedcaspase-3单克隆抗体为一抗,以GAPDH为内参照,羊抗鼠抗体为二抗。以凝胶分析系统(SAGECREAT ON)进行灰度分析。目标蛋白相对表达水平=目标条带灰度值/GAPDH条带灰度值。
1.5 各组胃癌细胞活性的测定转染后24 h取上述胃癌细胞制成单细胞悬液,接种到96孔板(每毫升50个细胞)中培养,采用CCK8法测定细胞活性,培养24、48和72 h各加入CCK8试剂(每孔10 μL)培养1 h,采用酶标仪检测波长为450 nm处的吸光度(A)值,以A值表示细胞活性。
1.6 各组胃癌细胞凋亡率的测定转染后24 h取上述胃癌细胞,加入Binding buffer重悬各组胃癌细胞,调整细胞密度为每毫升5 ×105个细胞,加入AnnexinⅤ-FITC混匀,孵育15 min,加入PI(5 μL)混匀,加样方法:阴性对照组均不加入AnnexinⅤ-FITC和PI,单染对照组加入AnnexinⅤ-FITC或PI,实验组加入AnnexinⅤ-FITC和PI,采用流式细胞仪检测细胞凋亡率。
1.7 统计学分析采用SPSS 20.0统计软件进行统计学分析。通过Kolmogorov-Smirnov检验数据是否正态分布,若数据符合正态分布以x±s表示,各组细胞中CagA、p-ERK、T-ERK、Bcl-2、Bax和cleavedcaspase-3蛋白表达水平及胃癌细胞凋亡率以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组胃癌细胞中CagA、p-ERK和T-ERK蛋白表达水平与空白对照组比较,CagA转染组胃癌细胞中CagA及p-ERK蛋白表达水平和CagA+ERKi组胃癌细胞中CagA蛋白表达水平明显升高(P < 0.01);与CagA转染组比较,CagA+ERKi组胃癌细胞中p-ERK蛋白表达水平明显降低(P < 0.01)。3组胃癌细胞中T-ERK蛋白表达水平比较差异无统计学意义(P>0.05)。见表 1和图 1。
| (n=7, x±s) | |||
| Group | CagA | p-ERK | T-ERK |
| Blank control | 0.07±0.01 | 0.16±0.02 | 0.92±0.21 |
| CagA transfection | 0.72±0.11* | 0.47±0.08* | 0.89±0.18 |
| CagA+ERKi | 0.71±0.13* | 0.19±0.03△ | 0.90±0.19 |
| * P < 0.01 compared with blank control group; △P < 0.01 compared with CagA transfection group. | |||
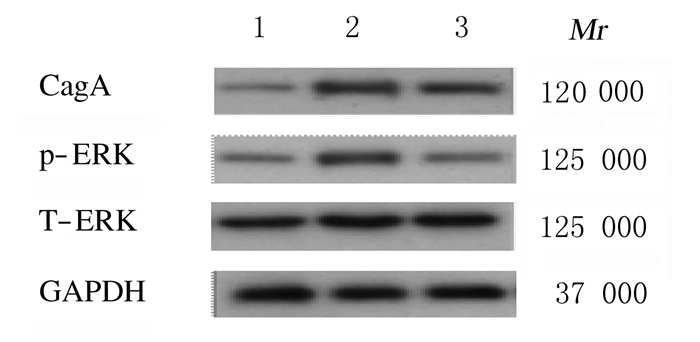
|
| Lane 1:Blank control group; Lane 2:CagA transfection group; Lane 3:CagA+ERKi group. 图 1 Western blotting法检测各组胃癌细胞中CagA、p-ERK和T-ERK蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of CagA, p-ERK, and T-ERK proteins in gastric cancer cells in various groups detected by Western blotting method |
|
|
与空白对照组比较,CagA转染组胃癌细胞中Bcl-2蛋白表达水平明显升高(P < 0.01),Bax和cleavedcaspase-3蛋白表达水平明显降低(P < 0.01);与CagA转染组比较,CagA+ERKi组胃癌细胞中Bcl-2蛋白表达水平明显降低(P < 0.01),Bax和cleavedcaspase-3蛋白表达水平明显升高(P < 0.01)。见表 2和图 2。
| (n=7, x±s) | |||
| Group | Bcl-2 | Bax | Cleaved caspase-3 |
| Blank control | 0.49±0.10 | 0.41±0.08 | 0.38±0.07 |
| CagA transfection | 0.97±0.04* | 0.15±0.14* | 0.12±0.17* |
| CagA+ERKi | 0.47±0.11△ | 0.43±0.10△ | 0.40±0.08# |
| * P < 0.01 compared with blank control group; △P < 0.01 compared with CagA transfection group. | |||

|
| Lane 1:Blank control group; Lane 2:CagA transfection group; Lane 3:CagA+ERKi group. 图 2 Western blotting法检测各组胃癌细胞中Bcl-2、Bax和cleavedcaspase-3蛋白表达电泳图 Fig. 2 Electrophoregram of Bcl-2, Bax, and cleaved caspase-3 proteins in gastric cancer cells in various groups detected by Western blotting method |
|
|
与培养24 h比较,培养48和72 h组胃癌细胞活性明显升高(P < 0.01);与空白对照组比较,CagA组各时间点胃癌细胞活性均明显升高(P < 0.01);与CagA转染组比较,CagA+ERKi组各时间点胃癌细胞活性均明显降低(P < 0.01),空白对照组与CagA + ERKi组各时间点胃癌细胞活性比较差异均无统计学意义(P>0.05)。见表 3。
| (n=7, x±s) | |||
| Group | A value | ||
| (t/h)24 | 48 | 72 | |
| Blank control | 0.78±0.13 | 1.17±0.16# | 1.54±0.21# |
| CagA transfection | 1.36±0.85 | 1.68±0.31*# | 2.85±0.78*# |
| CagA+ERKi | 0.83±0.10△ | 1.24±0.15△# | 1.63±0.24△# |
| * P < 0.01 compared with blank control group;△P < 0.01 compared with CagA transfection group;# P < 0.01 compared with 24 h. | |||
与空白对照组(15.32%±1.03%)比较,CagA转染组胃癌细胞凋亡率(8.21%±0.64%)明显降低(P < 0.01);与CagA转染组(8.21% ± 0.64%)比较,CagA+ERKi组胃癌细胞凋亡率(13.69%±1.53%)明显升高(P < 0.05);空白对照组与CagA+ERKi组胃癌细胞凋亡率比较差异无统计学意义(P>0.05)。见图 3。
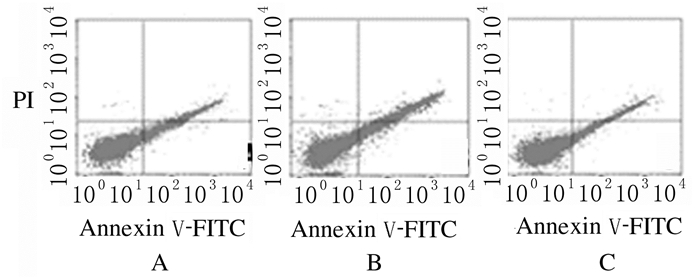
|
| A:Blank control group; B:CagA transfection group; C:CagA+ERKi group. 图 3 流式细胞术检测各组胃癌细胞凋亡率 Fig. 3 Apoptotic rates of gastric cancer cells in various groups detected by flow cytometry |
|
|
幽门螺旋杆菌为一种革兰阴性微需氧菌,呈螺旋状,全球约50%人口存在幽门螺旋杆菌感染,多数感染患者为无症状胃炎,少数发展为萎缩性胃炎甚至胃癌。CagA为幽门螺旋杆菌产生的毒力因子,由幽门螺旋杆菌Cag致病岛上的CagA基因编码产生的产物,是幽门螺旋杆菌感染引起炎症反应的重要效应蛋白,临床上包括CagA阳性和CagA阴性2种,CagA阳性感染患者胃癌的患病风险高于CagA阴性患者[4]。幽门螺旋杆菌感染后,通过幽门螺旋杆菌Cag致病岛编码的Ⅳ型分泌系统将CagA注入到胃上皮细胞并发生磷酸化,磷酸化的CagA和Scr同源区2结合激活Scr同源区的磷酸化酶活性,从而引起瀑布式的级联反应,通过干扰细胞信息传导通路引起组织严重的炎症损伤,参与胃癌的形成过程[5-6]。CagA可引起胃癌细胞增殖和凋亡紊乱[7],在胃癌的发生发展过程中发挥作用。本研究加入CagA转染后,胃癌细胞的正常代谢过程被打乱,出现增殖过高和凋亡过低等情况,表明CagA参与了胃癌的形成过程。
ERK是丝/苏氨酸蛋白激酶,丝裂原活化蛋白激酶家族成员之一,其信号传递途径是细胞生长、分裂和发育的信号网络核心。正常情况下ERK位于细胞胞浆中,是传导丝裂原信号的转导蛋白,当ERK激活后可转移到细胞核内,调节转录因子的活性产生细胞效应,包括ERK1、ERK2、ERK3、ERK4和ERK5共5个亚组,其中ERK1和ERK2表达广泛,是研究最彻底的亚型,参与细胞的有丝分裂、减数分裂和有丝分裂后期功能等生理过程,细胞因子、生长因子和病毒等多种刺激因子以及癌基因等均可激活ERK[8-9]。在恶性肿瘤中,ERK调节细胞的分化、增殖和存活,是多种生长因子的下游蛋白,其信号通路在肿瘤细胞的生长、侵袭和转移过程中起放大信号的作用,通过ERK信号级联反应可调控基因的表达[10],多种恶性肿瘤中均可检测到ERK的过度激活。研究[11]发现:ERK1/2在食管鳞状细胞癌的细胞增殖和凋亡中发挥重要作用;研究[12]发现:ERK信号通路参与调节肺癌HCC827细胞的增殖和凋亡过程。本研究结果表明:加入ERK抑制剂后,CagA的转染与其单独转染的结果不一致,与CagA转染组比较,CagA+ERKi组胃癌细胞增殖速度减缓、凋亡加快,表明抑制ERK通路可以影响CagA对胃癌细胞生理过程的作用,CagA可能通过ERK信号通路的激活调控胃癌的进展。
幽门螺旋杆菌感染与胃癌的形成关系密切,胃癌是幽门螺杆菌感染、宿主遗传和环境因素等相互作用的结果,幽门螺旋杆菌感染后启动胃黏膜的炎症通路,可通过激活信号通路参与胃癌的发生发展[13-16]。研究[17]发现:幽门螺旋杆菌感染后可引起ERK1/2高表达,后者的高表达可能参与胃癌的发生发展过程。研究[18]发现:幽门螺旋杆菌感染可加快ERK等信号通路的异常激活,进而ERK等信号通路的激活可引起胃癌细胞癌变,促进癌变细胞的浸润和转移。caspase-3为caspases级联反应下游的关键因子,cleavedcaspase-3可水解脱氧核糖核酸酶的抑制蛋白导致细胞凋亡,还可裂解Bcl-2,使其失去活性从而发挥促凋亡作用。Bcl-2为一种癌基因,对细胞凋亡具有抑制作用;Bax为重要的凋亡基因,对Bcl-2有抑制作用,Bax和Bcl-2之间的平衡关系对细胞凋亡具有调控作用[19-21]。但CagA是否通过ERK信号通路的激活调控凋亡相关基因水平参与胃癌的发生发展尚不十分清楚,本研究结果显示:加入ERK抑制剂后,CagA对胃癌细胞的Bcl-2蛋白水平影响明显降低,并可明显上调Bax和cleavedcaspase-3等抑制癌细胞增殖因子水平,恢复到正常胃癌细胞增殖的水平。
综上所述,本研究探讨CagA对ERK信号通路及胃癌细胞增殖、凋亡的影响,结果显示:CagA转染胃癌细胞可引起胃癌细胞CagA和p-ERK蛋白表达水平升高,抑制胃癌细胞凋亡、促进胃癌细胞增殖,ERK抑制剂可抑制CagA进而抑制胃癌细胞增殖和促进细胞凋亡,表明CagA+ERKi可通过抑制胃癌细胞增殖,促进胃癌细胞凋亡而抑制胃癌的发生发展过程。本研究对其可能机制进行研究,结果显示:CagA可引起胃癌细胞中p-ERK和Bcl-2蛋白表达水平升高,Bax和cleavedcaspase-3蛋白表达水平降低,给予ERK抑制剂后可纠正CagA引起的胃癌细胞p-ERK、Bax、cleavedcaspase-3和Bcl-2蛋白水平异常。CagA可能通过激活ERK信号通路调控凋亡相关基因,从而抑制细胞凋亡、促进细胞增殖,形成致癌作用。
| [1] | HUANG X, WANG C, SUN J, et al. Clinical value ofCagA, c-Met, PI3K and Beclin-1 expressed in gastric cancer and their association with prognosis[J]. Oncol Lett, 2018, 15(1): 947–955. |
| [2] | YANG D, LI R D, WANG H L, et al. Clinical implications of progranulin in gastric cancer and its regulation via a positive feedback loop involving AKT and ERK signaling pathways[J]. Mol Med Rep, 2017, 16(6): 9685–9691. DOI:10.3892/mmr.2017.7796 |
| [3] | CHEN S Y, DUAN G C, ZHANG R G, et al. Helicobacter pylori cytotoxin-associated gene A protein upregulates α-enolase expression via Src/MEK/ERK pathway:implication for progression of gastric cancer[J]. Int J Oncol, 2014, 45(2): 764–770. DOI:10.3892/ijo.2014.2444 |
| [4] | LAN K H, LEE W P, WANG Y S, et al. Helicobacter pylori CagA protein activates Akt and attenuates chemotherapeutics-induced apoptosis in gastric cancer cells[J]. Oncotarget, 2017, 8(69): 113460–113471. |
| [5] | LEE D Y, JUNG D E, YU S S, et al. Regulation of SIRT3 signal related metabolic reprogramming in gastric cancer by Helicobacter pylori oncoprotein CagA[J]. Oncotarget, 2017, 8(45): 78365–78378. |
| [6] | HATAKEYAMA M. Structure and function of Helicobacter pylori CagA, the first-identified bacterial protein involved in human cancer[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2017, 93(4): 196–219. DOI:10.2183/pjab.93.013 |
| [7] | 龙妮娅, 熊林, 赵艳, 等. 幽门螺杆菌东、西方株CagA的序列差异及其对胃癌细胞生长与凋亡的影响[J]. 微生物学通报, 2018, 45(4): 848–855. |
| [8] | WANG Y Z, XIAO H J, WU H T, et al. G protein subunit α q regulates gastric cancer growth via the p53/p21 and MEK/ERK pathways[J]. Oncol Rep, 2017, 37(4): 1998–2006. |
| [9] | CA IH, CHEN X, ZHANG J, et al. 18β-glycyrrhetinic acid inhibits migration and invasion of human g astric cancer cells via the ROS/PKC-α/ERK pathway[J]. J Nat Med, 2018, 72(1): 252–259. DOI:10.1007/s11418-017-1145-y |
| [10] | PEI Y F, ZHANG Y J, LEI Y, et al. Hypermethylation of the CHRDL1 promoter induces proliferation and metastasis by activating Akt and Erk in gastric cancer[J]. Oncotarget, 2017, 8(14): 23155–23166. |
| [11] | 孟令超, 张娜, 单粉粉, 等. 胃癌组织细胞外信号调节激酶1/2表达及其与幽门螺杆菌关系的初步分析[J]. 临床与实验病理学杂志, 2016, 32(2): 131–135. |
| [12] | 苏连明, 庄彦华, 颜彬, 等. 幽门螺杆菌感染与胃癌组织细胞外调节蛋白激酶1基因表达的相关性研究[J]. 中华实用诊断与治疗杂志, 2014, 28(8): 750–751, 754. |
| [13] | WATANABE T, TAKAHASHI A, SUZUKI K, et al. Epithelial-mesenchymal transition in human gastric cancer cell lines induced by TNF-nsition in humanbmed/Helicobacter pylori[J]. Int J Cancer, 2014, 134(10): 2373–2382. DOI:10.1002/ijc.28582 |
| [14] | NGO H K, LEE H G, PIAO J Y, et al. Helicobacter pylori induces Snail expression through ROS-mediated activation of Erk and inactivation of GSK-3throuhuman gastric cancer cells[J]. Mol Carcinog, 2016, 55(12): 2236–2246. DOI:10.1002/mc.22464 |
| [15] | 魏晓东, 唐艳萍. 胃癌中幽门螺旋杆菌感染对DNA甲基化影响的研究进展[J]. 中国中西医结合外科杂志, 2018, 24(6): 803–805. DOI:10.3969/j.issn.1007-6948.2018.06.031 |
| [16] | 奚经巧, 林枝, 陈建欧, 等. 幽门螺旋杆菌阳性慢性萎缩性胃炎患者血清CagA抗体浓度评估黏膜病变程度的价值[J]. 中国卫生检验杂志, 2018, 28(17): 2128–2131. |
| [17] | 刘凤霞, 刘文娟, 李建勇, 等. ERK1/2在食管鳞状细胞癌中促进细胞增殖、抑制凋亡及其调控机制的研究[J]. 生物技术通报, 2015, 31(10): 242–248. |
| [18] | 王希明, 张晔, 刘云鹏, 等. MAPK/ERK通路及泛素连接酶c-Cbl调控埃克替尼抑制肺癌HCC827细胞增殖和诱导细胞凋亡的研究[J]. 现代肿瘤医学, 2014, 22(5): 1024–1027. DOI:10.3969/j.issn.1672-4992.2014.05.13 |
| [19] | 谢琼, 胡桂明, 王洪涛. miRNA-223-3p调控JAK2/STAT3信号通路对胃癌细胞增殖、凋亡、迁移的影响[J]. 郑州大学学报:医学版, 2018, 53(5): 629–634. |
| [20] | 檀碧波, 李勇, 赵群, 等. 胃癌组织中miR-218和凋亡相关蛋白Bcl-2、Bax、xIAP、Survivin mRNA的表达观察[J]. 山东医药, 2018, 58(47): 20–23. DOI:10.3969/j.issn.1002-266X.2018.47.005 |
| [21] | 王玲, 周巧直, 王晓燕, 等. 阿托伐他汀调控MMP-9、Cleaved Caspase-3、Bcl-2和Bax蛋白表达对胃癌细胞增殖、周期和凋亡的影响[J]. 胃肠病学和肝病学杂志, 2018, 27(11): 1206–1210. DOI:10.3969/j.issn.1006-5709.2018.11.002 |
 2019, Vol. 45
2019, Vol. 45


