扩展功能
文章信息
- 付雯雯, 于晓风, 薛岩, 于萍, 吴雪记, 徐华丽, 睢大筼
- FU Wenwen, YU Xiaofeng, XUE Yan, YU Ping, WU Xueji, XU Huali, SUI Dayun
- 大鼠非人工呼吸机下心肌缺血再灌注无复流模型的建立和评价
- Establishment and evaluation of rat models of myocardial ischemia reperfusion-related no-reflow under non-artificial ventilator
- 吉林大学学报(医学版), 2019, 45(05): 1058-1062
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1058-1062
- 10.13481/j.1671-587x.20190515
-
文章历史
- 收稿日期: 2019-01-29
2. 吉林大学第一医院烧伤外科, 吉林 长春 130021
2. Department of Burns Surgery, First Hospital, Jilin University, Changchun 130021, China
目前临床上患者常因冠状动脉狭窄、夹层和(或)其他原因引起的心肌供血不足而发生心肌损伤和心肌梗死[1]。临床治疗多采用溶栓疗法和经皮冠状动脉介入术(percutaneous coronary intervention, PCI)等方法治疗心肌梗死,以疏通堵塞或扩大狭窄的冠状动脉,实现心肌有效再灌注,减少心肌梗死致残率及致死率[2-3]。研究[4]显示:PCI开通梗死动脉后,仍有37%~43%的患者心肌组织水平发生再灌注不良,缺血心肌未能实现有效灌注的现象,即无复流现象(no-reflow phenomenon, NR)[4-5]。NR的发生会引起多种不良预后,包括心室重构、恶性心律失常、围术期心肌再梗死、心力衰竭和死亡[6-12]。
研究[5, 13-18]表明:微血管栓塞、白细胞栓塞、外源性凝血途径和血管功能障碍等因素均可导致心肌灌注减少,进而发展为NR。但NR的发生机制尚不完全清楚,随着对NR研究的不断深入,建立心肌缺血再灌注无复流动物模型可以为NR的发病机制及病理生理研究提供重要的依据。经典的心肌缺血再灌注无复流模型是在人工呼吸机配合下完成的,造模对动物损伤大,动物成活率低,实验周期长,系统误差大。本研究建立大鼠非人工呼吸机下心肌缺血再灌注无复流模型,通过形态学、血液生化学及血液流变学等指标对模型进行评价,可弥补传统造模方法的不足,为研究心血管系统疾病发病机制及评价治疗心血管疾病药物药效学奠定基础。
1 材料与方法 1.1 实验动物、主要试剂和仪器50只SPF级雌性Wistar大鼠,体质量230~250 g,购自辽宁长生生物技术股份有限公司,动物合格证号:SCXK-(辽)2015-0001。Evans Blue (批号:20171008024)、Thioflavine S(批号:020M0201V)和ADP(批号:SLBL1267V)为美国Sigma公司产品,TTC(批号:20170808,上海惠世生化试剂有限公司),CK-MB试剂盒(批号:YF4QHYQ663,武汉伊莱瑞特生物科技有限公司),天门冬氨酸氨基转移酶(AST)试剂盒(批号:20180521)和乳酸脱氢酶(LDH)试剂盒(批号:20180626)为南京建成生物工程研究所产品。TE2000-U荧光倒置显微镜(日本Nikon公司),LBY-N6K血液黏度仪、LBY-F5血小板黏附仪和LBY-NJ2血小板聚集仪(北京普利生医疗器械厂)。
1.2 大鼠非人工呼吸机下心肌缺血再灌注无复流模型的建立[19]50只Wistar大鼠随机分为假手术组(20只)和模型组(30只)。大鼠乙醚麻醉后仰位固定于手术台上,自左侧3~4肋间开胸,暴露心脏,于肺动脉圆锥及左心房之间找出冠状动脉左前降支,使用0号手术线立即结扎(假手术组大鼠仅穿线不结扎),结扎时用一细小乳胶管垫于血管与结扎线之间,将心脏送回胸腔,并挤出胸腔内血液和气体,迅速关闭胸腔,开胸时间不超过30 s。结扎2 h后松解结扎线恢复心肌供血进行心肌再灌注,再灌注后充分排出胸腔气体,关闭胸腔。再灌注2 h后,处置动物,留存样本。
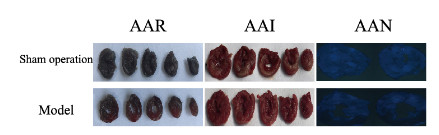
1.3 大鼠心肌缺血、梗死和无复流面积测定[20-22]再灌注2 h后,麻醉大鼠。右下肢、腹部备皮,于右下肢正中剪1~2 cm切口,分离皮下组织,见股静脉。自股静脉注入4% Thioflavin S 1 mL·kg-1,1 min后打开腹腔,自下腔静脉注入2% Evans Blue 2 mL·kg-1,1 min后开胸,取出心脏。剪除右心室和心房后,保留左心室。沿心脏长轴方向自心尖向上,横切成5片,切片厚度约为2 mm,观察心肌缺血面积(area at risk, AAR),使用倒置荧光显微镜(×10,365 nm波长)观察心肌无复流面积(area at no-reflow, AAN),然后将切片置于1% TTC溶液中,37℃孵育30 min,观察心肌梗死面积(area at infarct, AAI)。
采用Image-Pro Plus软件分析图片。AAR以5片心肌总缺血面积之和与左心室总面积的比值表示;心肌切片孵育TTC溶液后,红色区域为非梗死区,白色区域为梗死区。AAI以5片心肌总梗死面积与缺血总面积的比值表示;Thioflavin S灌流后,心肌切片产生荧光的区域为复流区,反之则为无复流区。AAN以5片心肌总无复流面积之和与缺血总面积的比值表示。
1.4 大鼠心肌三酶的测定[23]再灌注2 h后,麻醉大鼠,腹主动脉采血1 mL,静置2 h后,2 000 r·min-1离心10 min,分离血清,按照试剂盒说明书测定血清肌酸激酶同工酶(CK-MB)、AST和LDH活性。
1.5 大鼠全血黏度和血浆黏度测定[24]再灌注2 h后,麻醉大鼠,腹主动脉取血3 mL,1%肝素抗凝,取1 mL加入LBY-N6K血液黏度仪中,测定全血低切(20/s)、中切(60/s)和高切(120/s)黏度,剩余2 mL以3 000 r·min-1离心10 min,取血浆1 mL加入黏度计,检测120/s切变率下血浆黏度。
1.6 大鼠血小板黏附能力测定[24]再灌注2 h后,麻醉大鼠,腹主动脉取血1 mL。使用3.8%枸橼酸钠溶液与全血按1:9比例抗凝,1 000 r·min-1离心5 min。取20 μL血浆加入380 μL生理盐水稀释,混匀。取稀释血浆10 μL加入血细胞计数板,静置3 min,计数。将剩余血浆加入硅化球形玻璃瓶中,3.7 r·min-1旋转15 min,取黏附后血浆10 μL加入细胞计数板,静置3 min,计数,计算血小板黏附率(PAR)。PAR=(黏附前血小板数-黏附后血小板数)/黏附前血小板数×100%。
1.7 大鼠血小板聚集能力测定[24]再灌注2 h后,麻醉大鼠,腹主动脉取血1.5 mL。使用3.8%枸橼酸钠溶液与全血按1:9比例抗凝,混匀,1 500 r·min-1离心5 min,上清为富血小板血浆(PRP)。吸取200 μL PRP注入含搅拌子的比色杯中,置于恒温孔中备用。剩余抗凝血以3 000 r·min-1离心10 min,为贫血小板血浆(PPP)。吸取PPP 200 μL注入另一比色杯中,放入检测孔,检测零点。取出PPP杯,插入PRP杯。吸取75 μmol·L-1 ADP 10 μL,沿比色杯一角插入比色杯底部,迅速推出ADP溶液,计算1、3和5 min的血小板聚集率(PAG)及最大血小板聚集率(MPAG)。
1.8 统计学分析采用GraphPad Prim 5和SPSS13.0统计软件进行制图及统计学处理。各组大鼠心肌AAR、AAI和AAN,血清中CK-MB、LDH和AST活性,全血低切、中切和高切黏度及血浆黏度,PAR,1、3和5 min的PAG和MPAG均以x±s表示,2组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组大鼠心肌AAR、AAI和AAN再灌注2 h后,灌流Evans Blue和Thioflavin S以评估大鼠心肌AAR和AAN;心脏切片于TTC溶液中孵育,以评估大鼠心肌AAI。与假手术组比较,模型组大鼠心肌AAR、AAI和AAN均明显增加(P < 0.01)。见表 1和图 1(插页四)。
| (n=10, x±s, η/%) | |||
| Group | AAR | AAI | AAN |
| Sham operation | 0.92±1.73 | 0.00 | 3.78±1.43 |
| Model | 33.52±8.68* | 21.61±3.24* | 31.63±7.61* |
| * P < 0.01 compared with sham operation group. | |||
|
| 图 1 2组大鼠心肌组织Evans blue、TTC和Thioflavin S染色结果 Fig. 1 Results of Evans blue, TTC, and Thioflavin S staining of myocardium tissue of rats in two groups |
|
|
与假手术组比较,模型组大鼠血清CK-MB、LDH和AST活性均明显升高(P < 0.01)。见表 2。
| (n=10, x±s) | |||
| Group | CK-MB [ρB/(ng·L-1)] | LDH [λB/(U·L-1)] | AST [λB/(U·L-1)] |
| Sham operation | 541.34±64.16 | 2 845.02±213.01 | 86.60±16.93 |
| Model | 689.75±113.98* | 3 194.86±66.12* | 147.96±13.10* |
| * P < 0.01 compared with sham operation group. | |||
与假手术组比较,模型组大鼠全血低切、中切和高切黏度及血浆黏度均明显增加(P < 0.01)。见表 3。
| (n=10, x±s, mPa·s) | ||||
| Group | Whole blood viscosity | Plasma viscosity | ||
| 20/s | 60/s | 120/s | ||
| Sham operation | 4.64±0.55 | 4.04±0.40 | 3.79±0.30 | 1.32±0.25 |
| Model | 5.72±0.87* | 4.68±0.48* | 4.31±0.41* | 1.98±0.06* |
| * P < 0.01 compared with sham operation group. | ||||
与假手术组比较,模型组大鼠PAR,1、3和5 minPAG及MPAG均明显升高(P < 0.05或P < 0.01)。见表 4。
| (n=10, x±s, η/%) | |||||
| Group | PAR | PAG | MPAG | ||
| (t/min) 1 | 3 | 5 | |||
| Sham operation | 0.18±0.03 | 18.98±2.80 | 22.06±6.64 | 23.79±5.62 | 24.10±5.83 |
| Model | 0.28±0.09** | 29.38±7.77** | 31.57±8.90* | 32.85±5.13** | 33.46±7.80** |
| * P < 0.05, ** P < 0.01 compared with sham operation group. | |||||
急性心肌梗死(acute myocardial infarction, AMI)后,溶栓疗法和PCI可以及时有效地开通“犯罪血管”,大大提高AMI患者的急性期存活率。然而再灌注损伤后无复流-冠脉血管实现再灌注后,心肌组织仍存在血流灌注相对不足甚至无血流灌注的现象,可导致AMI患者预后不良,发生恶性心律失常、围术期心肌再梗死甚至死亡。NR的发生是心肌继续缺血、梗塞延展、心室重构和心功能恢复障碍的预测指标,也是评估再灌注治疗成功与否的主要指标之一[25-26]。
心肌缺血再灌注无复流模型是研究心血管系统疾病发病机制以及评价治疗心血管疾病药物药效学最基本的关键技术模型。然而,药理实验方法学记载的心肌缺血再灌注无复流模型是在人工呼吸机配合下完成的。由于呼吸机使用的频率,通气量的参数设定及气管切开等因素都对实验所检测指标产生干扰;造模中需剪断3、4肋骨以暴露心脏,对动物的损伤较大,增加了动物的死亡率,一般成活率不足60%,大大增加了实验动物数量;在呼吸机下造模不能批量进行,实验周期长,使整个造模(约1周)不在同一条件下进行,增大了系统误差,降低了实验的可信度。本研究建立的大鼠非人工呼吸机下心肌缺血再灌注无复流模型,不需要切开气管和切断肋骨,减少出血量,动物成活率提高到85%以上,整个造模可以在5 h内完成,不仅减少了实验动物数量,大大缩短了实验周期,也使实验条件保持一致,减少系统误差,提高可信度;采用乙醚吸入性麻醉剂,起效迅速,持续时间短,适合结扎心脏冠状动脉手术。
综上所述,与传统方法比较,经改进的造模方法不需要呼吸机,具有操作简便、动物损伤小、成模率高、实验周期短和实验费用低等优点,实验条件一致,减少了实验的系统误差,提高了实验的可信度,是完成心肌缺血再灌注无复流实验较好的方法。
| [1] | COLOMBO A, PROIETTI R, CULIC V, et al. Triggers of acute myocardial infarction:a neglected piece of the puzzle[J]. J Cardiovasc Med (Hagerstown), 2014, 15(1): 1–7. DOI:10.2459/JCM.0b013e3283641351 |
| [2] | GIDDAY J M, GASCHE Y G, COPIN J C, et al. Leukocyte-derived matrix metalloproteinase-9 mediates blood-brain barrier breakdown and is proinflammatory after transient focal cerebral ischemia[J]. Am J Physiol Heart Circ Physiol, 2005, 289(2): H558–H568. DOI:10.1152/ajpheart.01275.2004 |
| [3] | RICHTER V C, COELHO M, ARANTES E DE C, et al. Health status and mental health in patients after percutaneous coronary intervention[J]. Rev Bras Enferm, 2015, 68(4): 589–682. |
| [4] | 杨波, 杨树森. 血栓抽吸与替罗非班在急诊冠状动脉介入慢血流/无复流中的作用[J]. 中国循证心血管医学杂志, 2017, 9(11): 1406–1408. DOI:10.3969/j.issn.1674-4055.2017.11.36 |
| [5] | DE LUCA G, SURYAPRANATA H, STONE G W, et al. Adjunctive mechanical devices to prevent distal embolization in patients undergoing mechanical revascularization for acute myocardial infarction:a meta-analysis of randomized trials[J]. Am Heart J, 2007, 153(3): 343–353. DOI:10.1016/j.ahj.2006.11.020 |
| [6] | GALASSO G, SCHIEKOFER S, D'ANNA C, et al. No-reflow phenomenon:pathophysiology, diagnosis, prevention, and treatment. A review of the current literature and future perspectives[J]. Angiology, 2014, 65(3): 180–189. DOI:10.1177/0003319712474336 |
| [7] | HUANG F C, KUO H C, HUANG Y H, et al. Anti-inflammatory effect of resveratrol in human coronary arterial endothelial cells via induction of autophagy:implication for the treatment of Kawasaki disease[J]. BMC Pharmacol Toxicol, 2017, 18(1): 3. DOI:10.1186/s40360-016-0109-2 |
| [8] | LIU HH, ZHANG SS, LIU CR, et al. Resveratrol ameliorates microcystin-LR-induced testis germ cell apoptosis in rats via SIRT1 signaling pathway activation[J]. Toxins(Basel), 2018, 10(6): E235. |
| [9] | CHOI S E, KWON S, SEOK S, et al. Obesity-linked phosphorylation of SIRT1 by casein kinase 2 inhibits its nuclear localization and promotes fatty live[J]. Mol Cell Biol, 2017, 37(15): e00006–e00017. |
| [10] | FAJAR J K, HERIANSYAH T, ROHMAN M S. The predictors of no reflow phenomenon after percutaneous coronary intervention in patients with ST elevation myocardial infarction:A meta-analysis[J]. Indian Heart J, 2018, 70(Suppl3): S406–S418. |
| [11] | QUISI A, ALICI G. The relationship between serum rheumatoid factor level and no-reflow phenomenon in patients with acute ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. J Clin Lab Anal, 2018, 32(9): e22598. DOI:10.1002/jcla.22598 |
| [12] | CELIK T, BALTA S, DEMIR M, et al. Predictive value of admission red cell distribution width-platelet ratio for no-reflow phenomenon in acute ST segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. Cardiol J, 2016, 23(1): 84–92. |
| [13] | RANE S, HE M Z, SAYED D, et al. Downregulation of miR-199a derepresses hypoxia-inducible factor-1alpha and Sirtuin 1 and recapitulates hypoxia preconditioning in cardiac myocytes[J]. Circ Res, 2009, 104(7): 879–886. DOI:10.1161/CIRCRESAHA.108.193102 |
| [14] | YANG Y, DUAN W, LI Y, et al. Novel role of silent information regulator 1 in myocardial ischemia[J]. Circulation, 2013, 128(20): 2232–2240. DOI:10.1161/CIRCULATIONAHA.113.002480 |
| [15] | TOPOL E J, YADAV J S. Recognition of the importance of embolization in atherosclerotic vascular disease[J]. Circulation, 2000, 101(5): 570–580. DOI:10.1161/01.CIR.101.5.570 |
| [16] | 刘朝晖, 李德才, 刘思泰, 等. 急性心肌梗死冠状动脉介入术后无复流现象影响因素分析[J]. 临床误诊误治, 2019, 32(3): 85–89. DOI:10.3969/j.issn.1002-3429.2019.03.019 |
| [17] | 潘华福, 叶少武. 急性心肌梗死患者经皮冠脉介入术中无复流的研究进展[J]. 心血管病学进展, 2018, 39(6): 1029–1034. |
| [18] | 汤克虎, 任尽平, 张波涛, 等. 前列地尔对ST段抬高型急性心肌梗死患者经皮冠状动脉介入治疗术中心肌微循环障碍的影响[J]. 感染、炎症、修复, 2018, 19(3): 164–169. |
| [19] | 孙伟伦.前列地尔注射液对大鼠心肌缺血再灌注后无复流的保护作用和潜在机制[D].长春: 吉林大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10183-1014270913.htm |
| [20] | COZZI E, HAZARIKA S, STALLINGS H WRD, et al. Ultrafine particulate matter exposure augments ischemia-reperfusion injury in mice[J]. Am J Physiol-Heart Circ Physiol, 2006, 291(2): H894–H903. DOI:10.1152/ajpheart.01362.2005 |
| [21] | XU Z B, ALLOUSH J, BECK E, et al. A murine model of myocardial ischemia-reperfusion injury through ligation of the left anterior descending artery[J]. J Vis Exp, 2014(86): e51329–e513336. |
| [22] | 韦星, 张冯迪, 阳玉中, 等. 大鼠心肌缺血再灌注损伤后无复流模型的制备[J]. 中国动脉硬化杂志, 2017, 25(7): 728–731. DOI:10.3969/j.issn.1007-3949.2017.07.015 |
| [23] | 付雯雯.基于SIRT1信号通路的人参皂苷Rb2和Rg2预处理对心肌损伤的保护作用及机制研究[D].长春: 吉林大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10183-1017152288.htm |
| [24] | 王蕾.西洋参与制西洋参对大鼠心肌缺血再灌注损伤保护作用的对比研究[D].长春: 吉林大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10183-1017152540.htm |
| [25] | 骆秉铨. 冠状动脉无复流现象的临床研究进展[J]. 中国微循环, 2002, 6(5): 261–264. |
| [26] | ITO H. No-reflow phenomenon and prognosis in patients with acute myocardial infarction[J]. Nat Clin Pract Cardiovasc Med, 2006, 3(9): 499–506. DOI:10.1038/ncpcardio0632 |
 2019, Vol. 45
2019, Vol. 45


