扩展功能
文章信息
- 王松, 郭瀛泽, 李天舒, 宋金萍, 刘科苑, 周伟, 赵丽晶, 姜铁超, 郭丽荣
- WANG Song, GUO Yingze, LI Tianshu, SONG Jinping, LIU Keyuan, ZHOU Wei, ZHAO Lijing, JIANG Tiechao, GUO Lirong
- 高盐饮食对尿素通道蛋白B基因缺失小鼠动脉血压的影响及其机制
- Effect of high salt diet on arterial blood pressure in urea transporter B gene depletion mice and its mechanism
- 吉林大学学报(医学版), 2019, 45(05): 1052-1057
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1052-1057
- 10.13481/j.1671-587x.20190514
-
文章历史
- 收稿日期: 2018-01-22
2. 吉林大学基础医学院病理生理学系, 吉林 长春 130021;
3. 吉林大学第一医院检验科, 吉林 长春 130021;
4. 吉林大学中日联谊医院心内科, 吉林 长春 130033
2. Department of Pathophysiology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;
3. Department of Clinical Laboratory, First Hospital, Jilin University, Changchun 130021, China;
4. Department of Cardiology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
高血压是最常见的心血管疾病,其发病率逐年上升,目前全世界高血压患者人数超过10亿,每年导致约240万死亡[1-3]。冠心病医疗结果评价和临床转化(China PEACE)[4]的研究结果显示:在我国,对高血压的控制率从1991年的2.8%提升到了2017年的5.7%,仅仅上升了不到3个百分点;但是从1991年到2017年,高血压的患病率却增加了24.6%。根据《中国心血管病报告2017》概要显示:我国心血管病死亡率占首位,估算心血管患病人数达2.9亿,其中高血压患者为2.7亿[5]。高血压已经成为威胁人类健康的关键性因素。高血压可引起多种并发症,如脑出血、心力衰竭和肾功能不全等,严重威胁人类的健康。高血压包括原发性高血压和继发性高血压,其中90%的高血压患者为原发性高血压,原发性高血压中盐敏感性高血压占绝大多数。盐敏感性高血压是盐摄入量增加导致血压明显升高,限制盐摄入可使升高血压下降的高血压类型[6]。盐摄入量增多是盐敏感性高血压发生的核心因素之一,但其作用机制尚未明确。目前国内外研究多数认为高盐饮食导致盐敏感性高血压的发生与肾脏的钠水潴溜有关。尿素通道蛋白(urea transporter, UT)是介导尿素快速跨膜转运的膜蛋白,主要包括尿素通道蛋白A (ureatransporter A, UT-A)和尿素通道蛋白B(urea transporter B, UT-B)2个家族,其中UT-B介导尿素快速跨膜转运的膜蛋白[7-9]。UT-A亚家族有6个成员(UT-A1~UT-A6), 主要分布在肾脏,参与尿液浓缩的过程。UT-B在脑、肾脏、红细胞、睾丸和心脏等中表达,参与尿浓缩[10]、红细胞在血液中的流动性[11]、性成熟[12]和心肌肥大[13]等过程。关于脑组织脉络丛UT-B与盐敏感性高血压之间的关系还未见报道。本课题组前期研究[7]结果显示:盐敏感性高血压(Dahl salt-sensitive hypertension, Dahl S)大鼠给予高盐饮食2周后,脑组织脉络丛(choroid plexus,CP)中UT-B mRNA的表达水平明显降低,大鼠血压明显升高,提示UT-B可能参与了大鼠Dahl S的形成。为阐明表达于CP的UT-B与Dahl S之间的关系,本研究结果以UT-B基因缺失(UT-B-/-)小鼠为研究对象,给予4周高盐饮食,通过探讨高盐饮食对UT-B-/-小鼠平均动脉血压的影响,阐明UT-B-/-导致Dahl S的可能机制,为Dahl S防治提供新的思路和治疗靶点。
1 材料与方法 1.1 实验动物、主要试剂和仪器12只UT-B-/-小鼠和12只UT-B+/+小鼠(遗传背景为C57)由北京大学杨宝学教授馈赠,饲养于吉林大学基础医学院实验动物中心,昼夜等时(12 h/12 h昼/夜)、室内温度22℃±2℃,清洁级饲养,自由进食饮水。十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、丙烯酰胺、Tris-base、甲醇、N, N-二甲基双丙烯酰胺、溴化乙锭(EB)、琼脂糖、蛋白酶K和实验所需引物均购自上海生工生物工程有限公司,TRIzol试剂、dNTP、Oligo-DT、逆转录酶、DL2000和蛋白Maker均购自大连宝生物有限公司,UT-B兔抗鼠多克隆抗体(上海优宁维生物科技股份有限公司),钠离子试剂盒C002(南京建成生物工程研究所)。动物无创血压计(Kent公司,美国),低温高速离心机和Multiskan Spectrum酶标仪(Thermo公司,美国),推拉式切片机(Leica公司,日本),组织包埋系统和组织脱水机(Sakura公司,日本),显微镜(Olympus公司,日本),自动高压蒸汽消毒器(Sony公司,日本),低温冰箱(Sanyo公司,日本),电子天平(Ohaus公司,美国),TP 600 PCR仪(TaKaRa公司,日本)。
1.2 小鼠基因组DNA的UTB基因型鉴定配制新鲜的DNA裂解液提取小鼠尾基因组DNA。PCR反应扩增体系内:基因组DNA 2 μL, 2×Power Taq PCR Mix 12.5 μL, 1 μmol·L-1的引物1为1 μL,引物2和3各0.5 μL,双蒸水8.5 μL;扩增条件:94℃、5 min热启动;94℃、60 s,60℃、45 s,72℃、1 min,30个循环;72℃延伸5 min;PCR扩增产物用1%琼脂糖凝胶电泳,紫外灯下观察结果。引物序列:引物1: 5′-GGATCTGCCTTCCAAGAAACTCGTGTC-3′;引物2: 5′ -CTAT- GGCTTCTGAGGCGGAAAGAACC-3′;引物3: 5′-CAGGCCAGAGGGACAGCACAAACA-3′。
1.3 实验动物分组4周龄遗传背景相同的雄性UT-B-/-小鼠和UT-B+/+小鼠,随机分为4组,每组6只;给予普通饮食(0.3% NaCl)或高盐饮食(8.0% NaCl)4周。建立动物模型:UT-B+/+小鼠+普通饮食(UT-B+/++N)组、UT-B-/-小鼠+普通饮食(UT-B-/-+N)组、UT-B+/+小鼠+高盐饮食(UT-B+/++H)组和UT-B-/-小鼠+高盐饮食(UT-B-/-+H)组。
1.4 RT-PCR法检测小鼠脑组织CP中UT-B mRNA表达获得小鼠脑组织CP:20%乌拉坦麻醉并处死小鼠,利用无菌器械沿大脑矢状位切开头皮暴露骨;剪断颈椎,分离颅脑,避免损伤脑组织;清除表面血液,剥去软脑膜,将小鼠脑切片模具置于冰上,应用冠状位框固定大脑,无菌生理盐水润洗大脑;取大脑嗅球侧的第3~7张脑切片,无菌分离脑组织CP。TRIzol一步法提取小鼠脑组织CP总RNA:逆转录成cDNA。PCR(25 μL)扩增体系:cDNA 2 μL, 2×Power Taq PCR Mix 12.5 μL, 1 μmol·L-1的上下游引物各2 μL,双蒸水6.5 μL。β-actin为内参。扩增条件:94℃、5 min热启动;94℃、30 s,55℃、30 s,72℃、45 s,30个循环;72℃延伸5 min。PCR扩增产物用1%琼脂糖凝胶进行电泳,紫外灯下观察结果。引物序列:β-actin,Forward primer 5′-TTGTTACCAA- CTGGGACG-3′, Reverse primer 5′-GGCATAGA-GGTCTTTACGG-3′;UT-B, Forward primer 5′-CCACTCTGACAGCCCTCTT-3′, Reverse primer 5′-GATGACACCCAGCAACG-3′。
1.5 Western blotting法检测小鼠脑组织CP中UT-B蛋白表达水平取小鼠脑组织CP,方法同1.4。提取总蛋白,Bio-Rad蛋白检测试剂盒测定蛋白浓度。100℃煮沸蛋白变性,12% SDS-聚丙烯酰胺凝胶电泳浓缩胶(75 V,30 min),分离胶(110 V,90 min)进行电泳。电泳结束后,湿转;封闭;杂交,显色。内参为β-actin;一抗分别为抗-β-actin鼠单克隆抗体(1:3 000),兔抗小鼠UT-B蛋白抗体(1:500);二抗分别为山羊抗小鼠蛋白抗体(1:5 000),山羊抗兔蛋白抗体(1:5 000)。ECL化学发光显色成像系统观察目的条带,拍照、保存图像。
1.6 HE染色观察小鼠CP组织结构及免疫组织化学法检测UT-B蛋白在小鼠脑组织CP中表达的分布取小鼠脑组织,经4%多聚甲醛固定24 h,经脱水、透明、浸蜡、包埋、切片、染色和封固后显微镜下观察小鼠CP的结构变化及UT-B蛋白的分布。一抗应用兔抗小鼠UT-B蛋白抗体(1:250),二抗应用山羊抗兔蛋白抗体(1:1 000)。
1.7 小鼠脑脊液钠离子水平的测定小鼠脑脊液的收集:①剪去小鼠背部毛发暴露皮肤并消毒;②取两耳连线剪一横切口(约1.0 cm),取其中点向尾侧皮下剪开1.5 cm;③紧贴头骨逐层分离各肌层,出血处用无菌纱布按压止血,保持术口清洁;④接近颈后黄韧带时,用7号针头分离覆盖肌肉,暴露寰枕膜,用1 mL注射器的针头,针斜面向上,尖端近水平刺入蛛网膜下腔,缓慢抽出脑脊液。按照试剂盒说明书,检测钠离子水平,单位为mmol·L-1。
1.8 小鼠血清血管紧张素Ⅱ(Ang Ⅱ)水平的测定眼球取血:左手抓牢小鼠,剪断小鼠胡须防止引起溶血;轻压眼部皮肤,使眼球充血突出,用镊子夹取眼球并快速摘取,并使血液从眼眶内滴入洁净级的EP管中。室温静止10 min,3000r·min-1离心10 min,抽取上层血清,按试剂盒说明书检测Ang Ⅱ水平,单位为ng·L -1。
1.9 小鼠饮水量的测定每日22:00点用量筒测量小鼠的每日饮水量(mL),并记录。
1.10 小鼠动脉压的监测利用Kent Scientific血压计,严格按照说明书操作,采用“无创法”每日上午10:00监测小鼠平均动脉压,每只小鼠检测3次,计算并记录平均动脉压的平均值(mmHg)。
1.11 统计学分析采用GraphPad Prism 5.0统计软件进行统计学分析。各组小鼠饮水量、平均动脉压、脑脊液钠离子水平和血清AngⅡ水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 UT-B-/-小鼠的获得杂合子小鼠交配产生遗传背景相同的子代小鼠,采用鼠尾基因组DNA PCR法鉴定子代小鼠基因型,结果显示:UT-B+/+小鼠在400 bp处有一条碱基片段,UT-B+/-小鼠分别在250和400 bp处各有一条碱基片段;UT-B-/-小鼠在250 bp处有一条碱基片段。见图 1。

|
| M:1 000 bp marker; Lane 1: UT-B-/- mice; Lane 2: UT-B+/- mice; Lane 3:UT-B+/+ mice. 图 1 基因组DNA PCR法鉴定小鼠基因型 Fig. 1 Identification of genotypes in mice by genomic DNA PCRmethod |
|
|
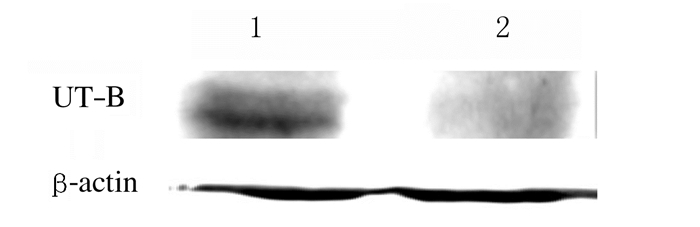
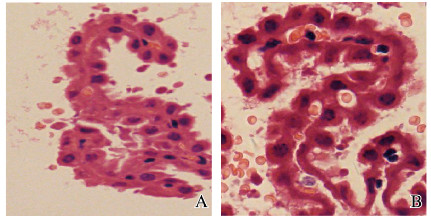
RT-PCR法检测结果:UT-B+/+小鼠脑组织CP组织可检测到500 bp处条带;UT-B-/-小鼠脑组织CP未见此条带(图 2);Western blotting法检测结果显示:UT-B+/+小鼠脑组织CP可检测到相对分子质量为45000的条带,UT-B-/-小鼠脑组织CP无此条带(图 3);HE染色法检测结果显示:UT-B+/+和UT-B-/-小鼠脑组织CP(图 4,见插页四);免疫组织化学法检测结果显示:UT-B蛋白表达于UT-B+/+小鼠脑组织CP上皮细胞,而UT-B-/-小鼠脑组织CP上皮细胞中无UT-B蛋白表达(图 5,见插页四)。

|
| Lane 1:UT-B+/+ mice; Lane 2:UT-B-/- mice. 图 2 RT-PCR法检测小鼠脑组织CP中UT-B基因的表达 Fig. 2 Expressions of UT-B gene in CP of brain tissue of mice detected by RT-PCR method |
|
|
|
| Lane 1:UT-B+/+ mice; Lane 2:UT-B-/- mice. 图 3 Western blotting法检测小鼠脑组织CP中的UT-B蛋白表达 Fig. 3 Expressions of UT-B protein in CP of brain tissue of mice detected by Western blotting method |
|
|
|
| A:UT-B+/+ mice; B:UT-B-/- mice. 图 4 小鼠CP的HE染色结果(Bar=20 μm) Fig. 4 HE staining results of CPof mice (Bar=20 μm) |
|
|

|
| A:UT-B+/+ mice; B:UT-B-/- mice. 图 5 免疫组织化学法检测UT-B基因在小鼠CP中的表达和定位(Bar=20 μm) Fig. 5 Expressions and locations of UT-B gene in CP of mice detected by immunohistochemistry(Bar=20 μm) |
|
|
UT-B+/+小鼠+普通饮食组、UT-B+/+小鼠+高盐饮食组和UT-B-/-小鼠+普通饮食组小鼠在饲养4周后脑脊液钠离子水平分别为(159.70±0.74)mmol·L-1、(159.90±1.16)mmol·L-1和(158.70± 0.84) mmol·L-1,钠离子水平比较差异无统计学意义(P>0.05);UT-B-/-小鼠+高盐饮食组小鼠脑脊液钠离子水平为(167.60±2.74) mmol·L-1,明显高于其他各组(P < 0.05)。
2.4 各组小鼠血清Ang Ⅱ水平UT-B+/+小鼠+普通饮食组和UT-B+/+小鼠+高盐饮食组、UT-B-/-小鼠+普通饮食组小鼠在饲养4周后血清中AngⅡ水平分别为(31.72±3.56) ng·L-1、(32.83±3.09) ng·L-1和(31.89±0.67) ng·L-1,组间比较差异无统计学意义(P>0.05);UT-B-/-小鼠+高盐饮食组小鼠血清中Ang Ⅱ水平(55.66 ng·L-1±1.59 ng·L-1)明显高于其他各组(P < 0.01)。
2.5 各组小鼠饮水量给予高盐饮食后小鼠饮水量明显增加,在给予高盐饮食第8天饮水量基本趋于稳定,UT-B+/+和UT-B-/-小鼠饮水量分别为(20.4 ±0.94)mL·d-1和(16.83±0.50)mL·d-1,较普通饮食组小鼠饮水量[UT-B+/+和UT-B-/-小鼠饮水量分别为(7.47 ±0.61)mL·d-1和(6.72 ±1.61)mL·d-1]明显增加(P<0.01)。给予高盐饮食后小鼠饮水量明显增加,在给予高盐饮食第8天饮水量基本趋于稳定,UT-B+/+和UT-B-/-小鼠饮水量分别为(20.4 ±0.94) mL·d-1和(16.83 ±0.50)mL·d-1,较普通饮食组小鼠明显增加(P < 0.01)。
2.6 各组小鼠平均动脉压未给予高盐饮食前,UT-B+/+小鼠+普通饮食组、UT-B-/-小鼠+普通饮食组、UT-B+/+ +高盐饮食组、UT-B-/-小鼠+高盐饮食组小鼠平均动脉压比较差异无统计学意义(P>0.05);UT-B-/-小鼠给予高盐饮食后平均动脉压在第4天开始升高,第8和28天时明显高于其他3组(P < 0.01)。见表 1。
| (n=6, x±s, P/mmHg) | |||||
| Group | Mean arterial pressure | ||||
| (t/d) 0 | 4 | 8 | 28 | ||
| UT-B+/++N | 103.67±1.19 | 113.60±5.02 | 118.77±1.11 | 110.60±0.43 | |
| UT-B-/-+N | 101.77±1.11 | 107.70±1.81 | 114.70±1.49 | 108.67±2.57 | |
| UT-B+/++H | 104.87±2.09 | 111.37±3.09 | 117.10±4.68 | 118.97±1.44 | |
| UT-B-/-+H | 102.83±1.55 | 117.67±6.91 | 132.30±4.01*△# | 154.63±1.88*△# | |
| UT-B+/+mice+N:UT-B+/+ mice +normal salt diet; UT-B-/- +N:UT-B-/-mice+normal salt diet; UT-B+/++H:UT-B+/+mice+high salt diet; UT-B-/- +H:UT-B-/-mice+high salt diet. * P < 0.01 vs UT-B+/++N group; △P < 0.01 vs UT-B-/-+N group; # P < 0.01 vs UT-B+/++H group. | |||||
Dahl S在原发性高血压中所占比例最大,盐敏感性是指在高血压患者和血压正常的个体中,改变膳食中盐的摄入量而引起血压发生不同变化的现象[14]。目前研究普遍认为盐摄入量是影响血压升高的最重要的可控因素[15]。盐摄入量增加导致Dahl S大鼠和自发性高血压大鼠(spontaneously hypertensive rat, SHR)的CSF钠离子水平升高,但不影响对盐不敏感性大鼠的脑脊液中钠离子水平[16],升高的脑脊液中钠离子会刺激下丘脑周围组织,并激活中枢性交感神经兴奋通路,后者引起AngⅡ分泌增多进而导致血压升高[17]。本研究检测了UT-B+/+和UT-B-/-小鼠在给予普通饮食或高盐饮食4周后脑脊液中钠离子水平,结果显示:UT-B+/+小鼠+普通饮食组、UT-B-/-小鼠+普通饮食组和UT-B+/+小鼠+高盐饮食组的CSF钠离子水平无明显变化,UT-B-/-小鼠+高盐饮食组小鼠脑脊液中钠离子水平明显升高,UT-B-/-小鼠给予高盐饮食后,血清Ang Ⅱ水平明显升高而UT-B+/+小鼠+普通饮食组、UT-B-/-小鼠+普通饮食组和UT-B+/+小鼠+高盐饮食组小鼠血清Ang Ⅱ水平无明显变化。以上结果与Dahl S大鼠给予高盐饮食后脑脊液中钠离子水平和血清Ang Ⅱ水平变化一致[7],表明UT-B基因缺失提高了小鼠对盐的敏感性。
脑脊液是由脑组织CP上皮细胞分泌,最后通过蛛网膜颗粒回渗到静脉系统[18-19]。CP上皮细胞侧缘近游离端的紧密连接、上皮下方的基膜和基膜下毛细血管有孔内皮构成“血-脑脊液屏障”;脑组织CP上皮细胞的基底膜和管腔膜面有许多离子通道和共转运体表达,以维持脑脊液内环境的稳定,如上皮细胞钠离子通道(epithelial sodium channels,ENaCs)和钠-钾ATP酶(sodium-potassium ATP enzyme,Na-K-ATPase)等,以维持脑脊液内环境的稳态。UT是一类介导尿素顺浓度差快速穿过细胞膜的膜蛋白,其通透速度远超过简单扩散。哺乳动物的UT-B由SLC14α1基因编码,UT-A由SLC14α2基因编码[20]。UT-B主要分布在肾脏,参与尿液浓缩过程[21]。为了明确UT-B与脑脊液钠离子水平之间的关系,本研究检测了UT-B基因和蛋白在脑组织的表达与定位,结果显示:UT-B基因表达于UT-B+/+小鼠脑组织CP;Western blotting法和免疫组织化学法检测结果显示:UT-B蛋白表达于UT-B+/+小鼠脑组织CP上皮细胞,与本课题组前期研究[8]结果一致。因此本文作者推测:表达于小鼠脑组织CP上皮细胞的UT-B缺失时,可引起小鼠盐敏感性高血压的发生,高盐饮食导致UT-B+/+和UT-B-/-小鼠饮水量明显增加,这与盐摄入量增加导致渗透压升高,刺激口渴中枢有关。UT-B-/-小鼠在给予高盐饮食后平均动脉压明显升高,其他3组小鼠平均动脉压实验前后无明显差异,表明表达于小鼠脑组织CP上皮细胞的UT-B缺失后,可引起小鼠盐敏感性增强,再给予高盐饮食后导致脑组织CP上皮细胞钠离子转运过程的改变,引起脑脊液钠离子水平的改变,进而导致血清Ang Ⅱ水平增加引起血压升高。
综上所述,对于UT-B基因缺失是如何导致小鼠脑脊液钠离子浓度升高的相关机制目前尚不清楚,SCHWEDA等[22]研究结果提示:脑脊液中的钠离子来源于脑组织CP上皮细胞的离子转运体对钠离子的转运,小鼠脑组织脉络丛上皮细胞表达的UT-B-/-是否影响脉络丛上皮细胞离子转运体的表达(ENaC和Na-K-ATPase)还有待进一步研究。
| [1] | MARQUES F Z, MACKAY C R, KAYE D M. Beyond gut feelings:how the gut microbiota regulates blood pressure[J]. Nature Rev Cardiol, 2018, 15(1): 20–32. DOI:10.1038/nrcardio.2017.120 |
| [2] | NOVELLO M F, RPSA M L, FERREIRA R T, et al. Compliance with the Prescription of antihypertensive medications and blood Pressure control in Primary Care[J]. Arq Bras Cardiol, 2017, 108(2): 135–142. |
| [3] | FRANCESCO T, MIRIAM Z. The role of the kidney in salt-sensitive hypertension[J]. Clin Exp Nephrol, 2012, 16(1): 68–72. DOI:10.1007/s10157-011-0489-y |
| [4] | LU J P, LU Y, WANG X C, et al. Prevalence, awareness, treatment, and control of hypertension in China-data from 1.7 million adults in a population-based screening study (China PEACE Million Persons Project)[J]. Lancet, 2017, 390(10112): 2549–2558. DOI:10.1016/S0140-6736(17)32478-9 |
| [5] | 陈伟伟, 高润霖, 胡盛寿. 《中国心血管病报告2017》概要[J]. 中国循环杂志, 2017, 32(6): 521–530. DOI:10.3969/j.issn.1000-3614.2017.06.001 |
| [6] | 罗怡, 陈明. 盐敏感性高血压研究进展[J]. 心血管病学进展, 2013, 34(5): 644–647. DOI:10.3969/j.issn.1004-3934.2013.05.014 |
| [7] | GUO L R, MENG J, XUAN C L, et al. High salt-diet reduces SLC14A1 gene expression in the choroid plexus of Dahl salt sensitive rats[J]. Biochem Biophys Res Commun, 2015, 461(2): 254–259. DOI:10.1016/j.bbrc.2015.04.010 |
| [8] | 钟丹丹, 杨宝学. 尿素通道蛋白B的转运特性[J]. 生理学研究, 2014, 2(1): 1–4. |
| [9] | LIU L Q, SUN Y X, ZHAO Y X, et al. Urea transport B gene induces melanoma B16 cell death via activation of p53 and mitochondrial apoptosis[J]. Cancer Sci, 2018, 109(12): 3762–3773. DOI:10.1111/cas.13825 |
| [10] | LI X C, CHEN G P, YANG B X. Urea transporter physiology studied in knockout mice[J]. Front Physiol, 2012, 3: 217. |
| [11] | GENG X Q, LEI T L, ZHOU H, et al. The knockout of urea transporter-B improves the hemorheological properties of erythrocyte[J]. Clin Hemorheol Microcirc, 2017, 65(3): 249–257. DOI:10.3233/CH-16174 |
| [12] | KLEIN J D. Expression of urea transporters and their regulation[J]. Subcell Biochem, 2014, 73(1): 79–107. |
| [13] | 姜涛, 杨宝学. 尿素通道蛋白的组织分布和生理功能[J]. 神经药理学报, 2015, 5(5): 40–48. DOI:10.3969/j.issn.2095-1396.2015.05.007 |
| [14] | KOTCHEN T A, COWLEY A W, FROHLICH E D. Salt in health and disease-A delicate balance[J]. N Engl J Med, 2013, 368(13): 1229–1237. DOI:10.1056/NEJMra1212606 |
| [15] | BLAUSTEIN M P, LEENEN F H H, CHEN L, et al. How NaCl raise blood pressure:a new paradigm for the pathogenesis of salt-dependent hypertension[J]. Am J Physiol Heart Circ Physiol, 2012, 302(5): H1031–H1049. DOI:10.1152/ajpheart.00899.2011 |
| [16] | JIANG E S, CHAPP A D, FAN Y Y, et al. Expression of proinflammatory cytokines is upregulated in the hypothalamic paraventricular nucleus of Dahl salt-sensitive hypertensive rats[J]. Front Physiol, 2018, 9: 104. DOI:10.3389/fphys.2018.00104 |
| [17] | NAKANO M, HIROOKA Y, MATSUKAWA R, et al. Mineralocorticoid-receptors/epithelial Na+ channels in the choroid plexus are involved in hypertensive mechanisms in stroke-prone spontaneously hypertensive rats[J]. Hypertens Res, 2013, 36(3): 277–284. DOI:10.1038/hr.2012.174 |
| [18] | KIBATHI L W, BAE S, PENZAK S R, et al. Potential influence of centrally acting herbal drugs on transporters at the blood-cerebrospinal fluid barrier and blood-brain barrier[J]. Eur J Drug Metab Pharmacokinet, 2018, 43(6): 619–635. DOI:10.1007/s13318-018-0486-6 |
| [19] | TUMANI H, HUSS A, BACHHUBER F. The cerebrospinal fluid and barriers-anatomic and physiologic considerations[J]. Handb Clin Neurol, 2017, 146(1): 21–32. |
| [20] | SANDS J M, BLOUNT M A. Genes and proteins of urea transporters[J]. Subcell Biochem, 2014, 73: 45–63. |
| [21] | ESTEVA-FONT C, ANDERSON M O, VERKMAN A S. Urea transporter proteins as targets for small-molecule diuretics[J]. Nat Rev Nephrol, 2015, 11(2): 113–123. DOI:10.1038/nrneph.2014.219 |
| [22] | SCHWEDA F. Salt feedback on the renin-angiotensin-aldosterone system[J]. Pflugers Arch, 2015, 467(3): 565–576. DOI:10.1007/s00424-014-1668-y |
 2019, Vol. 45
2019, Vol. 45


