扩展功能
文章信息
- 岳圆, 徐瀛濂, 王晶晶, 孙敏英, 张泽南, 赵馨越, 李宗璞, 台桂香
- YUE Yuan, XU Yinglian, WANG Jingjing, SUN Minying, ZHANG Zenan, ZHAO Xinyue, LI Zongpu, TAI Guixiang
- JNK酶活性下调对人前列腺癌、肝细胞癌和乳腺癌细胞生长的抑制作用
- Inhibitory effects of down-regulation of JNK enzymatic activity on growth of human prostate cancer cells, hepatocellular carcinoma cells and breast cancer cells
- 吉林大学学报(医学版), 2019, 45(05): 1046-1051
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1046-1051
- 10.13481/j.1671-587x.20190513
-
文章历史
- 收稿日期: 2018-05-02
2. 吉林大学基础医学院免疫学教研室, 吉林 长春 130021
2. Department of Immunology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是丝裂原活化蛋白激酶(MAPK)家族成员,属于蛋白激酶。活化的JNK可以与激活转录因子-2 (ATF2)及c-Jun的氨基末端区域结合, 使转录因子的活性区域发生磷酸化[1]。哺乳动物类的JNK包含3种亚型:JNK1、JNK2和JNK3。JNK1和JNK2几乎在所有的细胞中表达,而JNK3则主要表达于大脑、心脏以及睾丸组织中[2]。JNK激活后,可以通过下游底物调控细胞增殖、存活、分化和代谢,在多种癌症的发生发展中发挥重要作用[3]。早期研究[4-6]显示:多种癌基因,如Ras、Bcr-Abl、Met和c-Fos传递的癌基因信号依赖JNK的激活,表明JNK信号参与癌基因信号传导促进癌症进展。本课题组前期研究[7-8]显示:癌基因Mucin 1可以通过激活JNK促进肝细胞癌的发生和发展,推测以JNK为靶点的抗肿瘤研究有着广阔的前景。RNA干扰(RNA interference,RNAi)在癌症治疗中的有效性、高特异性以及低成本等优势,使其在癌症治疗中发挥着越来越重要的作用[9]。RNAi也称转录后基因沉默作用,是目前常用的基因沉默技术,其能够通过激活内源性机制促使细胞内特定蛋白质的信使RNA(messenger RNA,mRNA)前体降解,从而阻断该蛋白质的生物合成,从而有效地、特异性地下调基因的表达[10-11]。目前,国际上已有多个RNAi治疗药物进入临床试验,表明RNAi对癌症治疗具有潜在的临床应用价值[12-14]。然而,一些限制使得小干扰RNA(small interfering RNA,siRNA)在临床应用方面有着一定的困难。首先未修饰的siRNA在血流中不稳定,在体内递送时遇到很多障碍,不能有效地将药物导入体内的细胞[15-17];其次脱靶行为也可引起一些不良反应,同时siRNA在基因沉默过程中会引起目的细胞原有生理功能的紊乱,并且会诱导先天性的免疫应答。因此对siRNA进行优化是解决临床应用问题的有效途径之一。本研究拟采用JNK抑制剂SP600125和JNK-siRNA 2条途径沉默JNK基因,并在JNK-siRNA途径中使用脂质纳米粒子(lipid nanoparticles,LNP)运载JNK-siRNA,利用其易穿透肿瘤细胞间隙的特性[18],以期达到体内癌细胞内的高效载入,从而有效抑制JNK酶活性;建立小鼠皮下人前列腺癌、肝细胞癌和乳腺癌移植瘤动物模型,通过体外和体内实验,探讨这2条途径对肿瘤生长的抑制作用,为开发以JNK为靶点的小分子酶抑制剂奠定实验和理论基础。
1 材料与方法 1.1 实验动物、细胞、菌株、主要试剂和仪器BALB/c裸鼠8只,4~6周龄、体质量为20~22 g,动物许可证号:SCXK(京)2014-0004,购自北京阜康生物科技股份有限公司,雌雄各半,在无菌环境下饲养。人前列腺癌PC-3细胞、人肝细胞癌SMMC-7721细胞和人乳腺癌MCF-7细胞均由本室保存。脂质纳米粒子LNP购于陕西西安瑞禧生物有限公司,IMDM培养液和血清购于美国Gibco公司,JNK抑制剂SP600125购于英国Abcam公司,X-fect转染试剂购于日本TaKaRa公司,WST-1购于瑞士Roche公司,JNK-siRNA购于广州锐博生物科技有限公司, IHC检测试剂盒购于福州迈新生物技术公司,兔抗人JNK抗体和兔抗人p-JNK抗体购于美国Cell Signaling Technology公司,山羊抗兔IgG-HRP抗体和山羊抗小鼠IgG-HRP抗体购于美国Santa公司。IX71型荧光显微镜(日本奥林巴斯公司), BioTek Synergy H1型酶标仪(美国BioTek公司), ECL型发光仪(美国GE公司)。
1.2 实验细胞处理细胞在含有100 U·mL-1青霉素、100 mg·L-1链霉素和10%胎牛血清的IMDM培养液,于37℃、5%CO2细胞培养箱中培养,取对数生长期细胞用于实验。
1.3 WST-1增殖实验检测细胞活性细胞铺96孔板,每孔200 μL,放入CO2细胞培养箱中培养24 h,提前2 h将培养基更换为血清的IMDM培养基,每孔90 μL。配制转染混合物,每孔10 μL,转染4h后,更换为含有血清的IMDM培养基。在转染后24和48 h检测正常肿瘤细胞和采用siRNA沉默JNK和抑制剂SP600125处理后的肿瘤细胞的活力:每孔吸弃100μL细胞上清后,加入10μLWST-1溶液,轻轻敲打混匀,放入CO2细胞培养箱中采用酶标仪测定450 nm处吸光度(A)值。细胞活性= (实验孔A值-对照孔A值)/对照孔A值。
1.4 Western blotting法检测肿瘤细胞中JNK或p-JNK蛋白表达水平采用细胞刮收集PC-3、SMMC-7721和MCF-7细胞,通过Western blotting法检测JNK-siRNA和抑制剂SP600125处理后的肿瘤细胞中的JNK或p-JNK蛋白表达水平。siRNA组使用JNK-siRNA和NC-siRNA分别转染PC-3、SMMC-7721和MCF-7细胞,转染48 h后收集细胞,RIPA裂解液提取蛋白,用于后续实验。抑制剂SP600125组使用SP600125处理SMC-7721细胞后,用RIPA裂解液提取总蛋白,用于后续实验。采用BCA蛋白定量试剂盒按照说明书进行蛋白浓度的测定。蛋白变性处理后,SDS-PAGE凝胶电泳分离细胞蛋白,根据预染Marker条带停止电泳。之后湿转至PVDF膜,采用TBS-T配制的3% BSA或5%脱脂奶粉进行封闭。4℃封闭过夜;封闭后加入稀释的一抗,siRNA组一抗采用兔抗人JNK抗体,抑制剂SP600125组采用兔抗人p-JNK抗体。4℃孵育过夜。2组二抗分别采用山羊抗兔IgG-HRP抗体和山羊抗小鼠IgG-HRP抗体,常温摇床孵育2 h,采用TBS-T洗涤3次,每次5~10 min。ECL显影后采用ECL发光仪曝光,收集图像进行分析并利用软件Quantity One检测蛋白灰度值,计算蛋白表达水平。
1.5 siRNA的制备及应用siRNA的制备:一对靶向JNK的siRNA(JNK-siRNA),一对阴性对照NC-siRNA和一对NC-siRNA-Cy3均由广州锐博生物科技有限公司合成。JNK-siRNA的靶序列:5′-AGAAGGTAGGACATTCTTT-3′,正义链:5′-AGAAGGUAGGACAUUCUUUdTdT -3′, 反义链:3′-dTdTUCUUCCAUCCUGUAAGAAA-5′。siRNA的应用:体外实验中,siRNAs通过转染试剂X-fect转染至PC-3、SMMC-7721和MCF-7细胞中,使用NC-siRNA-Cy3-LNP检测转染效率。在体内实验中,JNK-siRNA-LNP和NC-siRNA-LNP均采用脂质纳米粒子包裹进行修饰,5 nmol siRNA溶于0.05 mL溶液中进行瘤内多点注射。
1.6 脂质纳米粒子介导的JNK-siRNAs的合成采用脂质纳米粒子LNP按照说明与已合成好的siRNAs进行包裹,形成siRNAs-LNP。
1.7 裸鼠皮下移植瘤模型的建立及肿瘤体积的测定将SMMC-7721细胞皮下注射到BALB/c裸小鼠右侧腋窝下方,待肿瘤长至3 mm×3 mm,再将8只小鼠随机分为4组,分别为抑制剂SP600125及其阴性对照组,JNK-siRNA组和NC-siRNA对照组,每组2只。SP600125组及其阴性对照组给予0.2 mg·kg-1SP600125或相同体积的生理盐水,共给药5次,每次给药间隔为1 d;JNK-siRNA-LNP组和NC-siRNA-LNP对照组小鼠给予5 nmol JNK-siRNA-LNP或NC-siRNA-LNP,给药6次,每次给药间隔为2 d,给药方式为瘤内直接注射,最后一次给药后3 d,小鼠安乐死,剥离裸鼠皮下移植瘤组织,测量体积后以甲醛固定。
1.8 免疫组织化学染色检测蛋白表达量采用石蜡包埋固定于甲醛中的肿瘤组织,切片,切片厚度为3μm。采用IHC免疫组织化学试剂盒按说明书操作检测肿瘤组织中JNK或p-JNK蛋白表达量,采用IX71显微镜在200倍视野下选取不同区域进行拍照,以出现咖啡色斑点为JNK或p-JNK阳性表达。通过Image Pro Plus 6.0软件分析蛋白表达量。
1.9 统计学分析采用SPSS 21.0软件进行统计学分析。24和48 h细胞活力以及体外实验中p-JNK蛋白表达水平以x±s表示, 2组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 体外实验siRNA组中肿瘤细胞JNK蛋白表达水平及细胞生长情况JNK-siRNA/NC-siRNA在PC-3、SMMC-7721和MCF-7肿瘤细胞中转染效率均大于95%。见图 1(插页三)。图 2中JNK-siRNA转染至3种肿瘤细胞后,JNK蛋白条带颜色与转染NC-siRNA相比均明显变浅(P<0.01)。转染24 h后,在转染率大于95%时,与NC-siRNA组比较,JNK-siRNA组肿瘤细胞的细胞活性下降(P<0.01),抑制率分别为31%、38%和41%,而随着时间增加,抑制效果稍有减弱(P<0.01),抑制率分别为29%、38%和38%。见图 3。
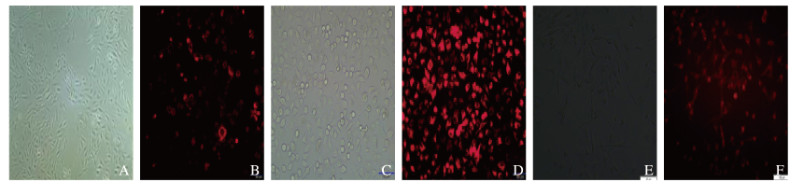
|
| A, B:PC-3 cells; C, D:SMMC-7721 cells; E, F:MCF-7 cells; A, C, E:Light; B, D, F:Cy3. 图 1 JNK-siRNA在PC-3、SMMC-7721和MCF-7肿瘤细胞中的瞬时转染情况(×200) Fig. 1 Transient transfection of JNK-siRNA in PC-3, SMMC-7721, and MCF-7 cells (×200) |
|
|

|
| A: PC-3 cells; B:SMMC-7721 cells; C:MCF-7 cells. Lane 1:NC-siRNA; Lane 2:JNK-siRNA 图 2 NC-siRNA/JNK-siRNA转染后PC-3、SMMC-7721和MCF-7细胞中JNK蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of JNK in PC-3, SMMC-7721, and MCF-7 cells after transfected by NC-siRNA and JNK-siRNA |
|
|

|
| A:PC-3 cells; B:SMMC-7721 cells; C:MCF-7 cells; *P < 0.01 compared with NC-siRNA group. 图 3 JNK-siRNA/NC-siRNA转染后24和48 hPC-3、SMMC-7721和MCF-7细胞活性 Fig. 3 Cell viabilities of PC-3, SMMC-7721, and MCF-7 cells 24 and 48 h after transfected by NC-siRNA and JNK-siRNA |
|
|
肝细胞癌细胞SMMC-7721细胞中导入抑制剂SP600125,与SP600125阴性对照组比较,抑制剂SP600125组肿瘤细胞中p-JNK蛋白的条带颜色明显变浅,p-JNK蛋白表达水平降低(P<0.01),抑制率达到69%。见图 4。
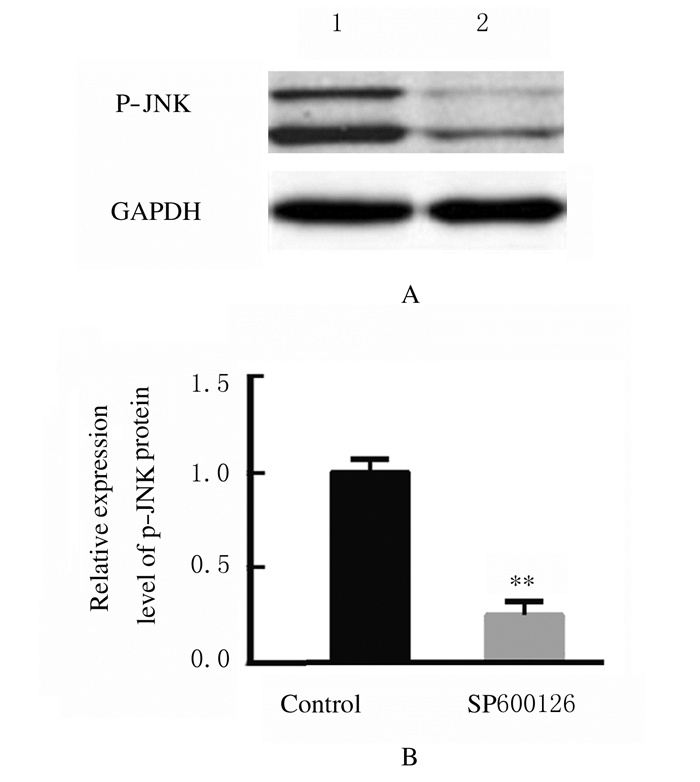
|
| A:Electrophoregram; B:Histogram; Lane 1:Untreated; Lane 2: SP600125. 图 4 SMMC-7721细胞中p-JNK蛋白表达 Fig. 4 Expressions of p-JNK in SMMC-7721 cells |
|
|
与SP600125阴性对照组比较,抑制剂SP600125组小鼠皮下移植瘤体积明显减小,而JNK-siRNA组小鼠皮下移植瘤的体积与其阴性对照组比较变化不明显。见图 5(插页四)。免疫组织化学染色检测结果:抑制剂SP600125组p-JNK蛋白表达水平较其阴性对照组明显减少,而JNK-siRNA组JNK蛋白的表达水平较对照组有所减少,但减少情况与抑制剂SP600125组比较并不明显。见图 6(插页四)。
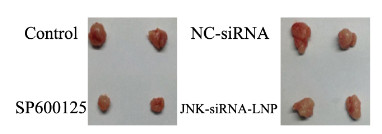
|
| 图 5 抑制剂SP600125和JNK-siRNA-LNP作用后体内SMMC-7721肿瘤生长情况 Fig. 5 Growth of SMMC-7721 tumor after treated with SP600125 and JNK-siRNA-LNP in vivo |
|
|
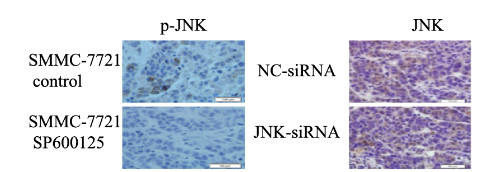
|
| 图 6 各组SMMC-7721细胞中p-JNK/JNK的表达情况(×200) Fig. 6 Expressions of p-JNK/JNK in SMMC-7721 cells in various groups(×200) |
|
|
迄今为止,已经开发出许多可能调节JNK信号传导特定组分的小分子抑制剂。这些抑制剂分为2类:ATP竞争性抑制剂和ATP非竞争性抑制剂。ATP竞争性抑制剂包括SP600125、CC-401、CC-930、AS601245和JNK-IN-8等。最具代表性的ATP非竞争性抑制剂是D-JNKI-1,也被命名为XG-102/AM-111,尽管D-JNKI-1尚未应用于癌症的治疗,但临床试验[19-20]证明:D-JNKI-1在预防和治疗急性耳蜗损伤引起的永久性感音神经性听力损失中起到积极作用;其在降低白内障手术后疼痛和眼内炎症的疗效及安全性方面的研究已经完成[21]。
鉴于抑制剂的有效性以及RNAi细胞毒性小的特点,本研究使用抑制剂和RNAi2种途径沉默肿瘤细胞中JNK的表达。实验结果表明:在体外实验,抑制剂SP600125和JNK-siRNA均可有效抑制p-JNK和JNK基因的表达,降低细胞活力,从而达到抑制肿瘤细胞增殖的目的。在体内实验,抑制剂SP600125可以有效地抑制肿瘤的生长,相较于抑制剂SP600125,脂质纳米粒子包裹的JNK-siRNA对肿瘤生长抑制作用并不明显。免疫组织化学染色法检测结果显示:抑制剂SP600125和JNK-siRNA-LNP均使p-JNK和JNK的表达减少,表明通过抑制剂和JNK-siRNA这2条途径均可下调JNK酶的活性,进一步影响肿瘤细胞的生长,达到治疗肿瘤的目的。
综合本课题组之前的研究和本次抑制剂SP600125的使用,进一步确定了JNK是抗肿瘤的一个有效靶点,为下一步研究奠定了坚实的基础。在选择下调JNK酶活性的途径方面,虽然抑制剂可以更有效地在体内抑制肿瘤生长,但特异性不高,其细胞毒性相对于siRNA来说比较大,因此仍需找出合适的siRNA来对JNK基因进行沉默。在本研究中,JNK-siRNA在体外实验中抑制效果良好,体内实验中抑制肿瘤生长效果不理想,其原因可能是:①体内环境较复杂,JNK-siRNA-LNP可能随着细胞分裂和快速酶促降解而数量减少,从而无法发挥全部作用;②LNP将JNK-siRNA导入体内细胞后,可能无法准确地将其运输到JNK靶点,使干扰作用不明显;③干扰位点的选择也会直接影响JNK-siRNA作用的发挥。在未来的研究中,优化JNK-siRNA的导入量、改良载体的结构和性质、开发新载体、对体内JNK酶进行基因测序以及优化干扰位点等手段将会成为实验重点,以期解决现在存在的不足。
综上所述,本研究结果显示:JNK是肿瘤治疗理想的分子靶点,下调JNK酶的活性可有效地抑制肿瘤细胞的生长,在未来的肿瘤治疗中发挥积极作用。本研究结果为以JNK为靶点的抗肿瘤药物研发以及肿瘤治疗提供了理论依据。
| [1] | MANNING G, WHYTE D B, MARTINEZ R, et al. The protein kinase complement of the human genome[J]. Science, 2002, 298(5600): 1912–1934. DOI:10.1126/science.1075762 |
| [2] | WAGNER E F, NEBREDA ÁR. Signal integration by JNK and p38 MAPK pathways in cancer development[J]. Nat Rev Cancer, 2009, 9(8): 537–549. DOI:10.1038/nrc2694 |
| [3] | SEKI E, BRENNER D A, KARIN M. A liver full of JNK:signaling in regulation of cell function and disease pathogenesis, and clinical approaches[J]. Gastroenterology, 2012, 143(2): 307–320. DOI:10.1053/j.gastro.2012.06.004 |
| [4] | RODRIGUES G A. Activation of the JNK pathway is essential for transformation by the Met oncogene[J]. EMBO J, 1997, 16(10): 2634–2645. DOI:10.1093/emboj/16.10.2634 |
| [5] | BEHRENS A, JOCHUM W, SIBILIA M, et al. Oncogenic transformation by ras and fos is mediated by c-Jun N-terminal phosphorylation[J]. Oncogene, 2000, 19(22): 2657–2663. DOI:10.1038/sj.onc.1203603 |
| [6] | BUBICI C, PAPA S. JNK signalling in cancer:in need of new, smarter therapeutic targets[J]. Br J Pharmacol, 2014, 171(1): 24–37. |
| [7] | WANG J, LIU G M, LI Q S, et al. Mucin1 promotes the migration and invasion of hepatocellular carcinoma cells via JNK-mediated phosphorylation of Smad2 at the C-terminal and linker regions[J]. Oncotarget, 2015, 6(22): 19264–19278. |
| [8] | LI Q S, LIU G M, YUAN H Y, et al. Mucin1 shifts Smad3 signaling from the tumor-suppressive pSmad3C/p21(WAF1) pathway to the oncogenic pSmad3L/c-Myc pathway by activating JNK in human hepatocellular carcinoma cells[J]. Oncotarget, 2015, 6(6): 4253–4265. |
| [9] | FIRE AZ. Gene silencing by double stranded RNA[J]. Cell Death Differ, 2007, 14(12): 1998–2012. DOI:10.1038/sj.cdd.4402253 |
| [10] | PECOT C V, WU S Y, BELLISTER S, et al. Therapeutic silencing of KRAS using systemically delivered siRNAs[J]. Mol Cancer Ther, 2014, 13(12): 2876–2885. DOI:10.1158/1535-7163.MCT-14-0074 |
| [11] | YUAN T L, FELLMANN C, LEE C S, et al. Development of siRNA payloads to target KRAS-mutant cancer[J]. Cancer Discov, 2014, 4(10): 1182–1197. DOI:10.1158/2159-8290.CD-13-0900 |
| [12] | MIRZAEI H, YAZDI F, SALEHI, et al. SiRNA and epigenetic aberrations in ovarian cancer[J]. Cancer Res Ther, 2016, 12(2): 498–508. |
| [13] | AHMADZADA T, REID G, MCKENZIE D R. Fundamentals of siRNA and miRNA therapeutics and a review of targeted nanoparticle delivery systems in breast cancer[J]. Biophys Rev, 2018, 10(1): 69–86. |
| [14] | VAISHNAW A K, GOLLOB J, GAMBA-VITALO C, et al. A status report on RNAi therapeutics[J]. Silence, 2010, 1(1): 14. DOI:10.1186/1758-907X-1-14 |
| [15] | BERNSTEIN E, CAUDY A A, HANNNOND S M, et al. Role for a bidentate ribonuclease in the initiation step of RNA interference[J]. Nature, 2001, 409: 363–366. DOI:10.1038/35053110 |
| [16] | LENG Q X, WOODLE M C, LU P Y, et al. Advances in systemic siRNA delivery[J]. Drugs Future, 2009, 34(9): 721. DOI:10.1358/dof.2009.034.09.1413267 |
| [17] | JENNY G PARVANI, MARK W JACKSON. Silencing the roadblocks to effective triple-negative breast cancer treatments by siRNA nanoparticles[J]. Endocrine-Related Cancer, 2017, 24(4): R81–R97. |
| [18] | CULLIS P R, HOPE M J. Lipid nanoparticle systems for enabling gene therapies[J]. Mole Ther, 2017, 25(7): 1467–1475. DOI:10.1016/j.ymthe.2017.03.013 |
| [19] | SUCKFUELL M, CANIS M, STRIETH S, et al. Intratympanic treatment of acute acoustic trauma with a cell-permeable JNK ligand:a prospective randomized phase Ⅰ/Ⅱ study[J]. Acta Otolaryngol, 2007, 127(9): 938–942. DOI:10.1080/00016480601110212 |
| [20] | SUCKFUELL M, LISOWSKA G, DOMKA W, et al. Efficacy and safety of AM-111 in the treatment of acute sensorineural hearing loss:a double-blind, randomized, placebo-controlled phase Ⅱ study[J]. Otol Neurotol, 2014, 35(8): 1317–1326. DOI:10.1097/MAO.0000000000000466 |
| [21] | BEYDOUN T, DELOCHE C, PERINO J, et al. Subconjunctival injection of XG-102, a JNK inhibitor peptide, in patients with intraocular inflammation:a safety and tolerability study[J]. J Ocul Pharmacol Ther, 2015, 31(2): 93–99. DOI:10.1089/jop.2013.0247 |
 2019, Vol. 45
2019, Vol. 45


