扩展功能
文章信息
- 冷冰, 王大麟, 郑淑云, 韩梅, 吴震宇, 裴颖, 薛昊罡
- LENG Bing, WANG Dalin, ZHENG Shuyun, HAN Mei, WU Zhenyu, PEI Ying, XUE Haogang
- 17β-雌二醇对大鼠骨髓间充质干细胞成骨分化过程中Ca2+通道的作用
- Effect of 17β-estradiol on Ca2+ channels during osteogenic differentiation of rat bone marrow mesenchymal stem cells
- 吉林大学学报(医学版), 2019, 45(05): 1041-1045
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1041-1045
- 10.13481/j.1671-587x.20190512
-
文章历史
- 收稿日期: 2019-03-20
2. 吉林大学第二医院眼科, 吉林 长春 130041
2. Department of Ophthalmology, Second Hospital, Jilin University, Changchun 130041, China
骨质疏松症是以骨量减少和骨组织纤维结构退化为特征的一种全身性的骨代谢疾病[1]。骨髓间充质干细胞(mesenchymal stem cells, MSCs)的功能缺陷是骨质疏松症发生的病理机制之一[2]。雌激素可能通过调节MSCs的增殖和分化特性来发挥促进骨形成作用[3-7]。膜离子通道活动是细胞电活动的基础, L型钙离子(Ca2+)通道是进入细胞内的最主要通道之一。细胞内Ca2+水平在信号传递及调节细胞生长的生理过程中发挥重要作用。在MSCs中有L型Ca2+通道的基因和蛋白表达[8]。本课题组的前期研究[9]已经证实了17β-雌二醇(17β-estradiol,17β-E2)通过上调骨钙素(BGP)mRNA表达水平,对成骨分化起促进作用。目前关于雌激素在MSCs成骨分化过程中Ca2+通道是否起到相应的作用尚未见报道。本研究通过观察17β-E2对MSCs成骨分化和Ca2+离子通道的影响,阐明17β-E2对MSCs促成骨分化的作用,探索雌激素对骨质疏松症的作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器雌性清洁级Wistar大鼠40只,购自吉林大学白求恩医学部实验动物中心,1月龄,体质量为(100±10)g,动物合格证号:SCXK-(吉)2007-0003;17β-E2、抗坏血酸、β-磷酸甘油和地塞米松购自美国Sigma公司,Fluo-3/AM(钙离子荧光探针)购自碧云天公司;倒置光学显微镜(BX43F,日本Olympus公司),激光扫描共聚焦显微镜(Digital Eclipse C1 TE2000-E, 3D,日本Nikon Insteck公司)。
1.2 大鼠MSCs培养大鼠离断脊髓处死后,取出大鼠股骨或胫骨,冲洗骨髓腔,使用Percoll分离液(1 073 g·L-1)进行密度梯度离心,再抽取单个核细胞层,具体培养步骤按参考文献[9]的方法进行,获得的大鼠MSCs以1:3比例传代培养。使用倒置光学显微镜观察传代培养的MSCs形态。
1.3 成骨诱导方法和细胞分组将第3代大鼠MSCs放入含10%FBS的DMEM培养液中培养24 h后,置于成骨细胞培养液(OBM)(1×10-8mol·L-1地塞米松,10 mmol·L-1β-甘油磷酸钠,50 mg·L-1抗坏血酸,含10%FBS的L-DMEM)中,3天更换1次培养液,持续诱导14 d。经培养液诱导3 d时,部分细胞变为立方形或多边形;诱导7 d时,大部分细胞变为多边形;诱导约14 d时,细胞聚集形成多个散在的细胞结节。采用诱导14 d后的MSCs进行分组实验。实验分为对照组(单纯OBM培养)和不同浓度17β-E2组(0.1、1.0、10.0和100.0 pmol·L-1 17β-E2组)。17β-E2用无水乙醇配制成10 nmol·L-1贮存液,用OBM稀释成所需的浓度。
1.4 Fluo-3/AM染色和Ca2+水平的测定将MSCs置于96孔板,细胞融合达80%~90%时进行成骨分化诱导14d,各组细胞加入含0.5 μmol·L-1 Fluo-3/AM染液于37℃孵育60 min后,利用激光扫描共聚焦显微镜(激发波长488 nm,发射波长530 nm)测定Ca2+水平,以平均荧光强度(mean fluorescent intensity, MFI)代表Ca2+水平。实验分组见1.3。荧光图像采用共焦显微镜Digital Eclipse C1控制软件EZ-C1(版本:2.30; Nikon Insteck)进行结果分析,结果获得根据测定的数据由控制软件EZ-C1系统自动生成。
1.5 全细胞膜片钳技术检测MSCs细胞Ca2+通道电流在光学显微镜观察挑选活性良好、形态典型的MSCs细胞(每组10个细胞), 应用全细胞膜片钳技术检测MSCs细胞Ca2+电流。采用两次拉制法把毛坯玻璃管制作成微电极(尖端直径为0.8~1.0 μm,电阻为1~3 MΩ)。微电极通过夹持器侧管连接注射器。用注射器对微电极施加正压,并缓慢地将微电极插入浴液,直至电极尖端接触MSCs细胞。去除正压后,用注射器抽吸,逐渐形成7.36~14.72 mmHg的负压。当微电极的尖端与细胞膜的表面形成1~5 GΩ封接电阻时,用力吸破微电极尖端上的细胞膜片,进行全细胞记录。调整程序后,通过膜片钳放大器输出脉冲,对膜进行电压钳制,记录不同条件下的全细胞Ca2+电流。细胞外液配制试剂(mol·L-1):BaCl2 90,MgCl2 1.5,葡萄糖7.3,4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES) 10,河豚青素(TTX) 0.0017。电极液配制试剂(mol·L-1):KCl 120,KF 20,NaCl2,MgCl2 2,乙二醇-双-(2-氨基乙醚)四乙酸(EGTA) 10,HEPES 10。调节pH值至7.4。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组Ca2+水平和Ca2+电流峰值以x±s表示,对数据进行正态分布检验,符合正态分布,多组间样本均数比较采用单因素方差分析,两组间样本均数比较采用两独立样本t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠MSCs培养采用倒置光学显微镜观察分离培养的大鼠MSCs。细胞形态呈成纤维细胞样,细胞核为椭圆形,细胞核内可见1或2个核仁。传代大鼠MSCs排列紧密,呈漩涡状排列,保持原代细胞的形态特征。见图 1。
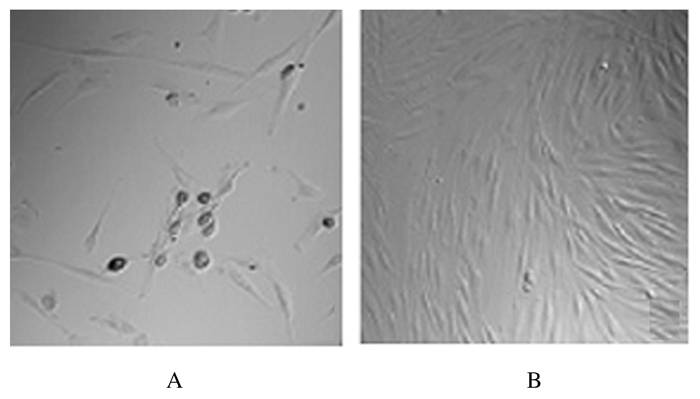
|
| A: G0 MSCs; B: G3 MSCs. 图 1 大鼠MSCs形态学特表现(×100) Fig. 1 Morphology of rat MSCs (×100) |
|
|
成骨诱导14 d,各组细胞经Fluo-3/AM染色后,于激光扫描共聚焦显微镜下观察可见:随着17β-E2浓度的增加,各组细胞的Fluo-3染色Ca2+水平也逐渐增强,以100.0 pmol·L-1 17β-E2组最为明显(图 2,见插页三)。通过激光扫描共聚焦显微镜的FI分析,与对照组比较,10.0和100.0 pmol·L-1 17β-E2组的MSCs成骨分化过程中Ca2+水平明显升高(P < 0.05或P < 0.01),0.1和1.0 pmol·L-1 17β-E2组Ca2+水平差异无统计学意义(P>0.05)。
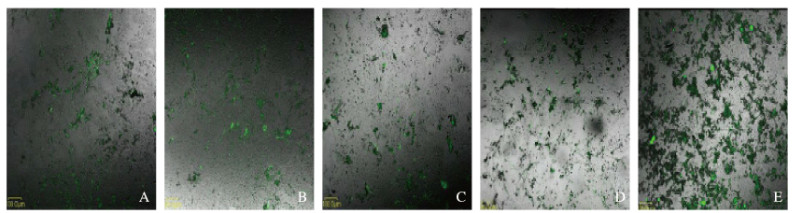
|
| A: Control group; B-E: 0.1, 1.0, 10.0, and 100.0 pmol·L-1 17β-E2 groups. 图 2 Fluo-3荧光染色观察各组MSCs中Ca2+荧光强度(×100) Fig. 2 Fluorescence intensities of Ca2+ in MSCs in various groups detected by Fluo-3 fluorescence staning (×100) |
|
|
MSCs孵育24 h后,12个细胞中有8个细胞可记录出内向Ca2+电流。测试电位在+20 mV时的Ca2+电流值被设定为峰值。对照组Ca2+电流峰值为(2.33±0.41)pA/pF,0.1、1.0、10.0和100.0 pmol·L-1 17β-E2组Ca2+电流峰值分别为(2.52±0.22)、(2.67±0.27)、(3.03±0.45)和(5.07±0.37)pA/pF。与对照组比较,10.0和100.0 pmol·L-1 17β-E2组Ca2+电流峰值明显升高(P < 0.05或P < 0.01),而0.1和1.0 pmol·L-1 17β-E2组Ca2+电流峰值差异无统计学意义(P>0.05)。
3 讨论卵巢功能衰竭引起的雌激素水平降低被认为是女性绝经后骨质疏松症发生的主要原因之一。雌激素降低可以抑制MSCs成骨分化,造成破骨细胞活性增强及骨代谢平衡失调,导致骨质疏松。因此,MSCs分化的成骨细胞是维持骨骼健康的重要因素之一[10-16]。
MSCs和成骨细胞表面存在雌激素受体[5, 9]。雌激素对骨基质蛋白编码、激素受体及转录因子基因的表达和成骨细胞的增殖等具有直接调控作用,并上调MSCs骨形成蛋白、核结合因子-1和碱性磷酸酶等基因的表达[17-22]。本课题组前期研究[9]表明:17β-E2通过上调BGP mRNA表达水平促进MSCs成骨分化。Ca2+通道是一种存在于细胞膜上的特定蛋白,是目前所知的选择性最强的离子通道,广泛存在于生物体内。Ca2+通道的开放或关闭、Ca2+流动的控制、多种细胞功能的调节均受外界环境刺激的影响[23-25]。因此,本研究以MSCs为靶点,利用Fluo-3荧光染色及膜片钳技术观察17β-E2在MSCs成骨分化过程中Ca2+通道的变化,探讨17β-E2对MSCs促成骨形成的机制。
关于L型Ca2+通道的相关研究主要是在神经和肌细胞等易兴奋的细胞上。细胞的分裂和代谢与Ca2+通道开放的调节密切相关。MSCs是成骨细胞的重要来源,在细胞生物学上与成骨细胞存在相似性。时飒等[8]在大鼠MSCs检测到的Ca2+通道电流与本研究结果一致,进一步验证了在未分化的大鼠MSCs细胞膜上也存在Ca2+通道,并参与MSCs的成骨分化,对成骨细胞增殖和细胞活性起着重要作用。
本研究结果显示:各组MSCs经Fluo-3/AM染色后,随着17β-E2剂量的增加,Ca2+水平也逐渐增强,并呈剂量依赖性,提示17β-E2促进MSCs成骨分化可能是通过促进Ca2+通道开放来完成的;激光扫描共聚焦显微镜进行MSCs成骨分化过程中Ca2+水平定量分析结果显示:与对照组比较,只有较高剂量(10.0和100.0 pmol·L-1) 17β-E2组Ca2+水平差异有统计学意义;全细胞膜片钳技术观察MSCs细胞Ca2+电流的变化结果显示:与对照组比较,较高剂量(10.0和100.0 pmol·L-1) 17β-E2组的MSCs细胞Ca2+电流峰值差异有统计学意义,与Ca2+水平定量分析结果相符,提示一定浓度的17β-E2可促进MSCsCa2+通道开放,内向Ca2+电流增强,MSCs的生物学活性升高。
本课题组前期研究[9]显示:MSCs免疫表型检测和MSCs生物学特性等实验结果均已证明17β-E2具有促进MSCs成骨分化的能力,浓度为100.0 pmol·L-1时作用最强,支持本研究Ca2+水平定量分析和MSCs细胞Ca2+电流变化的结果。结合前期研究及本研究结果,本文作者认为:雌激素在成骨细胞分化的早期主要通过与MSCs表面受体直接结合,而在中晚期是通过促进MSCs分泌,如转化生长因子-β(TGF-β)等细胞因子的间接效应,导致MSCs Ca2+通道开放,Ca2+内流增加,发挥细胞内第二信使的作用,上调BGP mRNA表达水平促进骨形成。本课题组下一步工作是要建立骨质疏松动物模型,开展17β-E2对骨质疏松症作用的体内研究,为骨质疏松症的防治提供确切可靠的科学指标。
| [1] | PAVEI OR, POPESCU M, NOVAC L, et al. Postmenopausal osteoporosis-clinical, biological and histopathological aspects[J]. Rom J Morphol Embryol, 2016, 57(1): 121–130. |
| [2] | RODRIGUEZ-SANZ M, GARCIA-GIRALT N, PRIETO-ALHAMBRA D, et al. CYP11A1 expression in bone is associated with aromatase inhibitor-related bone loss[J]. J Mol Endocrinol, 2015, 55(1): 69–79. |
| [3] | MATSUMOTO Y, OTSUKA F, TAKANO-NARAZAKI M, et al. Estrogen facilitates osteoblast differentiation by upregulating bone morphogenetic protein-4 signaling[J]. Steroids, 2013, 78(5): 513–520. DOI:10.1016/j.steroids.2013.02.011 |
| [4] | ZAMANI MAZDEH D, MIRSHOKRAEI P, EMAMI M, et al. 17β-estradiol improves the efficacy of exploited autologous bone marrow-derived mesenchymal stem cells in non-union radial defect healing:A rabbit model[J]. Res Vet Sci, 2018, 118: 11–18. DOI:10.1016/j.rvsc.2017.12.024 |
| [5] | CHEN F P, HU C H, WANG K C. Estrogen modulates osteogenic activity and estrogen receptor mRNA in mesenchymal stem cells of women[J]. Climacteric, 2013, 16(1): 154–160. |
| [6] | 彭伟, 秦媛, 李坤河, 等. 雌激素对体外骨髓间充质干细胞成骨及成纤维相关基因的影响[J]. 中国组织工程研究, 2016, 20(33): 4869–4875. DOI:10.3969/j.issn.2095-4344.2016.33.001 |
| [7] | 朱晓斐, 王飏, 金岩, 等. 雌激素剂量依赖性促进小鼠骨髓间充质干细胞的成骨分化[J]. 中国组织工程研究, 2012, 16(19): 3433–3437. DOI:10.3969/j.issn.1673-8225.2012.19.003 |
| [8] | 时飒, 金连弘, 申景岭, 等. 大鼠骨髓间充质干细胞L-型钙通道的表达及电流检测[J]. 解剖学报, 2007, 38(1): 111–114. DOI:10.3321/j.issn:0529-1356.2007.01.026 |
| [9] | 冷冰, 马恩元, 何巍, 等. 17β-雌二醇对大鼠骨髓间充质干细胞成骨分化的作用[J]. 吉林大学学报:医学版, 2015, 41(4): 763–768. |
| [10] | CAI J Z, TANG R, YE G F, et al. A halogen-containing stilbene derivative from the leaves of cajanus cajan that induces osteogenic differentiation of human mesenchymal stem cells[J]. Molecules, 2015, 20(6): 10839–10847. DOI:10.3390/molecules200610839 |
| [11] | QI M, LIU W, MA Y, et al. Spermidine enhances osteogenic differentiation and inhibits adipogenic differentiation of bone marrow-derived mesenchymal stem cells from ovariectomized mice[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2015, 31(6): 787–791. |
| [12] | LV H, SUN Y J, ZHANG Y C. MiR-133 is involved in estrogen deficiency-induced osteoporosis through modulating osteogenic differentiation of mesenchymal stem cells[J]. Med Sci Monit, 2015, 21: 1527–1534. DOI:10.12659/MSM.894323 |
| [13] | ZONG S H, ZENG G F, FANG Y, et al. The effects of α-zearalanol on the proliferation of bone-marrow-derived mesenchymal stem cells and their differentiation into osteoblasts[J]. J Bone Miner Metab, 2016, 34(2): 151–160. DOI:10.1007/s00774-015-0659-1 |
| [14] | GU Q H, CHEN C, ZHANG Z P, et al. Ginkgo biloba extract promotes osteogenic differentiation of human bone marrow mesenchymal stem cells in a pathway involving Wnt/β-catenin signaling[J]. Pharmacol Res, 2015, 97: 70–78. DOI:10.1016/j.phrs.2015.04.004 |
| [15] | TIAN F, JI X L, XIAO W N, et al. CXCL13 promotes osteogenic differentiation of mesenchymal stem cells by inhibiting mir-23a expression[J]. Stem Cells Int, 2015, 2015: 632305. |
| [16] | LUO Z Q, LIU M L, SUN L K, et al. Icariin recovers the osteogenic differentiation and bone formation of bone marrow stromal cells from a rat model of estrogen deficiency-induced osteoporosis[J]. Mol Med Rep, 2015, 12(1): 382–388. |
| [17] | ROZENBERG S, VANDROMME J, ANTOINE C. Postmenopausal hormone therapy:risks and benefits[J]. Nat Rev Endocrinol, 2013, 9(4): 216–227. DOI:10.1038/nrendo.2013.17 |
| [18] | 杨燕兵, 靳宪辉, 王海萍. 17β-雌二醇联合淫羊藿苷促进SD大鼠骨髓间充质干细胞的成骨分化[J]. 中国组织工程研究, 2018, 22(21): 3299–3303. DOI:10.3969/j.issn.2095-4344.0879 |
| [19] | 尹素娟, 张荣华, 朱晓峰, 等. rhTGF-β1对SD大鼠MSCS骨向分化的影响及机制研究[J]. 中国病理生理杂志, 2014, 30(3): 460–466. DOI:10.3969/j.issn.1000-4718.2014.03.014 |
| [20] | 王洁, 张鹏, 代庆刚, 等. 雌激素对大鼠骨髓间充质干细胞增殖及成骨分化的影响[J]. 上海口腔医学, 2014, 23(6): 654–660. |
| [21] | 刘凯, 马伟康, 张雷, 等. 不同龄大鼠骨髓间充质干细胞活性对比[J]. 现代生物医学进展, 2018, 18(6): 1024–1028. |
| [22] | 陈雪, 邓子翔, 牛云飞. 调节骨髓间充质干细胞的微环境因素研究进展[J]. 实用骨科杂志, 2018, 24(8): 721–725. |
| [23] | 王瑒, 李正, 王小娜, 等. 雷奈酸锶通过上调骨形态发生蛋白2的表达促进骨髓间充质干细胞分化为成骨细胞[J]. 中国病理生理杂志, 2012, 28(3): 404–408. DOI:10.3969/j.issn.1000-4718.2012.03.004 |
| [24] | 张新昌, 张西正. 骨髓间充质干细胞成骨分化相关通路的研究进展[J]. 医学综述, 2013, 19(21): 3853–3856. DOI:10.3969/j.issn.1006-2084.2013.21.005 |
| [25] | 孙中洋, 李东韬, 张舒. 成骨细胞钾、钙离子通道的研究进展[J]. 解放军医学院学报, 2014, 35(2): 186–189. DOI:10.3969/j.issn.2095-5227.2014.02.026 |
 2019, Vol. 45
2019, Vol. 45


