扩展功能
文章信息
- 郭青榜, 冯文化, 张钊
- GUO Qingbang, FENG Wenhua, ZHANG Zhao
- 辅酶Q10对高糖引起的人冠状动脉内皮细胞凋亡的抑制作用及其机制
- Inhibitory effect of coenzyme Q10 on apoptosis of human coronary endothelial cells induced by high glucose and its mechanism
- 吉林大学学报(医学版), 2019, 45(05): 1031-1035
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1031-1035
- 10.13481/j.1671-587x.20190510
-
文章历史
- 收稿日期: 2018-12-24
大血管病变是糖尿病主要的慢性并发症之一,其血管病变早期的病理特征表现为内皮细胞的损伤[1],而长期的高血糖状态诱导的血管内皮细胞结构损伤及功能紊乱[2],若不及时治疗或治疗不当易造成急性心血管事件。在部分糖尿病患者中发现冠状动脉内皮细胞的数量减少和功能受损,但其具体机制尚不清楚[3]。辅酶Q(coenzyme Q10,Co-Q10)也被称为泛醌,是线粒体内膜的电子传递载体,且在维持线粒体的稳态中发挥着重要作用[4]。研究[5]表明:Co-Q10可以通过改善心肌细胞线粒体膜电位抵抗心肌细胞的氧化应激损伤。糖尿病模型大鼠心肌内出现线粒体碎片,提示线粒体功能受损可能在糖尿病心血管并发症的产生过程中起重要作用[6]。然而,Co-Q10对糖尿病诱导的人冠状动脉内皮细胞(human coronary endothelial cells,HCAECs)凋亡的影响目前仍无定论。本研究通过高糖环境模拟糖尿病的血管环境,探讨Co-Q10是否对HCAEC发挥保护作用,以及是否通过线粒体相关途径发挥作用。本研究将为Co-Q10应用于临床治疗糖尿病诱导的冠心病提供理论依据。
1 材料与方法 1.1 细胞、主要试剂及仪器HCAECs(美国Cell Applications公司)。Co-Q10(日本Tokyo Chemical Industry公司),内皮细胞生长培养基(EGM-2)(瑞士Lonza公司),Cell Counting Kit-8试剂盒(日本Dojindo公司),PI试剂(中国福州飞净生物科技有限公司),Hoechst 33258(美国Bio-Techne公司),DAPI试剂和Mitotracker Red CMXRos试剂(美国Thermo Fisher Scientific公司),胎牛血清和MitoSOX Red线粒体超氧化物荧光探针(美国Invitrogen公司),RIPA裂解缓冲液、增强的BCA蛋白质测定试剂盒和β-actin抗体(江苏碧云天生物公司),PVDF膜(美国Bio-Rad公司),蛋白免疫印迹检测试剂(英国GE Healthcare公司),B细胞淋巴瘤/白血病2蛋白(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体和二抗(美国Cell Signaling Technology公司),Bcl-2相关死亡启动子(Bad)抗体和x连锁凋亡抑制蛋白(x-IAP)抗体(美国Abcam公司)。IX73型倒置荧光显微镜(日本Olympus公司),Elx800型酶标仪(美国Bio-Tek公司)。
1.2 细胞培养及分组HCAECs接种在含有10%胎牛血清EGM-2培养基的细胞培养瓶中,置于37℃、5%CO2细胞培养箱中培养。培养4 d后,用磷酸盐缓冲盐水(PBS)洗涤除去非贴壁细胞,并将贴壁细胞在新鲜培养基中再培养3 d,每2 d换液1次,每周按照1:3比例传代1次。取第3~5代细胞,用于本研究。细胞分为对照组,高糖组,高糖联合5、10和20 μmol·L-1 Co-Q10处理组。其中对照组细胞常规培养24 h;高糖组细胞采用含有终浓度为30 mmol·L-1葡萄糖的培养基培养24 h;高糖联合5、10和20 μmol·L-1 Co-Q10处理组细胞分别采用5、10和20 μmol·L-1 Co-Q10联合含有30 mmol·L-1葡萄糖的培养基培养24 h。
1.3 CCK-8法检测细胞活性采用Cell Counting Kit-8试剂盒检测细胞活性。将细胞接种于96孔板(每孔8 000个细胞),然后按照1.2中分组方法进行分组处理,每组设3个复孔。待细胞培养24 h后,按照试剂盒说明书步骤,弃旧培养基,用PBS洗涤细胞2次,并向每孔中加入100 μL新的但不含胎牛血清的EGM-2培养基和10 μL CCK-8溶液,然后将细胞再孵育2 h。使用酶标仪检测各组450 nm处的吸光度(A)值。每组实验重复3次。细胞相对活性=处理组A值/对照组A值×100%。
1.4 PI-Hoechst双染法检测细胞凋亡率以每毫升1×105个细胞密度将细胞接种于24孔板,细胞分为高糖组和高糖联合10 μmol·L-1 Co-Q10处理组,按照1.2中的方法进行处理,每组设3个复孔。待细胞培养24 h后,弃旧培养基,用PBS洗涤细胞2次,并向每孔中加入1 mL PBS。每孔加入2 mg·L-1的PI试剂和Hoechst 33258试剂,并在室温下暗室中孵育细胞10 min。PBS洗涤细胞2次,倒置荧光显微镜下观察细胞,每孔随机拍摄4张PI和Hoechst染色图片并计数。每组实验重复3次。以PI阳性细胞百分比表示细胞凋亡率。细胞凋亡率=PI阳性细胞数/Hoechst染色细胞数×100%。
1.5 Mito-tracker染色法检测线粒体膜电位采用Mito-tracker Red CMXRos试剂检测线粒体膜电位。以每毫升1×105个细胞的密度将细胞接种于24孔板,细胞分为高糖组和高糖联合10 μmol·L-1 Co-Q10处理组,按照1.2中的方法进行处理,每组设3个复孔。待细胞培养24 h后,弃旧培养基,用PBS洗涤细胞2次,并向每孔中加入1 mL PBS。每孔加入50 nmol·L-1的Mito-tracker Red CMXRos试剂,37℃孵育30 min,室温下用DAPI试剂染细胞核5 min。PBS洗涤细胞2次,倒置荧光显微镜使用488 nm波长激发后,在583 nm波长处测量红色荧光;使用360 nm波长激发,在450 nm波长处测量蓝色荧光,每孔随机拍摄4张视野图片,通过Image J软件测量荧光强度,代表线粒体膜电位。相对荧光强度=高糖联合10 μmol·L-1 Co-Q10处理组荧光强度/高糖组荧光强度×100%。每组实验重复3次。
1.6 Mito-SOX Red染色法检测线粒体活性氧(mtROS)水平以每毫升1×105个细胞密度将细胞接种于24孔板,细胞分为高糖组和高糖联合10 μmol·L-1 Co-Q10处理组,按照1.2中的方法进行处理,每组设3个复孔。待细胞培养24 h后,弃旧培养基,用PBS洗涤细胞2次,并向每孔中加入1 mL PBS。每孔加入5 μmol·L-1的MitoSOX Red试剂,37℃孵育15 min。室温下用2 mg·L-1Hoechst 33258试剂暗室中孵育细胞10 min。PBS洗涤细胞2次,倒置荧光显微镜下使用488 nm波长激发后,在583 nm波长处测量红色荧光;使用360 nm波长激发,在450 nm波长处测量蓝色荧光,并每孔随机拍摄4张视野图片,通过Image J软件测量荧光强度。mtROS相对水平=(高糖联合10 μmol·L-1Co-Q10处理组荧光强度/高糖联合10 μmol·L-1 Co-Q10处理组Hoechst 33258染色细胞数)/(高糖组荧光强度/高糖组Hoechst 33258染色细胞数)×100%。
1.7 Western blotting法检测HCAECs中Bax、Bad、Bcl-2和x-IAP蛋白表达水平以每毫升1×105个细胞密度将细胞接种于6孔板,细胞分为高糖组和高糖联合10 μmol·L-1 Co-Q10处理组,按照1.2中的方法进行处理,待细胞培养24 h后,预冷的PBS洗涤细胞3次。使用RIPA裂解缓冲液提取总蛋白质。将蛋白质溶液在4℃、20 000 r·min-1离心10 min以沉淀细胞碎片。收集上清液并使用增强的BCA蛋白质测定试剂盒检测蛋白水平。取45 μg蛋白质行8% SDS-PAGE凝胶电泳。分离的蛋白经电转移到PVDF膜。在室温下用含5%脱脂奶粉的TBST中封闭PVDF膜45 min。取1:1 000稀释的一抗(Bax、Bad、Bcl-2、x-IAP和β-actin)在4℃下孵育过夜。TBST洗涤PVDF膜3次后,将1:1 000稀释的二抗与PVDF膜在室温孵育50 min。TBST洗涤PVDF膜3次后,在暗室,使用蛋白免疫印迹检测试剂曝光显影。通过Image J软件测量条带的灰度值。目的蛋白的相对表达水平=目的蛋白的灰度值/ β-actin灰度值×100%。每组实验重复3次。
1.8 统计学分析采用Graphpad Prism 7.0软件进行统计学分析。各组细胞活性、细胞凋亡率、线粒体膜电位,mtROS水平和Bax、Bad、Bcl-2和x-IAP蛋白表达水平以x±s表示,2组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间均数两两比较采用LSD-t检验。检验水准α=0.05。
2 结果 2.1 各组细胞活性对照组,高糖组,高糖联合5、10和20 μmol·L-1 Co-Q10处理组细胞活性分别为(100.00±9.73)%、(41.32±8.94)%、(63.46±6.75)%、(92.74±2.79)%和(77.15± 4.86)%,各组间细胞活性比较差异有统计学意义(F=89.734,P < 0.01)。与对照组比较,高糖组细胞活性明显降低(P < 0.01);与高糖组比较,高糖联合5、10和20 μmol·L-1 Co-Q10处理组细胞活性明显升高(P < 0.05或P < 0.01),其中以10 μmol·L-1 Co-Q10处理组细胞活性升高最为明显。因此,后续实验中Co-Q10浓度均为10 μmol·L-1。
2.2 高糖组和高糖联合10 μmol·L-1 Co-Q10处理组细胞凋亡率与高糖组(53%±6%)比较,高糖联合10 μmol·L-1 Co-Q10处理组细胞凋亡率(20%±8%)明显降低(t=17.384,P<0.01)。见图 1(插页三)。
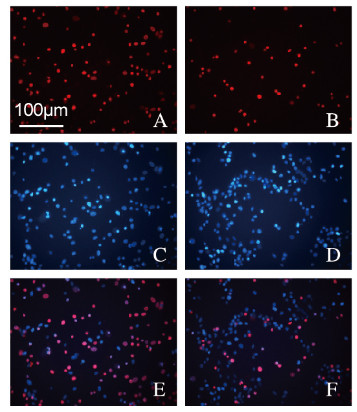
|
| A, B:PI; C, D:Hoechst; E, F:Merge. 图 1 PI-Hoechst双染法检测高糖组(A, C, E)和高糖联合10 μmol·L-1 Co-Q10处理组(B, D, F)细胞凋亡率(Bar=100 μm) Fig. 1 Apoptotic rates in high glucose group(A, C, E) and high glucose combined with 10 μmol·L-1Co-Q10 treatment group (B, D, F) detected by PI-Hoechst double staining(Bar=100 μm) |
|
|
与高糖组(100.00%±12.36%)比较,高糖联合10 μmol·L-1 Co-Q10处理组细胞线粒体膜电位(28.14%±6.15%)明显降低(t=7.356,P<0.01)。见图 2(插页三)。
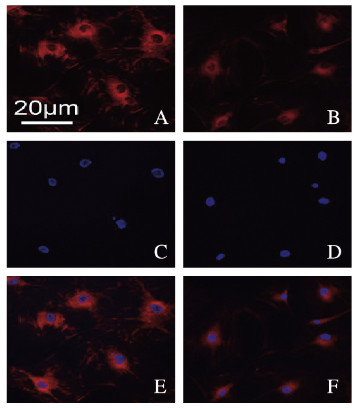
|
| A, B:Mito-tracker; C, D:DAPI; E, F:Merge. 图 2 Mito-tracker染色法检测高糖组(A, C, E)和高糖联合10 μmol·L-1 Co-Q10处理组(B, D, F)细胞线粒体膜电位(Bar=20 μm) Fig. 2 Cell mitochondrial membrane potentials in high glucose group(A, C, E) and high glucose combined with 10 μmol·L-1 Co-Q10 treatment group (B, D, F) detected by Mito-tracker staining(Bar=20 μm) |
|
|
与高糖组(100.00%±6.21%)比较,高糖联合10 μmol·L-1 Co-Q10处理组细胞中mtROS水平(22.56%±5.37%)明显降低(t=8.132,P<0.01)。见图 3(插页三)。
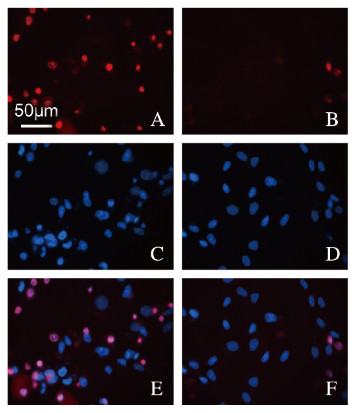
|
| A, B:MitoSox; C, D:Hoechst; E, F:Merge. 图 3 MitoSox染色法检测高糖组(A, C, E)和高糖联合10 μmol·L-1 Co-Q10处理组(B, D, F)细胞中mtROS水平(Bar=50 μm) Fig. 3 mtROS levels in high glucose group(A, C, E) and high glucose combined with 10 μmol·L-1 Co-Q10 treatment group(B, D, F) detected by MitoSox staining(Bar=50 μm) |
|
|
与高糖组[Bax相对表达水平为(100.00±6.78)%,Bad相对表达水平为(100.00±11.43)%]比较,高糖联合10 μmol·L-1 Co-Q10处理组细胞中促凋亡蛋白表达水平[Bax相对表达水平为(48.34±8.54)%,Bad相对表达水平为(42.75±4.78)%]明显降低(t=7.236,P<0.01;t=7.786,P<0.01);与高糖组[Bcl-2相对表达水平为(100.00± 8.56)%,x-IAP相对表达水平为(100.00±12.73)%]比较,高糖联合10 μmol·L-1 Co-Q10处理组抗凋亡蛋白表达水平[Bcl-2相对表达水平为(221.56±9.04)%,x-IAP相对表达水平为(256.34±11.04)%]明显升高(t=7.589,P<0.01;t=8.102,P<0.01)。见图 4。

|
| Lane 1:High glucose group; Lane 2:High glucose combined with 10 μmol·L-1 Co-Q10 treatment group. 图 4 Western blotting法检测高糖组和高糖联合10 μmol·L-1 Co-Q10处理组HCAECs中凋亡相关蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of apoptosis-related proteins in HCAECs in high glucose group and high glucose combined with 10 μmol·L-1 Co-Q10 treatment group detected by Western blotting method |
|
|
糖尿病在世界范围内患病人数众多,且患病率逐年上升,对社会和个人都造成极大负担。糖尿病中高血糖与血管并发症存在紧密联系[7]。2型糖尿病患者心血管事件发病率非常高,其中多数死于冠状动脉疾病,预后较差[8]。糖尿病大鼠的冠状动脉内皮细胞(coronary endothelial cell,CAEC)明显受损,且高糖刺激可以诱导CAEC炎症细胞发生凋亡[9]。近年来,虽然在糖尿病诱发冠状动脉血管病变的研究上取得了一定的进展[10-11],但其具体的机制尚不完善。因此,深入研究糖尿病高血糖诱导的冠状动脉病理生理变化的机制对于糖尿病的临床治疗十分重要。
Co-Q10是一种抗氧化剂,其作为亲脂性电子载体存储在细胞的线粒体中并调节呼吸链活性,可清除自由基,抑制细胞线粒体的凋亡[4]。研究[12]表明:Co-Q10通过抑制细胞色素C释放和半胱天冬酶活化发挥抗细胞凋亡作用。在糖尿病和代谢综合征中经常观察到线粒体氧化应激。mtROS的生成增加是糖尿病血管病变发展的关键事件,因此mtROS已成为内皮功能障碍、糖尿病和其他血管病变的潜在治疗靶点[13]。
本研究将HCAECs暴露于30 mmol·L-1高葡萄糖以模拟糖尿病冠状动脉血管状况,结果显示:高糖可以降低HCAECs细胞活性,并增加细胞凋亡,促进线粒体膜去极化,增加mtROS的作用。正常线粒体膜电位是维持线粒体进行氧化磷酸化、产生ATP的前提,是维持线粒体功能所必需,而凋亡过程中一个重要的变化即是线粒体膜电位的崩溃[14]。mtROS的蓄积是导致线粒体氧化应激损伤的必要条件[15-16]。本研究结果显示:Co-Q10对高葡萄糖诱导的HCAECs损伤、线粒体膜电位和mtROS水平具有改善作用。为进一步探讨Co-Q10对抗高糖对HCAECs损伤的机制,本研究采用Western blotting法检测HCAECs中凋亡相关蛋白表达水平,结果显示:在高糖环境下,Co-Q10可以抑制促凋亡蛋白Bax和Bad表达,促进抗凋亡蛋白Bcl-2和x-IAP表达。以上研究结果提示:在高糖环境下,Co-Q10对HCAECs的保护作用可能与抑制线粒体凋亡通路有关。
综上所述,Co-Q10可能通过线粒体凋亡通路来抑制高糖诱导的HCAECs凋亡,Co-Q10可能是一种潜在的治疗糖尿病诱导的冠状动脉损伤相关疾病的药物。
| [1] | WANG S Y, WANG J, ZHANG R, et al. Mendelian randomization analysis to assess a causal effect of haptoglobin on macroangiopathy in Chinese type 2 diabetes patients[J]. Cardiovasc Diabetol, 2018, 17(1): 14. DOI:10.1186/s12933-018-0662-7 |
| [2] | WILS J, FAVRE J, BELLIEN J. Modulating putative endothelial progenitor cells for the treatment of endothelial dysfunction and cardiovascular complications in diabetes[J]. Pharmacol Ther, 2017, 170: 98–115. DOI:10.1016/j.pharmthera.2016.10.014 |
| [3] | YAHAGI K, KOLODGIE F D, LUTTER C, et al. Pathology of human coronary and carotid artery atherosclerosis and vascular calcification in diabetes mellitus[J]. Arterioscler Thromb Vasc Biol, 2017, 37(2): 191–204. DOI:10.1161/ATVBAHA.116.306256 |
| [4] | KHUANKAEW C, APAIJAI N, SAWADDIRUK P, et al. Effect of coenzyme Q10 on mitochondrial respiratory proteins in trigeminal neuralgia[J]. Free Radic Res, 2018, 52(4): 415–425. DOI:10.1080/10715762.2018.1438608 |
| [5] | YAN B J, SUN Y X, WANG J. Depletion of ubiA prenyltransferase domain containing 1 expression promotes angiotensin-Ⅱ induced hypertrophic response in AC16 human myocardial cells via modulating the expression levels of coenzyme Q10 and endothelial nitric oxide synthase[J]. Mol Med Rep, 2017, 16(5): 6910–6915. DOI:10.3892/mmr.2017.7407 |
| [6] | SAVU O, SUNKARI V G, BOTUSAN I R, et al. Stability of mitochondrial DNA against reactive oxygen species (ROS) generated indiabetes[J]. Diabetes Metab Res Rev, 2011, 27(5): 470–479. DOI:10.1002/dmrr.1203 |
| [7] | DOMINGUETI C P, DUSSE L M, CARVALHO M D, et al. Diabetes mellitus:the linkage between oxidative stress, inflammation, hypercoagulability and vascular complications[J]. J Diabetes Complicat, 2016, 30(4): 738–745. DOI:10.1016/j.jdiacomp.2015.12.018 |
| [8] | NAKA K K, PAPATHANASSIOU K, BECHLIOULIS A, et al. Association of vascular indices with novel circulating biomarkers as prognostic factors for cardiovascular complications in patients with type 2 diabetes mellitus[J]. Clin Biochem, 2018, 53: 31–37. DOI:10.1016/j.clinbiochem.2017.12.010 |
| [9] | HAN X, WU Y, LIU X, et al. Adiponectin improves coronary no-reflow injury by protecting the endothelium in rats with type 2 diabetes mellitus[J]. Biosci Rep, 2017, 37(4): BSR20170282. DOI:10.1042/BSR20170282 |
| [10] | ZHANG J, JIN J, LIU J L, et al. A study of the correlation of insulin resistance and leptin with inflammatory factors and vascular endothelial injury in T2DM patients with CHD[J]. Exp Ther Med, 2018, 16(1): 265–269. |
| [11] | HE M H, NITTI M, PIRAS S, et al. Heme oxygenase-1-derived bilirubin protects endothelial cells against high glucose-induced damage[J]. Free Radic Biol Med, 2015, 89: 91–98. DOI:10.1016/j.freeradbiomed.2015.07.151 |
| [12] | SUMI K, OKURA T, FUJIOKA Y, et al. Coenzyme Q10 suppresses apoptosis of mouse pancreatic β-cell line MIN6[J]. Diabetol Metab Syndr, 2018, 10: 47. DOI:10.1186/s13098-018-0351-4 |
| [13] | ZHOU H, WANG S Y, ZHU P J, et al. Empagliflozin rescues diabetic myocardial microvascular injury via AMPK-mediated inhibition of mitochondrial fission[J]. Redox Biol, 2018, 15: 335–346. DOI:10.1016/j.redox.2017.12.019 |
| [14] | LI A X, SUN M, LI X. Withaferin-A induces apoptosis in osteosarcoma U2OS cell line via generation of ROS and disruption of mitochondrial membrane potential[J]. Eur Rev Med Pharmacol Sci, 2017, 21(6): 1368–1374. |
| [15] | 杜劲, 侯娟妮, 李秀川, 等. 脂滴包被蛋白5对高糖高脂诱导的小鼠心脏微血管内皮细胞凋亡的影响及机制[J]. 解放军医学杂志, 2017, 42(12): 1045–1050. DOI:10.11855/j.issn.0577-7402.2017.12.04 |
| [16] | WANG X, LU X C, ZHU R L, et al. Betulinic acid induces apoptosis in differentiated PC12 cells via ROS-mediated mitochondrial pathway[J]. Neurochem Res, 2017, 42(4): 1130–1140. DOI:10.1007/s11064-016-2147-y |
 2019, Vol. 45
2019, Vol. 45


