扩展功能
文章信息
- 时函, 王洁, 武影, 陈扬熙
- SHI Han, WANG Jie, WU Ying, CHEN Yangxi
- 双相磷酸钙作用下牙周组织缺损再生的Beagle犬正畸牙移动的骨改建功能
- Bone remodeling function of orthodontic tooth movement in Beagledogs with periodontal defect regeneration under action of biphasic calcium phosphate
- 吉林大学学报(医学版), 2019, 45(05): 1025-1030
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1025-1030
- 10.13481/j.1671-587x.20190509
-
文章历史
- 收稿日期: 2019-02-08
2. 同济大学口腔医学院及附属口腔医院牙周科 上海市牙组织修复与再生工程技术研究中心, 上海 200072;
3. 四川大学华西口腔医学院正畸科, 四川 成都 600040
2. Department of Periodontology, School & Hospital of Stomatology, Tongji University, Shanghai Engineering Research Center of Tooth Restoration and Regeneration, Shanghai 200072, China;
3. Department of Orthodontics, West China School of Stomatology, Sichuan University, Chengdu 600040, China
随着生活水平的提高,人们对美观的追求程度日益增加,成年正畸患者的数量与日俱增,此类患者常伴有牙根暴露和牙槽骨吸收等不同程度的牙周组织丧失的情况,对于这些患者即使轻微的矫治力也是无法承受的,因此有效地再生缺失的牙周支持组织是保证正畸治疗顺利进行的前提。随着生物工程技术的引入,骨组织再生这一难题也得以解决。脱蛋白牛骨矿物质和脱蛋白猪骨矿物质是常用的颗粒型生物材料,可应用于多种骨缺损治疗[1-3],并显示出良好的临床应用效果。然而,颗粒型骨替代物在材料稳定性方面存在一些缺点[4-5],当其仅与胶原膜同时使用时,材料的整体形状容易塌陷,但合成块状骨替代物可以克服这一限制,具有良好的体积维持能力。双相磷酸钙(biphasic calcium phosphate, BCP)是一种由2种混合陶瓷组成的合成骨替代物,即不易溶性羟基磷灰石(hydroxyapatite, HA)和更易溶性磷酸三钙(tricalcium phosphate, β-TCP)。根据HA/β-TCP比值,其表现出不同的性质。BCP具有良好的生物相容性和成骨能力,可作为石膏、聚合物、碳酸钙和陶瓷等组织工程支架[6]。BCP骨块在骨再生方面具有许多优点,其在骨形成、体积维持和生物相容性方面也显示出良好的效果[5, 7-8]。BCP作为骨修复材料已得到广泛关注[9-13],然而目前尚未见将BCP应用在牙周组织缺损再生方面的相关报道。
研究[14-15]已证实BCP用于牙周组织再生效果显著。然而再生的牙周组织是否能够承受正畸力的作用,对其施以正畸力后牙周组织所发生的改建与正常者是否存在差异尚需进一步研究。本实验通过建立牙周再生后的Beagle犬正畸牙移动模型,检测并比较再生后的牙周组织与正常牙周组织的骨改建情况及核心结合因子α1(core binding factor,Cbfα1)表达情况是否存在差异,以期为临床应用BCP使缺损的牙周组织再生提供实验依据。
1 材料与方法 1.1 实验动物、材料和试剂实验动物:健康成年雄性Beagle犬6只,由四川养麝研究所比格犬繁育中心提供,动物许可证号:SCXK(川)2014-01, 犬龄24个月,体质量(18.3±1.6)kg,实验前由四川省抗菌素研究所饲养1周,观察无明显全身疾患,无失牙及进食异常。BCP(40%HA+60%β-TCP),由四川大学华西口腔医学院组织工程实验室提供。3%戊巴比妥钠(上海西唐生物科技有限公司),HE染色试剂(购自Sigema公司),兔抗狗Cbfɑ1单克隆抗体(BA1578,武汉博士德生物工程有限公司),UltraSensitive SP超敏试剂盒(Kit-9710,福建迈新生物技术有限公司),显色剂(DAB-0031,北京中杉公司),其余常规试剂均为国产分析纯试剂。消毒孔巾、低速打磨机及磨头、气枪、光固化复合充填树脂及粘接剂(美国3M公司),光固化机、京津酸蚀剂、磷酸锌水门汀、生理盐水、75%酒精、棉球、纱球、持针器、镊子、钢丝剪和0.016英寸澳丝(杭州新亚医疗器械公司),细丝钳和镍钛拉簧(北京有色金属研究总院),0.25 cm结扎丝(上海医疗设备厂),ZL-1型正畸电测力计(西北工业大学与秦都口腔医院联合研制),根据犬牙外形自制的带环。其他实验用器械均为国产手术器械,使用前经高温高压灭菌消毒。
1.2 实验动物分组及动物模型的建立按帕尔默牙位表示法进行分区:A区为左上象限,B区为右上象限,C区为左下象限,D为右下象限。实验组:将每只犬A和D区侧切牙纳入实验,去除其唇侧龈方骨壁面积约5mm×3mm(图 1,见插页二),深及根面,形成缺损并充填BCP;对照组:B和C区未进行任何牙周手术操作。正畸牙移动模型建立:应用BCP对犬A和D区进行牙周组织再生12周后,行正畸牙移动实验。建立正畸牙移动模型,以第二侧切牙为支抗,唇向移动侧切牙(图 2,见插页二)。力值的测定采用测力计有压槽的一端压迫弓丝至贴紧牙面时读数,力值约为120 g。

|
| A: Model of periodontal tissue defect; B: Removal of labial bone wall of lateral incisor; C: Filling material of defect and covering wound with periodontal plug after suture. 图 1 犬牙周组织缺损再生模型的建立 Fig. 1 Establishment of dog model of periodontal tissue defect and regeneration |
|
|
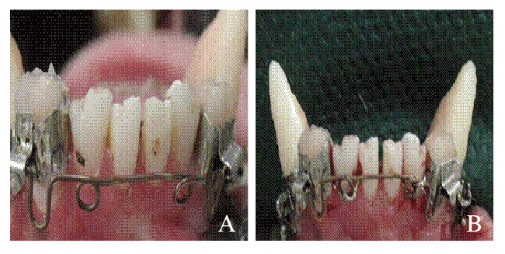
|
| 图 2 犬正畸牙移动模型的建立 Fig. 2 Establishment of dog model of orthodontic tooth movement |
|
|
在施加正畸压应力后的1、2和4周分别灌注处死2只Beagle犬,骨锯取出包含施加正畸力的牙齿及周围牙槽骨的骨块制成标本。将标本浸泡于预冷的4℃、4%多聚甲醛溶液中固定24 h,换为EDTA脱钙液进行脱钙,每天更换脱钙液,直至针尖可以轻易穿透骨皮质,脱钙周期为16周。至脱钙终点后,置入梯度酒精慢脱水,常规石蜡包埋。制备唇(颊)舌向的切片,切片厚度4μm,裱于涂有3-氨丙基-3-甲氧基硅烷(APES)粘附剂的玻片上,烤箱60℃~80℃烤干6~8 h,使切片更紧贴玻片。
1.4 Masson染色检查新生骨成熟程度组织切片脱塑至蒸馏水,苏木素染5~10 min,盐酸酒精分化,流水蓝化,蒸馏水洗,丽春红酸性品红液中染5~8 min,再次蒸馏水洗,1%磷钼酸中染1~3 min,直接入苯胺蓝液5 min (如染色效果不佳,可在冰醋酸内脱色后重染),流水速洗后置于60℃温箱中烘干,二甲苯透明,中性树脂封固。
1.5 免疫组织化学染色检查Cbfɑ1表达使用经APES试剂浸润并干燥后的载玻片,捞片后置58℃烤箱60 min,以使切片紧密贴附。切片常规脱蜡至水,用PBS(0.01 mol·L-1,pH值为7.5±0.1)冲洗3次×3 min;30% H2O2 1份+蒸馏水10份混合,室温10 min以阻断内源性过氧化酶活性,蒸馏水洗3次;将切片浸入0.1%胰蛋白酶进行抗原修复,37℃、30 min,冷却后PBS(pH值为7.2~7.6)冲洗3次、每次5 min;除去PBS,每张切片滴加50μL正常山羊血清,室温孵育10 min;除去血清,每张切片滴加50μL Ⅰ抗(狗Cbfɑ1 1:50稀释),室温孵育60 min;PBS冲洗3次、每次5 min,除去PBS,每张切片滴加50μL生物素标记的二抗,室温孵育10 min,PBS冲洗3次、每次3 min;除去PBS,每张切片滴加50μL链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min,PBS冲洗3次、每次3 min;除去PBS,每张切片滴加100μL新鲜配制的DAB溶液,显微镜下观察至显色(约10 min);自来水冲洗,苏木素复染2 min,自来水冲洗返蓝;梯度酒精脱水依次为80%乙醇稍洗1~2 s,95%乙醇2~3 s,95%乙醇3~5 s,无水乙醇5~10 min,使用二甲苯进行透明,中性树脂封片。设阴性对照,用PBS代替一抗,其余步骤相同。
采用偏振光显微镜(Nikon ECLIPSE ME600,摄像头NikonDIGITAL camera DXM1200F)进行观察,利用Nikon ACT-1软件进行分析。明场图像采集使用Leica DMI6000B显微镜。Cbfα1阳性表达为胞浆着棕黄色。
2 结果 2.1 Masson染色检测牙周组织的改建情况本实验仅对施加正畸压应力后牙移动周期的起点和终点,即1和4周2个时间点进行观察,比较骨和胶原的再生改建情况。正畸牙移动后1周,实验组和对照组牙周膜均明显变窄,纤维致密,难以辨清走行方向,血管管腔因受压而变扁,实验组犬牙槽骨以蓝染为主,对照组犬牙槽骨除牙周膜的受压区域外,大体呈红色。见图 3A和B(插页二)。正畸牙移动后4周,实验组犬牙槽骨红-蓝相间,对照组犬牙槽骨红染,2组的牙周膜内血管管腔变圆,牙周膜宽度与正畸牙移动后1周比较表现为增宽。见图 3C和D(插页二)。

|
| A: Experimental group (1 week); B: Control group (1 week); C: Experimental group (4 weeks); D: Control group (4 weeks). 图 3 实验组和对照组施加正畸力后犬牙周组织Masson染色结果(×200) Fig. 3 Results of Masson staining of periodontal tissue of dogs in experimental group and control group after orthodontic force application(×200) |
|
|
施加正畸压应力1周时,实验组犬牙周膜内细胞杂乱无章,成纤维细胞呈Cbfα1阳性反应,胞浆着棕黄色,实验组和对照组犬牙槽骨表面均可见骨吸收陷窝,内含多核的破骨细胞,受压变形的牙周膜内细胞排列无序。见图 4A和B(插页二)。施加正畸压应力2周时,实验组和对照组犬牙槽骨表面布满骨吸收陷窝,内含多核的破骨细胞,破骨细胞功能非常活跃,其胞浆Cbfɑ1染色呈阳性,受压变形的牙周膜内细胞排列无序,胞浆呈棕黄色。见图 4C和D(插页二)。施加压应力4周时,实验组犬骨改建尚未结束,破骨细胞消失,其骨吸收陷窝被成骨细胞所充填,骨小梁另一侧的成骨细胞也处于活跃状态,牙槽骨的骨髓腔内间充质细胞和边缘的成骨细胞仍可见Cbfɑ1阳性表达,对照组犬仍可见Cbfɑ1弱阳性表达。见图 4E和F(插页二)。
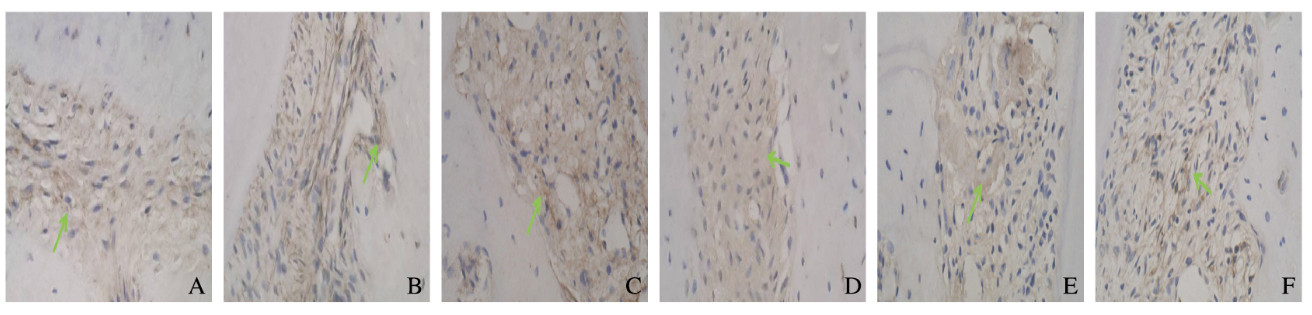
|
| A: Experimental group (1 week); B: Control group (1 week); C: Experimental group (2 weeks); D: Control group (2 weeks); E: Experimental group (4 weeks); F: Control group (4 weeks). 图 4 实验组和对照组施加正畸力后犬牙周组织免疫组织化学染色结果(×200) Fig. 4 Results of immunohistochemical staining of periodontal tissue of dogs in experimental group and control group after orthodontic force application(×200) |
|
|
本实验的目的是研究再生的牙周组织进行正畸牙移动的可行性,因此牙移动模型的建立贴近临床其研究结果才更有意义。本次正畸牙移动实验区选择临床上成年患者最多发牙槽骨退缩的切牙区,通过观察实验组与自身对照组犬牙移动后的组织学切片,发现二者在形态变化和改建周期上均无明显差异。
Masson染色可清晰区分类骨质和矿化骨小梁,但不易区分细胞。本研究采用Masson染色法来评价再生牙周组织的成熟程度,骨组织胶原的染色反应和胶原成熟程度有关。骨组织由新生到成熟,胶原逐渐老化,排列也更规律和致密, 交链增加, 从而可能引起胶原电荷特性的改变, 引起染色变化,即红色着染的比例越多, 骨越成熟[16-17]。Masson染色成熟骨的胶原着鲜红色, 新生骨在成熟过程中着蓝色至红-蓝相间。
通过Masson染色可以清晰观察到纤维的走行方向,从而确定牙周膜的受力状态。本研究结果显示:在施加正畸压应力后1周,实验组犬牙槽骨(应用BCP再生出的新骨)呈现以蓝染为主,而对照组犬未经手术处理的正常牙槽骨以红染为主,表明新生的牙槽骨其成熟程度尚未达到正常牙槽骨水平,但通过HE染色观察实验组和牙槽骨对照组的组织学形态未见明显差异,新生的牙槽骨、牙周膜及牙骨质未见异常,与对照组的正常骨组织一样在牙移动周期内发生骨改建,由此本文作者推断前期的牙周再生是成功的。在施加正畸压应力后4周时,可以明显观察到实验组犬牙槽骨着色变为红-蓝相间,表明其在骨改建过程中成熟程度也随之发生变化。
正畸牙移动时,在机械力刺激作用下,牙周膜细胞向成骨样细胞分化,此过程涉及多种信号分子和通道,其中关于Cbfɑ1在正畸骨改建中的重要作用引起了广泛关注。Cbfɑ1是决定多能性间充质细胞向成骨细胞分化的关键转录因子[18-20]。Cbfɑ1最初表达于发育早期的间质细胞集缩处的细胞中,即牙周膜细胞中富含的间充质细胞,这些细胞是成骨细胞和软骨细胞的前体,其只有在特定转录因子的作用下向其成熟的功能性细胞转化。研究[21]表明:Cbfɑ1作为人牙周膜细胞内接受力学信号刺激的目的基因,可以调控成骨细胞在受到细胞外刺激后的分化过程。Cbfɑ1在应力刺激下,可以将胞外力学信号通过细胞外基质(extracelullar matrix, ECM)与细胞膜的β1整合素结合,激活细胞内MAPK激酶途径来调控成骨细胞的增殖与分化。KWARIZADEH等[22]应用体内实验证实机械力刺激可以通过细胞外调节蛋白激酶(extracellular signal regulated protein kinase, ERK)信号通路来调节Cbfɑ1的表达,从而控制牙周膜内成骨样细胞的分化过程。
本课题组[23]前期进行了Cbfɑ1在大鼠实验性正畸牙移动过程中表达情况的研究,结果显示:Cbfɑ1在正常的牙周组织中呈弱阳性表达,且与牙移动的骨改建过程有密切关联。Cbfɑ1在整个骨改建周期内,呈现出一个先升高后降低的阳性表达趋势,随着骨改建的完成,Cbfɑ1表达也降低至初始状态的弱阳性。
本实验的研究区域分别是受应力刺激作用后的Beagle犬正常牙周组织和再生的牙周组织,结果显示:Cbfɑ1阳性表达及变化趋势与前期通过大鼠牙移动实验得出的结论类似,同样表现出先升高后降低,且2组间的表达变化情况并无明显差异。压应力侧的骨改建过程首先表现为单核吞噬细胞到达骨基质表面后融合成多核性破骨细胞,这些破骨细胞在牙槽骨表面分泌胶原酶,是有机基质脱钙和水解进而形成骨吸收陷窝;同时还有另一种骨吸收形式,即通过压电效应改变细胞电环境,使其发生骨细胞性溶骨,表现为牙槽骨表面凹凸不平的陷窝,但附近无破骨细胞的出现。到加力后2周时可以明显观察到破骨细胞出现在牙槽骨表面进行骨吸收,Cbfɑ1阳性表达于牙周膜细胞的胞浆内,此时牙周膜细胞在Cbfɑ1的调控作用下分化为成骨细胞,介导骨吸收的同时开始分化;随着加力时间的延长,压应力侧的成骨细胞开始分泌骨基质,当成骨细胞渐渐被其分泌的骨基质包埋并分化为骨细胞时,破骨细胞消失,破骨活动受到抑制,骨基质进一步矿化并最终完成骨改建。Cbfɑ1在压应力侧仍呈阳性表达,但与同期的张应力侧相比阳性表达程度较弱,可能是成骨细胞介导骨吸收作用而使其分化受到阻碍,当破骨活动受到抑制时才表现为Cbfɑ1强阳性表达,但到加力周期结束即加力后4周时,Cbfɑ1在压应力侧的阳性表达仍较强,因此本文作者推断压应力侧的骨改建与张应力侧相比稍滞后。
应用BCP再生的牙周组织在压应力作用下Cbfɑ1阳性表达均与对照组犬正常牙周组织极为相似,无明显差异。由此可见,从行使功能的角度,再生的牙周组织已达到了正常牙周组织水平,可以完成正畸牙移动的骨改建过程。
Cbfɑ1可促进成骨细胞生成并产生骨保护素(receptor activator NF-κB ligand/osteoprotegerin,OPG/RANKL),促进破骨细胞分化成熟进而介导破骨活动[24]。由于本研究未对OPG/RANKL表达进行检测,无法预知2种效应究竟是哪种直接影响到骨改建的周期,尚有待于进一步研究。同时应力作用后的骨改建是一个复杂的过程,相关的信号通路错综复杂,如何更有效地运用并促进骨改建,仍需深入研究。
| [1] | RAMOS-MURGUIALDAY M, CAUBET J, RAMIS J M, et al. Evaluation of the ideal implant insertion time in human bone biopsies after sinus elevation using a combination of autologous bone and graft substitute[J]. Int J Oral Maxillofac Implants, 2015, 30(4): 891–899. DOI:10.11607/jomi.3945 |
| [2] | LEE J S, SHIN H K, YUN J H, et al. Randomized clinical trial of maxillary sinus grafting using deproteinized porcine and bovine bone mineral[J]. Clin Implant Dent Relat Res, 2017, 19(1): 140–150. DOI:10.1111/cid.12430 |
| [3] | LEE J S, CHA J K, KIM C S. Alveolar ridge regeneration of damaged extraction sockets using deproteinized porcine versus bovine bone minerals:A randomized clinical trial[J]. Clin Implant Dent Relat Res, 2018, 20(5): 729–737. DOI:10.1111/cid.12628 |
| [4] | AKBARZADEH R, YOUSEFI A M. Effects of processing parameters in thermally induced phase separation technique on porous architecture of scaffolds for bone tissue engineering[J]. J Biomed Mater Res Part B Appl Biomater, 2014, 102(6): 1304–1315. DOI:10.1002/jbm.b.33101 |
| [5] | HWANG J W, PARK J S, LEE J S, et al. Comparative evaluation of three calcium phosphate synthetic block bone graft materials for bone regeneration in rabbit calvaria[J]. J Biomed Mater Res Part B Appl Biomater, 2012, 100(8): 2044–2052. |
| [6] | RASPERINI G, PILIPCHUK S P, FLANAGAN C L, et al. 3D-printed bioresorbable scaffold for periodontal repair[J]. J Dent Res, 2015, 94(9 Suppl): 153S–157S. |
| [7] | LUONGO F, MANGANO F G, MACCHI A, et al. Custom-made synthetic scaffolds for bone reconstruction:A retrospective, multicenter clinical study on 15 patients[J]. BioMed Res Int, 2016: 5862586. |
| [8] | YUAN H P, VAN BLITTERSWIJK C A, DE GROOT K, et al. Cross-species comparison of ectopic bone formation in biphasic calcium phosphate (BCP) and hydroxyapatite (HA) scaffolds[J]. Tissue Eng, 2006, 12(6): 1607–1615. DOI:10.1089/ten.2006.12.1607 |
| [9] | CHEN Y, WANG J, ZHU X D, et al. Enhanced effect of beta-tricalcium phosphate phase on neovascularization of porous calcium phosphate ceramics:in vitro and in vivo evidence[J]. Acta Biomater, 2015, 11: 435–448. DOI:10.1016/j.actbio.2014.09.028 |
| [10] | PARK J C, OH S Y, LEE J S, et al. In vivo bone formation by human alveolar-bone-derived mesenchymal stem cells obtained during implant osteotomy using biphasic calcium phosphate ceramics or Bio-Oss as carriers[J]. J Biomed Mater Res Part B Appl Biomater, 2016, 104(3): 515–524. DOI:10.1002/jbm.b.33416 |
| [11] | LIM H C, SONG K H, YOU H, et al. Effectiveness of biphasic calcium phosphate block bone substitutes processed using a modified extrusion method in rabbit calvarial defects[J]. J Periodontal Implant Sci, 2015, 45(2): 46–55. DOI:10.5051/jpis.2015.45.2.46 |
| [12] | BOULER J M, PILET P, GAUTHIER O, et al. Biphasic calcium phosphate ceramics for bone reconstruction:A review of biological response[J]. Acta Biomater, 2017, 53: 1–12. DOI:10.1016/j.actbio.2017.01.076 |
| [13] | OLTON D, LI J H, WILSON M E, et al. Nanostructured calcium phosphates (NanoCaPs) for non-viral gene delivery:influence of the synthesis parameters on transfection efficiency[J]. Biomaterials, 2007, 28(6): 1267–1279. DOI:10.1016/j.biomaterials.2006.10.026 |
| [14] | SHI H, MA J, ZHAO N, et al. Periodontal regeneration in experimentally-induced alveolar bone dehiscence by an improved porous biphasic calcium phosphate ceramic in beagle dogs[J]. J Mater Sci Mater Med, 2008, 19(12): 3515–3524. DOI:10.1007/s10856-008-3524-0 |
| [15] | WANG L L, SHI H, CHEN Y J, et al. Healing of acute alveolar bone dehiscence following treatment with porous biphasic calcium phosphate in beagle dogs[J]. Clin Oral Investig, 2011, 15(6): 983–991. DOI:10.1007/s00784-010-0454-2 |
| [16] | 杨小荣, 刘芳, 汪芳, 等. Masson染色法在周围神经损伤中的应用[J]. 诊断病理学杂志, 2012, 19(6): 473–474. DOI:10.3969/j.issn.1007-8096.2012.06.027 |
| [17] | 于斐, 雷鸣, 曾晖, 等. 特殊染色技术在骨关节炎关节软骨形态学研究中的比较[J]. 中国矫形外科杂志, 2015, 23(19): 1801–1807. |
| [18] | KOMORI T, YAGI H, NOMURA S, et al. Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J]. Cell, 1997, 89(5): 755–764. DOI:10.1016/S0092-8674(00)80258-5 |
| [19] | YAMAGUCHI A, KOMORI T, SUDA T. Regulation of osteoblast differentiation mediated by bone morphogenetic proteins, hedgehogs, and Cbfa1[J]. Endocr Rev, 2000, 21(4): 393–411. DOI:10.1210/edrv.21.4.0403 |
| [20] | JIMÉNEZ M JG, BALBÍN M, ALVAREZ J, et al. A regulatory cascade involving retinoic acid, Cbfa1, and matrix metalloproteinases is coupled to the development of a process of perichondrial invasion and osteogenic differentiation during bone formation[J]. J Cell Biol, 2001, 155(7): 1333–1344. DOI:10.1083/jcb.200106147 |
| [21] | DUCY P, STARBUCK M, PRIEMEL M, et al. A Cbfa1-dependent genetic pathway controls bone formation beyond embryonic development[J]. Genes Dev, 1999, 13(8): 1025–1036. DOI:10.1101/gad.13.8.1025 |
| [22] | KAWARIZADEH A, BOURAUEL C, GÖTZ W, et al. Early responses of periodontal ligament cells to mechanical stimulus in vivo[J]. J Dent Res, 2005, 84(10): 902–906. DOI:10.1177/154405910508401006 |
| [23] | 时函, 陈远萍, 史瑞新, 等. 核心结合因子α1与正畸牙移动中牙槽骨改建的相关性研究[J]. 上海口腔医学, 2007, 16(5): 507–511. DOI:10.3969/j.issn.1006-7248.2007.05.014 |
| [24] | GAO Y H, SHINKI T, YUASA T, et al. Potential role of cbfa1, an essential transcriptional factor for osteoblast differentiation, in osteoclastogenesis:regulation of mRNA expression of osteoclast differentiation factor (ODF)[J]. Biochem Biophys Res Commun, 1998, 252(3): 697–702. DOI:10.1006/bbrc.1998.9643 |
 2019, Vol. 45
2019, Vol. 45


