扩展功能
文章信息
- 张曦, 潘玉卿, 李静芳, 杨伟, 高艳章, 魏颖, 石琼, 夏全松, 杨丽
- ZHANG Xi, PAN Yuqing, LI Jingfang, YANG Wei, GAO Yanzhang, WEI Ying, SHI Qiong, XIA Quansong, YANG Li
- 人早幼粒细胞cDNA文库的构建及其鉴定
- Construction of human promyelocytic cDNA library and its identification
- 吉林大学学报(医学版), 2019, 45(05): 1015-1019
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 1015-1019
- 10.13481/j.1671-587x.20190507
-
文章历史
- 收稿日期: 2018-11-24
2. 昆明医科大学第一附属医院检验科 云南省实验诊断研究所 云南省检验医学重点实验室, 云南 昆明 650032
2. Department of Clinical Laboratory, First Affiliated Hospital, Kunming Medical University, Yunnan Institute of Experimental Diagnosis, Yunnan Key Laboratory of Laboratory Medicine, Kunming 650032, China
白血病是一组造血系统的恶性克隆性疾病,在我国的发病率约为7.53/10万,急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是急性髓细胞性白血病(acute myeloid leukemia,AML)的一个亚型,占白血病构成比的10%~15%,男性与女性发病率均等。APL是白血病中最凶险、病程发展最迅速、早期死亡率最高的一种亚型,危害性极大[1-2]。尽管全反式维甲酸及三氧化二砷的应用使该病的缓解率有了较大提高,但其并非对所有的APL患者有效,甚至会导致患者不明原因发热、体质量减轻、肺浸润伴呼吸困难、心包积液、低血压和肾功能衰竭等多种并发症[3]。既往研究[4-5]表明:APL大鼠体内的白血病及维甲酸融合基因所表达的蛋白早幼粒细胞白血病基因-维甲酸受体基因α(PML-RARα)可通过各种转录因子参与细胞内致病信号的传递,但染色体如何易位并促发早幼粒细胞白血病的形成,PML-RARα如何在单个细胞水平干扰RARα和PML 2种蛋白的正常功能及其发病机制目前尚未完全清楚。因此,本研究构建了人早幼粒细胞白血病HL60细胞的cDNA文库,为获取该疾病所有的全基因组片段,探讨其发生的分子机制并寻找诊疗靶点,以期通过酵母双杂交系统筛选文库内与APL发生和发展有生物意义的互作蛋白奠定基础。
1 材料与方法 1.1 细胞株、主要试剂和仪器HL60细胞株购自中国科学院上海细胞库;Oligotex mRNA Kits(德国Qiagen公司),逆转录酶(美国Invitrogen公司),1 000 bp Plus DNA分子标记和双链cDNA合成试剂盒(德国Axygen公司),cDNA均一化试剂盒(俄罗斯Evrogen公司),重组酶和pPR3-N载体(上海海科生物技术有限公司),酵母感受态细胞制备试剂盒(美国Clontech公司);5430R型台式高速冷冻离心机和移液器(德国Eppendorf公司),CFX96型qPCR仪和GenePulserXcell型电转化仪(美国Biorad公司)。
1.2 Ttizol法提取HL60细胞总RNA离心力500 g离心细胞后,用无菌PBS清洗2次。加入10 mL提取液洗脱细胞,室温放置5 min。在上述液体中加入2 mL苯酚氯仿,震荡混匀后于12 000 g、4℃离心10 min。将上层液体转移到新的离心管后,加入等体积的异丙醇,震荡混匀后,12 000 g、4℃离心15 min后弃上清。沉淀物用75%乙醇5 mL洗涤2次,室温晾干溶于500 μL DEPC水。提取的总RNA行电泳检测。
1.3 HL60细胞mRNA分离总RNA中加入70℃预热的BufferOBB 600 μL,混匀,70℃水浴3 min,置于20℃~30℃放置10 min。室温14 000 g离心2 min后,移去液体部分。将沉淀用400 μL buffer OW2重悬,混匀后转移至1.5 mL离心柱上,14 000 g离心1 min。过滤柱转至新的离心管中,加入100 μL预热的DEPC水,混匀后14 000 g离心1 min。过滤柱加入60 μL的2 mol·L-1乙酸钠及600 μL无水乙醇颠倒混匀,置于-80℃冰箱15 min。最后14 000 g低温离心15 min,去上清。空气中晾干沉淀后溶于8 μL的DEPC水中,取2 μL电泳检测,同时检测吸光度(A)值,计算A(260)/A(280)的比值。
1.4 cDNA第一链合成将mRNA溶液用DEPC水补足至22.5 μL后加入3′ RT Primer(1.5g·L-1) 2 μL,立即置于70℃温箱反应7 min,产物立即置于冰上。取一支新的RNase-free管,加入10 μL 5X RT Buffer,2.5 μL 10 mmol·L-1 dNTPs,5 μL DEPC水加入5 μL逆转录酶为反应混合液Ⅰ于冰上待用,将mRNA与上述液体充分混匀,50℃处理50 min。反应产物移至新的EP管中,加入Glycogen1 μL,7.5 mol·L-1 NH4OAc 25 μL,无水乙醇187 μL,于-80℃冰箱放置1 h。16 000 g、4℃离心30 min,室温干燥后,用20 μL DEPC水溶解沉淀,放置冰上备用。
1.5 cDNA第二链合成配制反应液Ⅱ:92 μL DEPC双蒸水,30 μL cDNA第二链合成缓冲液,3 μL dNTPs,6 μL双链DNA合成酶,将第一链产物加入反应液Ⅱ,16℃、2 h。加入2 μL T4 DNA多聚酶16℃、5 min,最后加入10 μL EDTA及160 μL酚、氯仿和异戊醇混合液(酚:氯仿:异戊醇为25:24:1)充分混匀30 s;14 000 g室温离心5 min,将上清移到新的离心管中, 乙醇沉淀,溶于40 μL DEPC水中。
1.6 cDNA加5′接头配制反应体系:cDNA 34 μL,T4 ligase Buffer 5 μL,5′Adapter 10 μL,T4 DNA Ligase 1 μL,混匀16℃过夜后加入10 mol·L-1 dNTP2 μL,T4 DNA聚合酶2 μL,16℃、20 min补平末端,待片段与pPR3-N载体相连。
1.7 胶回收cDNA片段并与载体相连配制1%的琼脂糖凝胶,行电泳法检测上述产物,切胶后回收1 000 bp以上的片段,并用DEPC水溶解回收产物。取7 μL cDNA与3 μL经酶处理的线性化载体pPR3-N混合,加入5 μL重组酶,5 μL灭菌水置于50℃温箱反应1 h。将上述混合物加入2 μL Proteinase K灭活重组酶及78 μL无菌水后,依次加入1 μL Glycogen,50 μL 7.5 mol· L-1 NH4OAc,375 μL无水乙醇,于-80℃冰箱放置1 h。16 000 g、4℃离心30 min,室温干燥后,用10 μL DEPC水重悬沉淀备用。
1.8 cDNA文库的构建及评价采用酵母感受态细胞试剂盒制备酵母Y187感受态细胞,将2.5 μL重组产物采用电转法转移至50 μL感受态细胞,电击结束后电转杯中加入LB培养基1 mL,然后放入新的离心管,补足体积至5 mL,置于37℃,225~250 r·min-1培养1 h。将培养物分别稀释10、100、1 000和10 000倍,分别取10 μL稀释液涂布平板(含氨苄抗性),于次日计数平板上的克隆数即库容量。随机挑选24个平板上的单克隆,PCR法检测文库插入片段的大小。剩余培养物加入甘油至终浓度20%,保存于-80℃冰箱备用。
2 结果 2.1 总RNA电泳检测Trizol法提取HL60细胞总RNA,电泳检测结果显示:2个样本建库的样品28S、18S及5SRNA条带清晰无降解,弥散程度低,且28S RNA水平约为18SRNA的2倍,提示总RNA提取后完全满足建库需求。见图 1。
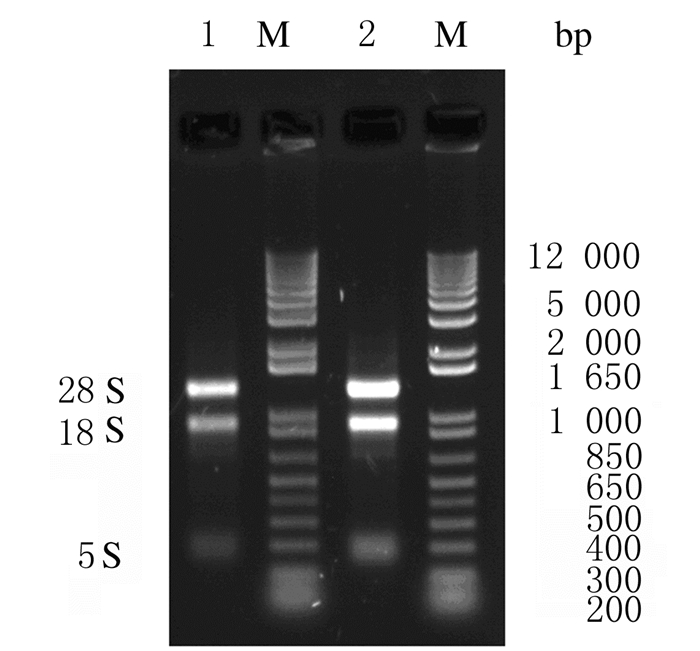
|
| Lane 1, 2:Total RNA of HL60 cells; M:DNA marker. 图 1 HL60细胞总RNA电泳图 Fig. 1 Electrophoregram of total RNA in HL60 cells |
|
|
试剂盒法提取样本中的mRNA为6.2 μg,取2 μL mRNA溶液行琼脂糖凝胶电泳检测,结果显示:条带清晰,呈弥散状分布,提示mRNA质量合格,可以满足建库需要。见图 2。
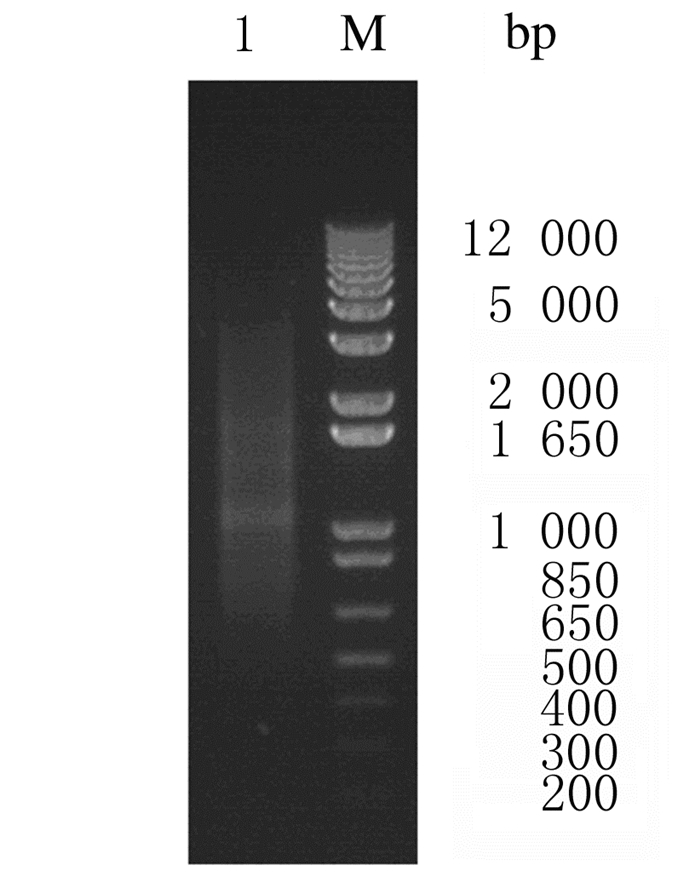
|
| Lane 1:mRNA of HL60 cells; M:DNA marker. 图 2 HL60细胞mRNA电泳图 Fig. 2 Electrophoregram of mRNA in HL60 cells |
|
|
取原始电转化后的菌液10 μL稀释100倍后,从中取出10 μL涂布于含氨苄抗性的LB平板,37℃培养1~2 d,共长出约250个灰白色小菌落(图 3)。手工法计算库容量为2.5×106 CFU·mL-1,共计5 mL原始菌液,总库容量约为1.25×107CFU。

|
| 图 3 转化后菌液平板培养结果 Fig. 3 Result of plate culture of bacteria solution after transformation |
|
|
挑取LB平板上的单克隆行PCR法扩增,电泳检测产物大小,结果显示:插入片段长度约为1500bp,文库阳性率为100%。见图 4。
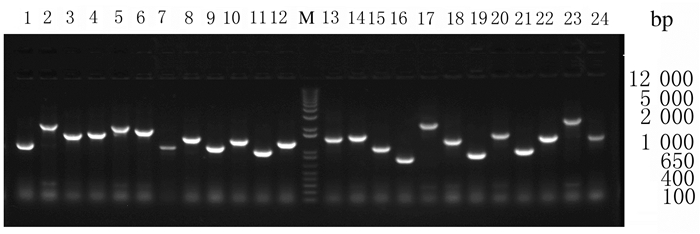
|
| Lane 1-24:Insertion fragment of HL60 cell DNA library; M:DNA marker. 图 4 酵母双杂交cDNA文库插入片段的PCR法检测 Fig. 4 Detection of insert fragments in yeast two-hybrid cDNA library by PCRmethod |
|
|
APL临床表现常见大量白细胞浸润所致的肝脾肿大、感染出血、骨髓造血功能衰竭和弥漫性血管内凝血等症状。APL患者定位于17号染色体上的维甲酸受体基因(retinoic acid receptor alpha,RARα)和定位于15号染色体上的早幼粒细胞基因(promyelocytic leukemia,PML)发生易位,形成融合基因PML-RARα,其编码的融合蛋白PML-RARα在APL的进展中发挥着重要作用[6]。APL的诊断方法包括细胞学、细胞化学、染色体核型分析、RT-PCR法检测相关融合蛋白和流式细胞术进行免疫分型等,每种方法有其各自的优点及其局限性[7]。如何对APL早期干预及治疗需明确其发病机制及信号通路。肥胖是早幼粒细胞白血病预后的危险因素之一[8]。高体质量指数(BMI)作为危险因子在性别及人种无关的APL患者中总体生存率明显降低且易增加细胞多分化的风险[9]。而尽早诊断对于M3V(hypogranular/microgranular)型APL所致的弥漫性血管内凝血(DIC)意义重大[10]。在基因水平上,APL细胞生长受到了异常调控,包括异常增殖和黏附、细胞外基质降解和血管生成增加等[11-12]。
蛋白的酵母双杂交实验是以酵母的遗传分析为基础,研究反式作用因子之间的相互作用对真核基因转录调控的影响, 该系统最初由FIELDS等[13]创立,通过该系统上的DNA结合功能域(DNA-binding domain,BD)和转录激活功能域(activation domain,AD)来实现特异序列上相应基因的转录,其检测灵敏度高,在酵母内保持蛋白质的天然折叠状态,并使蛋白质发生相互作用更接近生理状态。在血液系统疾病研究领域,酵母双杂交系统的运用使得相关疾病的机制得到了有效阐述,WANG等[14]筛选出与肿瘤坏死因子受体相关因子6(TRAF6)互作的B细胞来源的慢性淋系白血病蛋白3(BCL3),其中BLC3能够抑制骨髓中破骨细胞的生成。LU等[15]在白血病细胞系中筛选出能与高表达的ISPP蛋白互作的FHL2蛋白,2种蛋白的高表达促进了白血病细胞增殖并抑制其凋亡。LIN等[16]研究表明:锌指蛋白179(Znf179)能与早幼粒细胞锌指蛋白PLZF发生相互作用,进而阐明Znf179功能。
GINS2基因在白血病细胞系中普遍存在表达异常增高现象[17]。本课题组[18-20]前期成功筛选到稳定沉默GINS2基因的早幼粒细胞白血病HL60细胞株,MTT法和流式细胞术检测结果均显示:实验性的干预GINS2在HL60细胞中的表达后,出现HL60细胞凋亡增加和增殖减少,且下调GINS2表达后可抑制白血病细胞DNA复制并影响其G2/M期进程,其作用机制可能与共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)、检查点激酶2(checkpoint kinase 2,CHK2)、抑癌基因p53和p38MAPK信号通路相关,提示GINS2基因及其表达的蛋白对APL的发生和发展起到了关键作用。为此,本研究构建了人早幼粒细胞来源的HL60细胞系的cDNA文库,以期通过与其互作蛋白的筛选,进一步阐明GINS2在APL中可能的发生机制及信号网络。本研究在体外提取HL60细胞总RNA后,试剂盒法分离纯化样本中的mRNA,去除RNA内核糖体以及残留的基因组对反转录的影响,以及避免文库内掺入核糖体等不需要的基因。采用逆转录法合成cDNA第一链后,再用酶促法直接合成cDNA第二链,保证扩增过程中不会发生选择偏好性,而体系内所有的RNA都直接反转录成双链cDNA。在胶回收cDNA片段后将其与pPR3-N载体连接,通过同源重组的方法在酵母Y187菌株中构建人早幼粒细胞cDNA文库,最终进行库容量以及插入片段大小的检测。
综上所述,本研究成功构建了人早幼粒细胞cDNA文库,为进一步研究白血病的致病机制及蛋白互作等相关信号通路奠定了基础。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA ACancer J Clin, 2019, 69(1): 7–34. DOI:10.3322/caac.21551 |
| [2] | CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | SANZ M A, MONTESINOS P. How we prevent and treat differentiation syndrome in patients with acute promyelocytic leukemia[J]. Blood, 2014, 123(18): 2777–2782. DOI:10.1182/blood-2013-10-512640 |
| [4] | HUANG Y, QIU JH, CHEN GQ, et al. Coiled-coil domain of PML is essential for the aberrant dynamics of PML-RARalpha, resulting in sequestration and decreased mobility of SMRT[J]. Biochem Biophys Res Commun, 2008, 365(2): 258–265. DOI:10.1016/j.bbrc.2007.10.184 |
| [5] | LO-COCO F, HASAN S K. Understanding the molecular pathogenesis of acute promyelocytic leukemia[J]. Best Pract Res Clin Haematol, 2014, 27(1): 3–9. DOI:10.1016/j.beha.2014.04.006 |
| [6] | ARBER D A, ORAZI A, HASSERJIAN R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127(20): 2391–2405. DOI:10.1182/blood-2016-03-643544 |
| [7] | BABA S M, PANDITH A A, SHAH Z A, et al. Pathogenetic implication of fusion genes in acute promyelocytic leukemia and their diagnostic utility[J]. Clin Genet, 2019, 95(1): 41–52. |
| [8] | LI S F, CHEN L, JIN W, et al. Influence of body mass index on incidence and prognosis of acute myeloid leukemia and acute promyelocytic leukemia:A meta-analysis[J]. Sci Rep, 2017, 7(1): 17998. DOI:10.1038/s41598-017-18278-x |
| [9] | BRECCIA M, MAZZARELLA L, BAGNARDI V, et al. Increased BMI correlates with higher risk of disease relapse and differentiation syndrome in patients with acute promyelocytic leukemia treated with the AIDA protocols[J]. Blood, 2012, 119(1): 49–54. DOI:10.1182/blood-2011-07-369595 |
| [10] | BARBUI T, FINAZZI G, FALANGA A. The impact of all-trans-retinoic acid on the coagulopathy of acute promyelocytic leukemia[J]. Blood, 1998, 91(9): 3093–3102. |
| [11] | SAEED S, LOGIE C, STUNNENBERG G, et al. Genome-wide functions of PML-RARα in acute promyelocytic leukaemia[J]. Br J Cancer, 2011, 104(4): 554–558. DOI:10.1038/sj.bjc.6606095 |
| [12] | UY G L, LANE A A, WELCH J S, et al. A protease-resistant PML-RARαhas increased leukemogenic potential in a murine model of acute promyelocytic leukemia[J]. Blood, 2010, 116(18): 3604–3610. DOI:10.1182/blood-2008-11-189282 |
| [13] | FIELDS S, SONG O. A novel genetic system to detect protein-protein interactions[J]. Nature, 1989, 340(6230): 245–246. DOI:10.1038/340245a0 |
| [14] | WANG K, LI S, GAO Y, et al. BCL3 regulates RANKL-induced osteoclastogenesis by interacting with TRAF6 in bone marrow-derived macrophages[J]. Bone, 2018, 114: 257–267. DOI:10.1016/j.bone.2018.06.015 |
| [15] | LU W T, YU T T, LIU S, et al. FHL2 interacts with iASPP and impacts the biological functions of leukemia cells[J]. Oncotarget, 2017, 8(25): 40885–40895. |
| [16] | LIN D Y, HUANG C C, HSIEH Y T, et al. Analysis of the interaction between Zinc finger protein 179(Znf179) and promyelocytic leukemia zinc finger (Plzf)[J]. J Biomed Sci, 2013, 20: 98. DOI:10.1186/1423-0127-20-98 |
| [17] | 高艳军, 刘北忠, 钟梁, 等. GINS2基因siRNA真核表达质粒的构建及其对NB4细胞凋亡的影响[J]. 中国生物制品学杂志, 2012, 25(12): 1602–1606. |
| [18] | 张曦, 刘北忠, 高艳军, 等. 干扰GINS2表达对HL60细胞增殖和凋亡的影响[J]. 中国生物工程杂志, 2013, 33(3): 41–46. |
| [19] | GAO Y J, WANG S B, LIU B Z, et al. Roles of GINS2 in K562 human chronic myelogenous leukemia and NB4 acute promyelocytic leukemia cells[J]. Int J Mol Med, 2013, 31(6): 1402–1410. DOI:10.3892/ijmm.2013.1339 |
| [20] | ZHANG X, ZHONG L, LIU B Z, et al. Effect of GINS2 on proliferation and apoptosis in leukemic cell line[J]. Int J Med Sci, 2013, 10(12): 1795–1804. DOI:10.7150/ijms.7025 |
 2019, Vol. 45
2019, Vol. 45


