扩展功能
文章信息
- 李胜男, 王梦旭, 胡伟东, 陈少凤, 陈杏兰, 李友
- LI Shengnan, WANG Mengxu, HU Weidong, CHEN Shaofeng, CHEN Xinglan, LI You
- miR-186过表达慢病毒载体的构建及鉴定
- Construction and identification of miR-186 overexpression lentiviral vector
- 吉林大学学报(医学版), 2019, 45(05): 997-1002
- Journal of Jilin University (Medicine Edition), 2019, 45(05): 997-1002
- 10.13481/j.1671-587x.20190504
-
文章历史
- 收稿日期: 2018-11-23
2. 广东医科大学附属医院神经病学研究所, 广东 湛江 524002
2. Institute of Neurology, Affiliated Hospital, Guangdong Medical University, Zhanjiang 524002, China
微小RNA(micro-RNA,miRNA)是一类长度为20~25的非编码单链RNA[1],能够通过碱基互补配对原则与其靶基因的3′端非翻译区(3′-Untranslated Region,3′UTR)结合[2-3],促进靶mRNA的降解并抑制靶基因的翻译[4],调控靶基因转录后水平的表达[5]。miRNA参与调控机体的细胞增殖、分化和凋亡等进程,miRNA的功能失调会引起多种类型的疾病,特别是癌症、神经退行性疾病[6]和心血管疾病[7]等,因此miRNA相关信号通路在确定具体的临床治疗方法等方面有重要意义。Hsa-miR-186位于人类染色体1p31.1。研究者在miRBase数据库(http://www.mirbase.org/)上比对miR-186在不同种属之间的序列发现:miR-186的序列在人、小鼠、马、恒河猴、黑猩猩和牛等物种中具有高度的保守性。研究[8]表明:miR-186-5p参与调控多种类型癌症的病理进程,在胆管癌、骨肉瘤和肺癌等癌症中作为致癌基因或肿瘤抑制基因发挥双重作用。如在非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞中,miR-186-5p通过调节细胞周期蛋白D1、细胞周期蛋白依赖性蛋白激酶2(cyclin dependent kinase 2, CDK2)和细胞周期蛋白依赖性蛋白激酶6(cyclin dependent kinase 6, CDK6)来抑制肿瘤细胞的增殖[9]。miR-186还可以通过靶向内质网自噬调节因子1 (reticulophagy regulator 1, RETREG1)促进皮肤鳞状细胞癌细胞增殖并抑制癌细胞的凋亡[10]。此外miR-186-5p也可以作为心血管风险的循环生物标志物来诊断急性冠状动脉综合征[7, 11]。研究[12]显示:miR-186-5p在体外的缺糖缺氧模型和缺血性脑卒中患者的血清中均明显上调,其可能成为缺血性脑中风的潜在血清诊断标志物。最新的研究[13]显示:microRNAs(miR)可以作为老年人常见疾病阿尔茨海默病(Alzheimer’ s disease,AD)的新型诊断和预后生物标志物和治疗靶点。研究[14]显示:miR-186在大脑中高度表达,并且其在大脑皮层中的表达水平随着年龄的增长而下降;miR-186还能够直接负向调控β-分泌蛋白1(Beta-Secretase 1,BACE1)的表达,作为大脑衰老与AD的风险评估因子。最近的研究[13, 15]表明:miR-186能够通过靶向调控γ-分泌酶复合体(γ secretase complex)成员Nicastrin(NCSTN)的表达降低β-淀粉样蛋白(amyloid β-protein, Aβ)的分泌,并且miR-186在AD的进程中也参与调控神经元的氧化应激损伤。AD是一种慢性神经退行性疾病,是老年痴呆症的最常见原因[16],其发病机制及病理进程非常复杂,而miR-186在其中发挥的作用却知之甚少。本研究通过构建过表达miR-186慢病毒载体,包装miR-186过表达慢病毒,为进一步直接使用miR-186慢病毒感染神经细胞提供条件,更有助于今后观察miR-186在神经细胞中的定位,以及其对细胞形态的直接影响,同时也为AD中miR-186的上下游信号通路及具体的作用机制研究奠定基础。
1 材料与方法 1.1 细胞系、质粒、主要试剂和仪器人胚胎肾细胞(HEK)293T细胞系购自中国科学院上海细胞库。载体质粒(FV040)、辅助质粒psPAX2(pHelper1.0)和辅助质粒pMD2G(pHelper2.0)均购于上海复百澳公司。大肠杆菌菌株TOP10和氨苄霉素购自北京索莱宝科技有限公司,质粒抽提试剂盒购自北京天根生化科技有限公司,限制性内切酶EcoRⅠ和AgeⅠ、T4DNA连接酶及DNA Polymerase均购自美国NEB公司,QIAquick Gel Extraction Kit购自德国QIAGEN公司,Revert Acid First Strand cDNA Synthesis Kit购自美国Thermo Scientific公司,2×RealStar Green Power Mixture购自北京康润诚业生物科技有限公司,DMEM培养基、无血清培养基、Opti-MEM胎牛血清和0.05% Typsin Lipofectamine 2000均购自美国Gibco公司。荧光显微镜(CKX41)购自日本Olympus公司,PCR仪(AB2720)购自美国Applied Biosystems公司,实时荧光定量PCR仪(Roche LightCycler96)购自美国罗氏公司。
1.2 引物序列及合成miR-186引物:茎环引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAGCCCA-3′, 上游引物, 5′-CGCGCGCGCAAAGAATTCTCCTTT-3′, 下游引物,5′-ATCCAGTGCAGGGTCCGAGG-3′;内参U6引物:上游引物,5′-CTCGCTTCGGCAGCACA-3′, 下游引物,5′-AACGCTTCACGAATTTGCGT-3′。miR-186引物和U6引物均由上海生工生物工程公司合成。
1.3 FV040 miR-186过表达质粒的构建、转化及鉴定将1对miR-186的Oligo DNA退火成双链,退火体系:上游退火引物(100 μmol·L-1) 1 μL,下游退火引物(100 μmol·L-1) 1 μL,退火缓冲液2 μL,ddH2O 15 μL,T4多聚核苷酸激酶(PNK) 1 μL。在PCR仪中设定反应程序:37℃、30 min,95℃、5 min,温度按照每分钟5℃的速度降至25℃。使用EcoRⅠ和AgeⅠ限制性内切酶对FV040载体进行双酶切,酶切体系:10×NEB Buffer 2 μL,EcoRⅠ 0.5 μL,AgeⅠ 0.5 μL,FV040 1 μg,ddH2O加至总体积为20 μL。将含有酶切体系的PCR管置于37℃水浴锅中酶切过夜。EcoRⅠ和AgeⅠ双酶切后使用酶切回收试剂盒切胶回收FV040质粒。随后将目的片段miR-186全基因通过T4DNA连接酶连接至FV040载体上。连接体系:酶切回收DNA 2 μL,稀释后退火引物(100 μmol·L-1)6 μL,10×T4 Ligase Buffer 1.5 μL,T4 DNA连接酶1 μL,ddH2O添加至15 μL,16℃连接过夜。
将FV040 miR-186连接产物加入100 μL TOP10感受态细胞中混匀,冰上反应0.5 h后置于42℃水浴中热激90 s,随后置于冰上冷却5 min,并将其均匀涂布于含100 mg·L-1氨苄LB培养平板,倒置平板于37℃恒温箱中,过夜培养12~16 h。次日取出见平板上长出菌落,挑取5个单克隆分别于3 mL含100 mg·L-1的LB培养基的BD摇菌管中,37℃恒温摇床摇菌过夜,吸取部分菌液用50%甘油保菌,剩余菌液送上海生工生物工程公司进行测序。保留鉴定成功的甘油菌,蘸取少量甘油菌于5 mLBD摇菌管中摇菌8 h,随后吸取2 mL小摇的菌液于500mL LB生长培养基中继续摇菌过夜扩大培养,次日进行质粒的抽提。
1.4 miR-186过表达慢病毒的包装在10 cm的培养皿中培养HEK293T细胞,生长至70%~80%时,按照1:3的比例将细胞传代至2个直径为10 cm细胞培养皿中,次日进行细胞转染。转染体系:分为Mixture A和Mixture B 2个体系:A体系为750 μL Opti-MEM+15 μL Lipofactamine 2000,B体系为750 μL Opti-MEM+ 10 μg FV040载体质粒(10 μg FV040 miR-186质粒)+5 μg pHelper 1.0载体+5 μg pHelper 2.0载体,A和B体系混匀后,室温静置5 min。随后将B体系加入A体系中,混匀并静置20 min。期间将2个直径为10 cm的细胞培养皿中的生长培养基换成2 mL Opti-MEM。20 min后将A和B混合物分别均匀滴加到10 cm细胞培养皿中。转染4 h后,换成15 mL HEK293T细胞生长培养基,细胞继续培养48 h后收集上清。
1.5 miR-186过表达慢病毒的收集及浓缩将转染48 h后的培养基上清收集到50 mL离心管中,4℃、5 000 r·min-1离心3 min去除细胞碎片。随后用0.45 μm的滤膜,过滤上清至新离心管,4℃超高速离心机80 000 g离心4 h。弃上清,用DPBS溶解病毒,并分装保存于-80℃冰箱。
1.6 miR-186过表达慢病毒感染HEK293T细胞将HEK293T细胞铺在12孔板中,次日待细胞密度达到70%~80%时,开始选择病毒的最佳感染复数(MOI),设置25、50、75和100 MOI进行慢病毒感染实验。在12孔板中分别加入一定量的FV040慢病毒和miR-186过表达慢病毒,每组设置3个复孔。病毒感染24 h后,换成HEK 293T生长培养基。感染72 h后,在荧光显微镜下观察细胞状态和慢病毒的感染效率。当MOI=50时,细胞状态良好并且慢病毒的感染效率达到90%,故选择MOI=50进行后续的慢病毒感染实验。
1.7 实时荧光定量PCR法检测HEK293T细胞中miR-186表达水平将细胞铺在35 mm培养皿中,次日按照MOI=50分别感染FV040慢病毒(对照组)和miR-186过表达慢病毒(实验组)。感染72 h后,收集细胞,使用Trizol裂解法裂解细胞提取RNA,加入20 μL DEPC水溶解RNA。随后使用核酸检测仪检测RNA浓度并记录吸光度(A)值,计算A(260)/A(280)比值。RNA逆转录实验,用DNase Ⅰ去除RNA中的DNA,反应体系:RNA 1 μg,10×Reaction Buffer 1 μL,DNase Ⅰ 1 μL,DEPC水加至总体积为10 μL,混匀后置于PCR仪上,37℃反应30 min。随后向反应体系中加入1 μL 50 mmol·L-1 EDTA终止反应,PCR仪中65℃反应10 min。使用Revert Acid First Strand cDNA Synthesis Kit合成cDNA,反应体系:RNA 1 μg,5×Reaction Buffer 4 μL,miR-186 RT primer(100 μmol·L-1)1 μL,10 mmol·L-1 dNTP Mix 2 μL,Revert Aid M-MuLV RT (200 U·μL-1) 1 μL,RiboLockRNase Inhibitor (20 U·μL-1)1 μL,RNase-free H2O添加至总体积为20 μL。PCR仪上反应:42℃、60 min,70℃、5 min。采用2×RealStar Green Power Mixture试剂盒进行实时荧光定量PCR法检测,反应体系:cDNA 0.5 μg,miR-186 Forwadprimer(10 μmol·L-1)0.4 μL,miRNA-186 Reverse primer(10 μmol·L-1)0.4 μL,2×RealStar Green Power Mixture 10 μL,RNase-free H2O补足至20 μL。使用两步法PCR扩增程序:95℃、10 min;95℃、15 s,60℃、1 min,40个循环。以U6为内参,采用2-ΔΔCT法计算miR-186相对表达水平。其中ΔCt=目的基因(miR-186)Ct平均值-内参基因(U6)Ct平均值,ΔΔCt=ΔCt(实验组)- ΔCt(对照组)。实验重复3次。
1.8 统计学分析采用Graphpad Prism 5统计软件进行统计学分析。miR-186相对表达水平以x±s表示,2组间样本均数比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
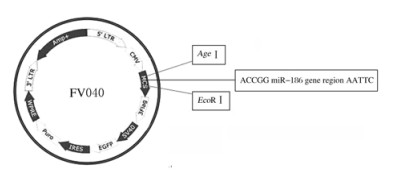
2 结果 2.1 miR-186过表达慢病毒载体图谱的构建在miRBase数据库中查找hsa-miR-186序列,根据其序列设计并合成miR-186引物,在慢病毒载体FV040多克隆位点处选择EcoRⅠ和AgeⅠ2个限制性酶切位点进行双酶切后,将PCR扩增的pre-miR-186序列,通过T4 DNA连接酶连接到携带EGFP/Puromycin的慢病毒载体FV040中。随后将FV040 miR-186质粒送到公司进行测序,将测序成功的DNA序列与GenBank上公布miR-186序列进行比对,两者的miR-186序列完全匹配,表明miR-186序列已经成功克隆到FV040载体中,FV040 miR-186慢病毒载体图谱构建成功(图 1)。
|
| 图 1 miR-186过表达慢病毒载体的构建 Fig. 1 Construction of miR-186 overexpression lentivirus vector |
|
|
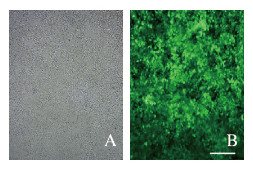
将HEK293T细胞按照1:10比例传代至35 mm细胞培养皿中,次日,待细胞密度达70%~80%时,使用MOI=50的FV040慢病毒和FV040 miR-186过表达慢病毒分别感染HEK293T细胞。72 h后,在荧光显微镜下观察绿色荧光蛋白表达,显示约90%以上的实验组细胞均表达绿色荧光蛋白(图 2,见插页一)。
|
| 图 2 miR-186过表达慢病毒成功感染的HEK293T细胞(Bar=1 000 μm) Fig. 2 HEK293T cells successfully infected with miR-186 overexpression lentivirus(Bar=1 000 μm) |
|
|
与对照组(0.8387±0.1456)比较,实验组HEK293T细胞中miR-186表达水平(12.6400±0.7884)明显升高(t=14.72,P < 0.01),约为对照组的15.07倍。
3 讨论AD是一种记忆认知功能逐渐减退的渐进性神经退行性疾病[17]。AD通常表现为错误折叠蛋白的聚集、Aβ和tau蛋白的沉积[18]以及进行性认知功能障碍[19]。AD发病原因主要是由于载脂蛋白E对Aβ蛋白的异常聚集和清除,同时年龄、种族和地区等因素也可能会影响AD的发生[20]。最近的研究[21]表明:miRNA在AD发病及进展中发挥着重要的作用。miRNA的功能失调会影响淀粉样β蛋白前体(APP)表达和Aβ的分泌,miRNA-338- 5p过表达可以抑制BACE1 mRNA表达及Aβ的形成,影响AD后期的神经炎性反应[22]。miR-138过表达还可以促进Aβ的产生以及tau蛋白的磷酸化[23],进而升高AD的风险[24]。研究[25]显示:AD与环状RNA(circle RNA,circRNA)有密切关联,CircHDAC9可以作为miR-138的海绵,抑制miR-138表达,从而促进去乙酰化酶1(sirtuin 1, Sirt1)表达,减少Aβ的生成。circHDAC9/miR-138/Sirt1信号通路为AD的治疗提供了潜在的靶点。miR-186可以通过靶向结合BACE1 mRNA的3′UTR区,抑制BACE1的表达[14]和Aβ的产生[15],影响AD的病理进程,因此miR-138可作为AD风险增加或早期诊断的标志物。然而,迄今为止尚未发现调控miR-186表达的AD相关circRNA,因而进一步研究调控miR-186功能的AD相关circRNA具有重要的意义。
目前针对miRNA的研究,主要是使用化学合成的miRNA模拟物、miRNA抑制剂或者经过特殊标记和化学修饰的miRNA激动剂及miRNA拮抗剂,通过瞬时转染的方法来增强或抑制内源性miRNA的表达,从而进一步调节靶基因的生物学功能。然而因miRNA模拟物、miRNA抑制剂、miRNA激动剂和miRNA拮抗剂的作用时间相对较短,作用效果相对较差且不稳定,故在体内外实验中的应用较为有限[26]。慢病毒载体可以有效地将目的基因整合到宿主染色体上,稳定而持久地表达目的基因,并且慢病毒的感染能力较强,可有效稳定地提高目的基因在体外难转染细胞中的转染效率[27-28],有利于后续实验的顺利开展。
综上所述,本研究通过构建FV040 miR-186过表达慢病毒载体,以及后续的miR-186慢病毒感染HEK293T细胞和实时荧光定量PCR法等实验,结果显示:感染miR-186过表达慢病毒的HEK293T细胞中miR-186表达水平明显增加,表明成功包装了miR-186慢病毒。本研究结果为今后深入研究miR-186与AD相关的上游circRNAs及下游靶基因的具体作用机制提供了条件,也为进一步研究miR-186在AD脑中的变化以及其失调所涉及的生物学途径奠定了基础。
| [1] | AMBROS V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350–355. DOI:10.1038/nature02871 |
| [2] | DOENCH J G, SHARP P A. Specificity of microRNA target selection in translational repression[J]. Genes Dev, 2004, 18(5): 504–511. DOI:10.1101/gad.1184404 |
| [3] | HOSIN A A, PRASAD A, VⅡRI L E, et al. MicroRNAs in atherosclerosis[J]. J Vasc Res, 2015, 51(5): 338–349. |
| [4] | SAVITT J M, DAWSON V L, DAWSON T M. Diagnosis and treatment of Parkinson disease:molecules to medicine[J]. J Clin Invest, 2006, 116(7): 1744–1754. DOI:10.1172/JCI29178 |
| [5] | LEE Y, AHN C, HAN J J, et al. The nuclear RNase Ⅲ Drosha initiates microRNA processing[J]. Nature, 2003, 425(6956): 415–419. DOI:10.1038/nature01957 |
| [6] | XIE Y M, CHEN Y H. microRNAs:Emerging targets regulating oxidative stress in the models of Parkinson's disease[J]. Front Neurosci, 2016, 10: 298. |
| [7] | WANG K J, ZHAO X, LIU Y Z, et al. Circulating MiR-19b-3p, MiR-134-5p and MiR-186-5p are promising novel biomarkers for early diagnosis of acute myocardial infarction[J]. Cell Physiol Biochem, 2016, 38(3): 1015–1029. |
| [8] | ZHAO X, WANG Y L, DENG R, et al. miR186 suppresses prostate cancer progression by targeting Twist1[J]. Oncotarget, 2016, 7(22): 33136–33151. |
| [9] | CAI J C, WU J H, ZHANG H Z, et al. miR-186 downregulation correlates with poor survival in lung adenocarcinoma, where it interferes with cell-cycle regulation[J]. Cancer Res, 2013, 73(2): 756–766. DOI:10.1158/0008-5472.CAN-12-2651 |
| [10] | HU X D, LIU Y F, AI P, et al. MicroRNA-186 promotes cell proliferation and inhibits cell apoptosis in cutaneous squamous cell carcinoma by targeting RETREG1[J]. Exp Ther Med, 2019, 17(3): 1930–1938. |
| [11] | WU J, SONG J X, WANG C, et al. Identification of serum microRNAs for cardiovascular risk stratification in dyslipidemia subjects[J]. Int J Cardiol, 2014, 172(1): 232–234. |
| [12] | WANG R, BAO H, ZHANG S, et al. miR-186-5p promotes apoptosis by targeting IGF-1 in SH-SY5Y OGD/R Model[J]. Int J Biol Sci, 2018, 14(13): 1791–1799. DOI:10.7150/ijbs.25352 |
| [13] | WU D M, WEN X, WANG Y J, et al. Effect of microRNA-186 on oxidative stress injury of neuron by targeting interleukin 2 through the janus kinase-signal transducer and activator of transcription pathway in a rat model of Alzheimer's disease[J]. J Cell Physiol, 2018, 233(12): 9488–9502. DOI:10.1002/jcp.26843 |
| [14] | KIM J, YOON H, CHUNG D E, et al. miR-186 is decreased in aged brain and suppresses BACE1 expression[J]. J Neurochem, 2016, 137(3): 436–445. DOI:10.1111/jnc.13507 |
| [15] | DELAY C, DORVAL V, FOK A, et al. MicroRNAs targeting Nicastrin regulate Abeta production and are affected by target site polymorphisms[J]. Front Mol Neurosci, 2014, 7: 67. |
| [16] | GIRI M, SHAH A, UPRETI B, et al. Unraveling the genes implicated in Alzheimer's disease[J]. Biomed Rep, 2017, 7(2): 105–114. |
| [17] | HØGH P. Alzheimer's disease[J]. Ugeskr Laeg, 2017, 179(12): V09160686. |
| [18] | HAMANO T, HAYASHI K, SHIRAFUJI N, et al. The implications of autophagy in Alzheimer's disease[J]. Curr Alzheimer Res, 2018, 15(14): 1283–1296. DOI:10.2174/1567205015666181004143432 |
| [19] | BERTRAM L, LILL C M, TANZI R E. The genetics of Alzheimer disease:back to the future[J]. Neuron, 2010, 68(2): 270–281. DOI:10.1016/j.neuron.2010.10.013 |
| [20] | KIM J, BASAK J M, HOLTMAN D M. The role of apolipoprotein E in Alzheimer's disease[J]. Neuron, 2009, 63(3): 287–303. DOI:10.1016/j.neuron.2009.06.026 |
| [21] | LUKIW W J, ANDREEVA T V, GIGORENKO A P, et al. Studying micro RNA function and dysfunction in Alzheimer's disease[J]. Front Genet, 2012, 3: 327. |
| [22] | QIAN Q, ZHANG J, HE F D, et al. Down-regulated expression of microRNA-338-5p contributes to neuropathology in Alzheimer's disease[J]. FASEB J, 2019, 33(3): 4404–4417. DOI:10.1096/fj.201801846R |
| [23] | Boscher E, Husson T, Quenez O, et al. Copy number variants in miR-138 as a potential risk factor for early-onset Alzheimer's disease[J]. J Alzheimers Dis, 2019, 68(3): 1243–1255. DOI:10.3233/JAD-180940 |
| [24] | DELAY C, CALON F, MATHEWS P, et al. Alzheimer-specific variants in the 3'UTR of Amyloid precursor protein affect microRNA function[J]. Mol Neurodegener, 2011, 6: 70. DOI:10.1186/1750-1326-6-70 |
| [25] | LU Y, TAN L, WANG X. Circular HDAC9/microRNA-138/Sirtuin-1 pathway mediates synaptic and amyloid precursor protein processing deficits in Alzheimer's disease[J]. Neurosci Bull, 2019, 18: 1–12. |
| [26] | 赵静, 杨兴武, 李京涛, 等. 基于高通量测序的肝癌circRNA-miRNA-mRNA调控网络构建及功能富集分析[J]. 临床肝胆病杂志, 2019, 35(8): 1740–1744. |
| [27] | 李琦, 邹志余, 杨瑞泽, 等. 慢病毒载体介导增强型绿色荧光蛋白筛选稳定转染的兔骨髓间充质干细胞[J]. 西安交通大学学报:医学版, 2019, 40(4): 619–623. |
| [28] | NASRI M, KARIMI A, ALLAHBAKHSHIAN FARSANI M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes[J]. Cytotechnology, 2014, 66(6): 1031–1038. DOI:10.1007/s10616-013-9652-5 |
 2019, Vol. 45
2019, Vol. 45


