扩展功能
文章信息
- 宿凯笙, 赵令, 冯秀南, 姜振宇
- SU Kaisheng, ZHAO Ling, FENG Xiunan, JIANG Zhenyu
- 抗Ro-52抗体阳性的抗合成酶综合征2例报告及文献复习
- Antisynthetase syndrome with positive anti-Ro52 antibody: A report of 2 cases and literature review
- 吉林大学学报(医学版), 2019, 45(04): 935-939
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 935-939
- 10.13481/j.1671-587x.20190434
-
文章历史
- 收稿日期: 2018-11-11
抗合成酶综合征(anti-synthetase syndrome, ASS)临床少见,作为特发性炎症性肌病的一种亚型,其特征是血清中出现以抗Jo-1抗体为主的抗氨基酰-tRNA合成酶抗体,以肌炎、间质性肺疾病(interstitial lung disease, ILD)、雷诺现象、“技工手”、发热和关节炎为主要症状,临床表现多种多样,由于其可能引发的ILD及继发肿瘤使其成为一种预后不良的疾病而受到重视[1]。抗Ro-52抗体作为抗核抗体谱中的一种,近年来发现其在不同的自身免疫性疾病中具有不同的临床意义[2]。目前国外已有针对该抗体在ASS中出现的高频性及其临床意义的相关报道[2-3],但国内尚无相关报道。本文作者结合文献复习对2例抗Ro-52抗体阳性ASS患者的临床资料进行分析总结,以加强临床医生对抗Ro-52抗体阳性ASS患者临床特点的认识。
1 临床资料 1.1 一般资料病例1,女性,36岁。2018年8月因双手关节肿痛4月余,加重伴全身乏力10余天就诊于本科。患者3个月前就诊于当地医院,当时查抗环瓜氨酸肽(CCP)抗体和抗核抗体(ANA)系列均阴性,诊断为“血清阴性类风湿关节炎”并给予相关治疗(具体治疗药物和剂量不详),无明显好转。10余天前出现关节肿痛加重并伴有全身乏力。病程中偶有胸闷及活动后气短;无发热,无光过敏,无明显脱发,无雷诺现象。专科查体:患者双手桡侧掌面皮肤粗糙,出现角化、裂纹及脱屑,呈“技工手”样改变,Gottron征阳性;双肺呼吸音粗,未闻及干湿性啰音;上下肢肌力5级,肌张力正常;双手近端指间关节肿胀,压痛(+), 双膝、双肘关节压痛(+)。
病例2,女性,34岁。2017年12月因双手关节肿胀1月余,加重伴双手、双足和颜面部水肿7d,发热3d入院。3d前因周身水肿和发热就诊于当地医院,给予白蛋白、利尿剂及抗感染治疗,水肿有所消退但发热无缓解。患者为求进一步诊治就诊于本科。病程中偶有心悸、气短及呼吸困难;无寒战,无光过敏,无脱发,无雷诺现象。专科查体:患者双手呈“技工手”样改变,双手背侧皮肤表面散在丘疹,无红肿及瘙痒感;双肺下野叩诊浊音,听诊呼吸音粗,左下肺可闻及吸气相末期干湿啰音;上下肢肌力5级,肌张力正常;双手掌指关节、指间关节肿胀,压痛(-)。
2例患者均出现明显的关节症状和呼吸系统症状,肌炎所致的肌肉无力及肌痛表现尚不明显;既往均无阳性病史。
1.2 影像学检查2例患者肺CT均提示双肺间质性改变;病例1肺CT仅为右肺中叶、左肺舌叶及双肺下叶散在网格状及磨玻璃样改变(图 1A和B);患者2表现为ILD改变并发双侧胸腔积液和肺不张(图 1C和D)。
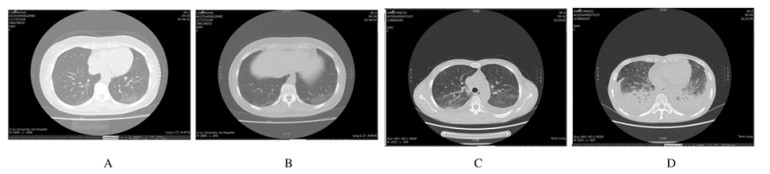
|
| A, B: Case 1;C, D:Case 2;A, C:Ground glass and reticulation images in the middle lobe of both lungs; B:Ground glass and reticulation images in the lower lobe of both lungs; D:Ground glass, reticulation, atelectasis and pleural effusion in the lower lobe of both lungs. 图 1 2例ASS患者的肺CT影像 Fig. 1 Image performances of lung CT of 2 cases of ASS patients |
|
|
2例患者肌酸激酶均升高,肌炎抗体谱示抗Jo-1和抗Ro-52抗体强阳性;肌电图提示肌源性损害;肌肉活检符合特发性炎症性疾病改变,但肌纤维尚无坏死表现,炎症较轻。
病例1,肌酸激酶1305 U·L-1。肌炎抗体谱:抗Jo-1抗体IgG(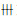
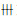
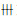
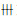
根据参考文献[1]中制定的诊断标准,2例患者均明确诊断为ASS。2例患者均给予糖皮质激素及以羟氯喹为基础的免疫抑制剂治疗,治疗反应良好,随访未见疾病活动及继发肿瘤征象。
病例1:给予甲强龙80 mg每日1次静点,吗替麦考酚酯0.75g每日2次口服,羟氯喹0.2g每日2次口服。治疗7d后复查血清肌酸激酶为434 U·L-1,关节疼痛和乏力症状缓解,激素改为口服,嘱患者出院后规律用药,定期复查。出院1个月后随访,症状未见复发,复查疾病活动相关指标(肌酸激酶、C反应蛋白和血沉等)及肿瘤标志物检测结果未见明显异常。病例2:给予甲强龙80 mg每日1次静点,艾拉莫德25 mg每日2次口服,羟氯喹0.2 g每日2次口服。治疗7d后复查血清肌酸激酶为326U·L-1,关节肿胀、周身水肿及发热症状明显缓解,激素改为口服,嘱患者出院后规律用药,定期复查。出院1和3个月后随访2例患者症状未见复发,复查疾病活动相关指标(肌酸激酶、C反应蛋白和血沉等)及肿瘤标志物检测结果未见明显异常。
2 讨论在以往的认识中,抗Ro-52抗体和抗Ro-60抗体,即抗SSA抗体,属于抗核抗体谱中的一种抗体[2-3]。但SCHULTE-PELKUM等[4]研究认为:Ro-52蛋白和Ro-60蛋白是2种独立的生物大分子蛋白。应用线性免疫检测法研究结果[5-6]显示:抗Ro-52抗体阳性的血清样本,在应用传统的间接免疫荧光法检测时无法显示抗SSA抗体阳性。目前研究者[3]认为:抗Ro-52抗体并非抗SSA抗体的一部分,二者是两种独立的抗体系统,具有不同的临床意义。因此,临床上对于该种抗体的单独检测十分必要,单独检测抗SSA抗体易于漏检。
ASS的标志性特点是血清中肌炎自身抗体的出现。目前有研究者[2, 7-9]认为:抗Ro-52抗体可以作为一种肌炎相关性抗体(myositis-associated antibodies, MAA),并发现其与作为肌炎特异性抗体(myositis-specified antibodies, MSA)的抗合成酶抗体高频共同出现。RUTJES等[10]研究显示:约60%的抗Jo-1抗体阳性患者的血清中可检测出抗Ro-52抗体,且二者间不存在交叉反应性。进一步研究[11-12]证实:抗Ro-52抗体同样以高频率(约70%)出现在其他抗合成酶抗体阳性患者的血清样本中,如抗PL-7和PL-12抗体,提示抗Ro-52抗体与抗合成酶抗体间具有相关性,但其共同出现的机制尚无报道。研究[2-3]显示:抗Ro-52抗体作为一种致病性抗体在疾病的发生发展过程中起作用。
抗Ro-52抗体与ASS患者的某些临床表现有关。文献[1, 13-14]报道:抗Ro-52抗体阳性ASS患者的关节表现酷似类风湿关节炎,并发关节表现的ASS应作为不典型类风湿关节炎鉴别诊断的一种。LEE等[2]报道:抗Ro-52抗体在多种结缔组织病中均可出现,但仅在ASS中其与关节症状有相关性。MARIE等[6]认为:抗Ro-52抗体的出现导致ASS患者出现严重的关节表现,如关节脱位、畸形和侵蚀性关节炎,即使通过治疗,关节功能丧失也很常见。本研究报道的2例患者均以双手关节症状为首发表现,肌炎症状均不明显,肌力正常,肌酸激酶升高程度尚不严重,通过肌电图和肌肉活检才得以确认肌炎诊断,且肌肉活检显示肌炎改变程度均较轻,其病程进展与典型多发性肌炎明显不同。目前,抗Ro-52抗体与肌肉受累严重程度之间的相关性尚无报道。
ASS患者有发生ILD和继发肿瘤的可能性使其成为预后不良的疾病,抗Ro-52抗体的存在将进一步恶化患者的预后。文献[1, 15]报道:ASS相关性ILD将由于抗Ro-52抗体的出现隐匿性更强、更易发展为快速进展型ILD及难治性呼吸衰竭。印度一项横断面研究[16]显示:抗Ro-52抗体阳性ASS患者患ILD风险明显升高,且这一风险并不仅限于抗Jo-1抗体,与其他抗合成酶抗体共存时同样可增加这一风险。这一联系的内在机制尚待进一步研究。CRUELLAS等[17]主张将抗Ro-52抗体作为肌炎相关性ILD诊断敏感性极高的抗体,但其特异性较差。本研究报道的2例患者呼吸系统症状轻而影像学改变程度重,ILD呈隐匿进展。
ASS患者继发恶性肿瘤的机会较高,可能与其自身免疫的紊乱有密切关联。Ro-52蛋白可能是一种抑癌基因产物,作为细胞内转录调节因子,其有抑制正常细胞恶变的功能[18]。临床研究[6]也证实了上述分子生物学进展:在至少5年访视期内,89例抗Jo-1抗体阳性患者中,36例抗Ro-52抗体阳性患者有7例继发肿瘤,53例抗Ro-52抗体阴性患者仅有3例继发肿瘤。研究[19]显示:抗合成酶抗体与ASS继发肿瘤呈负相关关系。抗Ro-52抗体与ASS继发肿瘤及不良预后间的相关性[20]也得到了证实,然而该抗体能否成为ASS患者继发肿瘤的预测因素仍有待进一步研究。本研究报道的2例患者均为年轻女性且在院期间及短期随访内均尚未发现恶性肿瘤征象,但因其存在抗Ro-52抗体这一不良因素,后续定期随访检查十分必要。
针对ASS的治疗,目前的主流方案仍为应用激素和免疫抑制剂治疗[13]。有学者[15]通过研究证实:抗Ro-52抗体可以作为包括快速进展性ILD在内的重型ASS应用利妥昔单抗(rituximab,RTX)治疗的血清生物学标志,在访视期内应用RTX的抗Ro-52抗体阳性ASS患者多数达到了肌炎的完全缓解、ILD的明显好转或完全缓解,与之对照的应用传统免疫抑制剂的患者则治疗反应较差。对于抗Ro-52抗体阳性ASS患者,RTX为其后续治疗提供了新的治疗选择及思路。
综上所述,抗Ro-52抗体是一种独立的抗体系统,其作为一种MAA在ASS中与抗合成酶抗体合并出现的频率较高,且与ASS患者的不良预后有关联。临床医师应充分认识抗Ro-52抗体与ASS间的联系,在诊治过程中应高度警惕,及时对患者关节损伤、ILD进展及继发肿瘤进行评估并适时应用RTX,以进一步改善患者的预后,提高患者的生存质量。
| [1] | URIBE L, RONDEROS D M, DÍAZ M C, et al. Antisynthetase antibody syndrome:case report and review of the literature[J]. Clin Rheumatol, 2013, 32(5): 715–719. DOI:10.1007/s10067-013-2207-5 |
| [2] | LEE A Y S. A review of the role and clinical utility of anti-Ro52/TRIM21 in systemic autoimmunity[J]. Rheumatol Int, 2017, 37(8): 1323–1333. DOI:10.1007/s00296-017-3718-1 |
| [3] | OKE V, WAHREN-HERLENIUS M. The immunobiology of Ro52(TRIM21) in autoimmunity:a critical review[J]. J Autoimmun, 2012, 39(1/2): 77–82. |
| [4] | SCHULTE-PELKUM J, FRITZLER M, MAHLER M. Latest update on the Ro/SS-A autoantibody system[J]. Autoimmun Rev, 2009, 8(7): 632–637. DOI:10.1016/j.autrev.2009.02.010 |
| [5] | PEENE I, MEHEUS L, DE KEYSER S, et al. Anti-Ro52 reactivity is an independent and additional serum marker in connective tissue disease[J]. Ann Rheum Dis, 2002, 61(10): 929–933. DOI:10.1136/ard.61.10.929 |
| [6] | MARIE I, HATRON P Y, DOMINIQUE S, et al. Short-term and long-term outcome of anti-Jo1-positive patients with anti-Ro52 antibody[J]. Semin Arthritis Rheum, 2012, 41(6): 890–899. DOI:10.1016/j.semarthrit.2011.09.008 |
| [7] | LABRADOR-HORRILLO M, MARTÍNEZ M A, SELVA-O'CALLAGHAN A, et al. Identification of a novel myositis-associated antibody directed against cortactin[J]. Autoimmun Rev, 2014, 13(10): 1008–1012. DOI:10.1016/j.autrev.2014.08.038 |
| [8] | BETTERIDGE Z, MCHUGH N. Myositis-specific autoantibodies:an important tool to support diagnosis of myositis[J]. J Int Med, 2016, 280(1): 8–23. |
| [9] | SATOH M, TANAKA S, CERIBELLI A, et al. A comprehensive overview on myositis-specific antibodies:new and old biomarkers in idiopathic inflammatory myopathy[J]. Clin Rev Allergy Immunol, 2017, 52(1): 1–19. DOI:10.1007/s12016-015-8510-y |
| [10] | RUTJES SA, VREE EGBERTS W T, JONGEN P, et al. Anti-Ro52 antibodies frequently co-occur with anti-Jo-1 antibodies in sera from patients with idiopathic inflammatory myopathy[J]. Clin Exp Immunol, 1997, 109(1): 32–40. DOI:10.1046/j.1365-2249.1997.4081308.x |
| [11] | FRANK M B, MCCUBBIN V, TRIEU E, et al. The association of anti-Ro52 autoantibodies with myositis and scleroderma autoantibodies[J]. J Autoimmun, 1999, 12(2): 137–142. DOI:10.1006/jaut.1998.0265 |
| [12] | 黄春梅, 李永哲. 多发性肌炎/皮肌炎自身抗体谱的研究进展[J]. 国际检验医学杂志, 2006, 27(1): 33–35, 39. DOI:10.3969/j.issn.1673-4130.2006.01.013 |
| [13] | CHATTERJEE S, PRAYSON R, FARVER C. Antisynthetase syndrome:not just an inflammatory myopath[J]. Cleve Clin J Med, 2013, 80(10): 655–666. DOI:10.3949/ccjm.80a.12171 |
| [14] | MUMM G E, MCKOWN K M, BELL C L. Antisynthetase syndrome presenting as rheumatoid-like polyarthritis[J]. J Clin Rheumatol, 2010, 16(7): 307–312. DOI:10.1097/RHU.0b013e3181f3bf9c |
| [15] | BAUHAMMER J, BLANK N, MAX R, et al. Rituximab in the treatment of Jo1 antibody-associated antisynthetase syndrome:anti-ro52 positivity as a marker for severity and treatment response[J]. J Rheumatol, 2016, 43(8): 1566–1574. DOI:10.3899/jrheum.150844 |
| [16] | SRIVASTAVA P, DWIVEDI S, MISRA R. Myositis-specific and myositis-associated autoantibodies in Indian patients with inflammatory myositis[J]. Rheumatol Int, 2016, 36(7): 935–943. DOI:10.1007/s00296-016-3494-3 |
| [17] | CRUELLAS M G, VIANA V D O S S, LEVY-NETO M, et al. Myositis-specific and myositis-associated autoantibody profiles and their clinical associations in a large series of patients with polymyositis and dermatomyositis[J]. Clinics (Sao Paulo), 2013, 68(7): 909–914. DOI:10.6061/clinics |
| [18] | ESPINOSA A, DARDALHON V, BRAUNER S, et al. Loss of the lupus autoantigen Ro52/Trim21 induces tissue inflammation and systemic autoimmunity by disregulating the IL-23-Th17 pathway[J]. J Exp Med, 2009, 206(8): 1661–1671. DOI:10.1084/jem.20090585 |
| [19] | SELVA-O'CALLAGHAN A, TRALLERO-ARAGUÁS E, GRAU-JUNYENT J M, et al. Malignancy and myositis:novel autoantibodies and new insights[J]. Curr Opin Rheumatol, 2010, 22(6): 627–632. DOI:10.1097/BOR.0b013e32833f1075 |
| [20] | SCHMIDT J. Current classification and management of inflammatory myopathies[J]. J Neuromuscul Dis, 2018, 5(2): 109–129. DOI:10.3233/JND-180308 |
 2019, Vol. 45
2019, Vol. 45


