扩展功能
文章信息
- 李婳, 曹艳莎, 赵津平, 任甫, 李宁
- LI Hua, CAO Yansha, ZHAO Jinping, REN Fu, LI Ning
- 组织芯片技术检测SIRT6蛋白在结肠癌组织中的表达及其临床意义
- Expression of SIRT6 protein in colon cancer tissue detected by tissue microarray technique and its clinical significance
- 吉林大学学报(医学版), 2019, 45(04): 893-898
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 893-898
- 10.13481/j.1671-587x.20190426
-
文章历史
- 收稿日期: 2018-10-29
2. 锦州医科大学附属第一医院肿瘤血管与微环境实验室, 辽宁 锦州 121000;
3. 锦州医科大学生物人类学研究所, 辽宁 锦州 121000
2. Tumor Angiogenesis and Microenvironment Laboratory, First Affiliated Hospital, Jinzhou Medical University, Jinzhou 121000, China;
3. Biological Anthropology Institute, Jinzhou Medical University, Jinzhou 121000, China
结肠癌是世界上第三大最常见的癌症,在亚洲国家结直肠癌的发病率呈上升趋势。NAD依赖性蛋白脱乙酰基酶sirtuin-6(NAD-dependent deacetylase sirtuin-6,SIRT6)是沉默配型信息调节蛋白家族(silent mating type information regulation 2 homolog,SIRTs) SIRT1~SIRT7中的一员。SIRT6同时具有去乙酰化酶活性和核糖基转移酶活性,参与调控了众多生命过程。SIRT6能通过多途径提高DNA损伤修复能力,提高端粒稳定性[1-2]。SIRT6通过核因子活化B细胞κ轻链增强子(NF-κB)及其下游基因来调控细胞衰老[3-4]。SIRT6可作为重要的葡萄糖稳态调控因子[5-6],还可调控心血管以及脂肪肝等代谢疾病,在一定程度上可能起到延长寿命的作用[7-9]。近年来研究[10-11]表明:SIRT6可调节肿瘤发生、增殖和代谢,但其在不同肿瘤中的作用结果及其机制并不相同。目前,SIRT6蛋白在结肠癌组织中表达及其与患者临床病理参数关系和对预后影响的报道较少,并且结果并不一致。本研究利用结肠癌组织芯片技术检测SIRT6蛋白在结肠癌患者结肠癌组织中的表达,探讨SIRT6蛋白表达与结肠癌患者临床病理参数及预后的关系。
1 资料与方法 1.1 一般资料结肠癌组织芯片(HColA180Su09)购自上海芯超生物科技有限公司,来自100例结肠癌患者(其中80例癌组织具有相应的癌旁组织),男性54例,女性43例,3例性别不详(丢失性别信息),年龄24~90岁,行原发性结肠癌根治手术时间为2000—2008年。所有患者术前均未行放化疗, 诊断均经术后病理结果证实,其中部分患者临床资料缺失(5例年龄不详,5例肿瘤大小不详,2例TNM分期不详,14例T分期不详,2例N分期不详)。纳入本研究的实验数据为诊断明确的结肠癌病例及免疫组织化学检测产生的原始数据,死于无关病因的患者均未纳入本研究。结肠癌组织和癌旁组织均经10%甲醛固定,石蜡包埋,于4℃冰箱中保存。
1.2 免疫组织化学染色检测结肠癌和癌旁组织中SIRT6蛋白表达石蜡切片常规脱蜡至水,柠檬酸缓冲液抗原修复,PBS洗涤5min×3次,3%过氧化氢孵育10 min封闭内源性过氧化氢酶,滴加SIRT6抗体1:200稀释,4℃过夜,PBS洗涤5min×3次,加入辣根过氧化物酶标记的二抗,DAB显色,用流水终止,苏木精复染、脱水、透明、树脂封片,拍照。其中3例样本脱片,数据排除。SIRT6蛋白在细胞质和细胞核中均表达,以抗体出现棕黄色或棕褐色颗粒判定为阳性反应,对结果进行半定量分析评分和分组。染色强度评分:0分(阴性),1分(+),2分(

采用SPSS 17.0统计软件进行统计学分析。结肠癌和癌旁组织中SIRT6蛋白表达水平以均值表示,资料为非正态分布,采用非参数统计中的秩和检验进行分析。结肠癌患者癌组织中SIRT6蛋白表达水平与结肠癌患者临床病理参数的关联性分析采用秩和检验,生存曲线分析采用Kaplan-Meier法,单因素生存分析采用Log-rank检验,多因素生存分析采用Cox风险回归模型。以P < 0.05为差异有统计学意义。
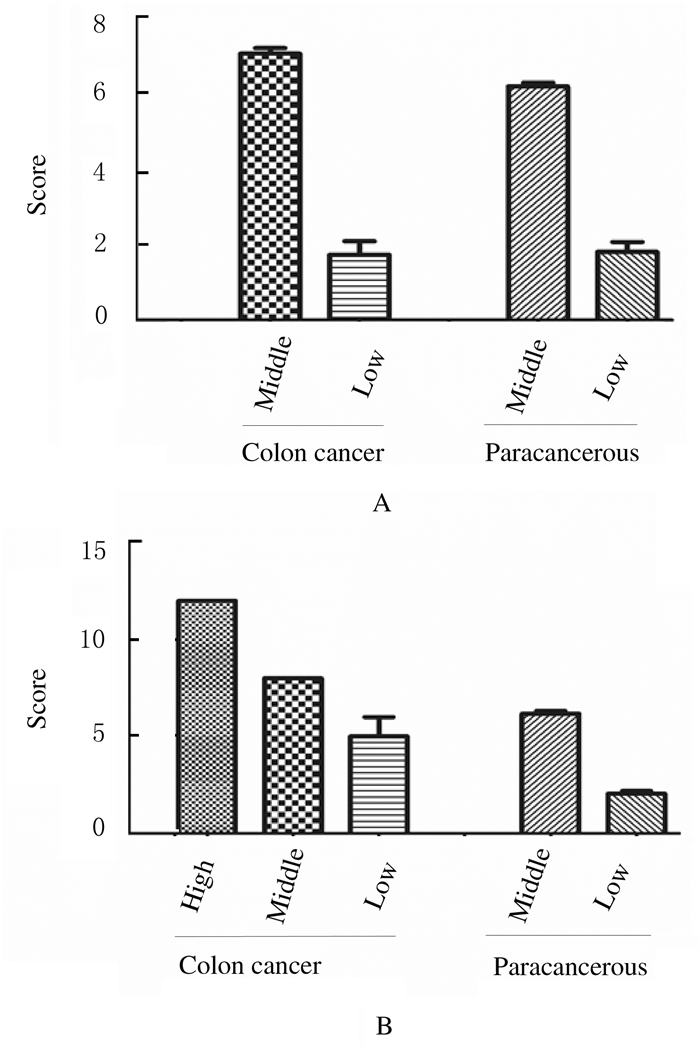
2 结果 2.1 SIRT6蛋白在结肠癌组织和癌旁组织中的表达水平SIRT6蛋白表达的组织芯片,180个位点结构保存完好,双芯布阵,排列整齐,免疫组织化学染色效果较好,无明显坏死组织,阳性染色呈棕黄色颗粒,SIRT6蛋白在细胞核和细胞质中均有阳性表达,见图 1(插页七)。有3例组织脱片,77例结肠癌及其癌旁组织染色结果评分后进行秩和检验。SIRT6蛋白在细胞核中的表达情况:结肠癌组织中表达组SIRT6表达水平评分为7.04,低表达组SIRT6表达水平评分为1.73;癌旁组织中中表达组SIRT6表达水平评分为6.17,低表达组SIRT6表达水平评分为1.80;与癌旁组织比较结肠癌组织细胞核中SIRT6表达水平差异有统计学意义(Z=-4.603,P=0.000)。SIRT6蛋白在细胞质中的表达情况:结肠癌组织高表达组SIRT6表达水平评分为12.00,中表达组SIRT6表达水平评分为8.00,低表达组SIRT6表达水平评分为1.80;癌旁组织中表达组SIRT6表达水平为6.16,低表达组SIRT6表达水平评分为2.05;结肠癌组织细胞质中SIRT6表达水平与癌旁组织比较差异有统计学意义(Z=-7.610, P=0.000)。见图 2。

|
| A:Cytoplasm; B:Nucleus; C:Paracancerous tissue. 图 1 结肠癌患者癌组织(A,B)和癌旁组织(C)中STRT6蛋白表达(免疫组织化学,×200) Fig. 1 Expressions of STRT6 protein in cancer tissue(A, B) and paracancerous tissue(C) of colon cancer patients(Immunohistochemistry, ×200) |
|
|
|
| A:Nucleus; B:Cytoplasm. 图 2 结肠癌组织和癌旁组织中SIRT6蛋白表达水平 Fig. 2 Expression levels of SIRT6 protein in colon cancer and paracancerous tissues |
|
|
SIRT6蛋白在结肠癌组织细胞浆和细胞核中表达水平分别与患者性别、肿瘤大小、病理分级、T分期、N分期、M分期、TNM分期等临床指标进行了秩和检验分析, 结果显示:结肠癌组织SIRT6蛋白的表达水平与结肠癌患者不同临床病理参数之间均无关联(P>0.05)。见表 1。
| Parameter | n | Expression of SIRT6(nucleus) | Z | P | Expression ofSIRT6(cytoplasm) | Z | P | ||||
| High | Middle | Low | High | Middle | Low | ||||||
| Gender | |||||||||||
| Male Female |
53 43 |
0 0 |
40 35 |
13 8 |
-0.695 | 0.487 | 21 12 |
31 31 |
1 0 |
-1.113 | 0.266 |
| Age(year) | |||||||||||
| >65 ≤65 |
58 34 |
0 0 |
46 25 |
12 9 |
-0.634 | 0.526 | 21 13 |
37 20 |
0 1 |
-0.014 | 0.989 |
| Tumor size(d/cm) | |||||||||||
| >5 ≤5 |
56 36 |
0 0 |
45 28 |
11 8 |
-0.297 | 0.767 | 22 11 |
33 25 |
1 0 |
-0.720 | 0.471 |
| Pathological classification | |||||||||||
| Ⅰ-Ⅱ Ⅲ |
49 48 |
0 0 |
40 36 |
9 12 |
-0.630 | 0.528 | 20 15 |
29 32 |
0 1 |
-1.092 | 0.275 |
| TNM stage | |||||||||||
| TNM1-2 TNM3-4 |
58 37 |
0 0 |
46 30 |
12 7 |
-0.209 | 0.834 | 21 13 |
37 24 |
0 0 |
-0.106 | 0.916 |
| T stage | |||||||||||
| T1-T3 T4 |
69 14 |
0 0 |
64 9 |
5 5 |
-1.396 | 0.163 | 17 7 |
52 7 |
0 0 |
-1.066 | 0.286 |
| N stage | |||||||||||
| N0 N1-N2 |
58 37 |
0 0 |
46 29 |
12 8 |
-0.108 | 0.914 | 21 13 |
37 24 |
0 0 |
-0.106 | 0.916 |
| M stage | |||||||||||
| M0 M1 |
94 3 |
0 0 |
74 2 |
20 1 |
0.691 | 0.746 | 32 2 |
61 1 |
1 0 |
0.245 | 0.349 |
Kapla-Meier生存曲线显示:SIRT6蛋白在细胞核中高表达,年龄小,TNM分期低,T、N和M分期低的患者预后更好,见图 3。单因素Log-rank分析显示:结肠癌患者年龄、TNM分期、T分期、N分期、M分期和SIRT6在细胞核中的表达与预后有关联(P < 0.05)(表 2)。对100例结肠癌患者随访8~9年,39例生存,61例死亡,无失访。对单因素分析中差异有统计学意义的变量纳入COX多因素生存回归分析,结果显示:患者年龄、T分期、N分期和SIRT6蛋白在细胞核中高表达与患者预后有关联(P < 0.05),年龄小、T和N分期低及SIRT6蛋白在细胞核中高表达的结肠癌患者预后更好,可能是独立的预后因子,而SIRT6在细胞质中高表达与结肠癌患者的生存率无关联(P>0.05)。见表 2。

|
| A: SIRT6 protein(nucleus); B:Age; C:TNM stage; D:T stage; E:N stage; F:M stage. 图 3 结肠癌患者的Kapplan-Meier生存曲线 Fig. 3 Kapplan-Meier survival curves of colon cancer patients |
|
|
| Parameter | n | Univariate regression | Multivariate regression | |||||
| HR | 95%CI | P | HR | 95%CI | P | |||
| Gender | ||||||||
| Male Female |
53 43 |
1.056 | 0.635-1.757 | 0.834 | - | - | - | |
| Age(year) | ||||||||
| >65 ≤65 |
58 34 |
0.520 | 0.304-0.887 | 0.016 | 0.394 | 0.210-0.738 | 0.004 | |
| Tumor size(d/cm) | ||||||||
| >5 ≤5 |
56 36 |
1.160 | 0.698-1.928 | 0.566 | - | - | - | |
| Pathological classification | ||||||||
| Ⅰ Ⅱ Ⅲ |
2 47 48 |
1.586 | 0.980-2.567 | 0.060 | - | - | - | |
| TNM stage | ||||||||
| TNM1 TNM2 TNM3 TNM4 |
5 53 34 3 |
2.657 | 1.687-4.185 | 0.000 | 1.028 | 0.336-3.143 | 0.961 | |
| T stage | ||||||||
| T1-T2 T3 T4 |
6 63 14 |
2.006 | 1.147-3.507 | 0.015 | 2.301 | 1.202-4.404 | 0.012 | |
| N stage | ||||||||
| N0 N1 N2 |
58 27 10 |
2.197 | 1.547-3.119 | 0.000 | 2.423 | 1.008-5.825 | 0.048 | |
| M stage | ||||||||
| M0 M1 |
94 3 |
13.540 | 3.803-48.203 | 0.000 | 4.506 | 0.929-21.86 | 0.062 | |
| SIRT6 (nucleus) | ||||||||
| Middle expression Low expression |
69 28 |
2.302 | 1.307-4.054 | 0.004 | 2.345 | 1.270-4.328 | 0.006 | |
| SIRT6 (cytoplasm) | ||||||||
| High expression Middle expression |
34 63 |
1.309 | 0.759-2.260 | 0.333 | - | - | - | |
| “-”:No data. | ||||||||
SIRT6是哺乳动物体内Ⅲ类组蛋白去乙酰化酶Sirtuins家族的成员,是最早在酵母中发现的衰老相关基因SIR2的同源基因。SIRT6主要定位在细胞核, 其基因定位于19号染色体短臂13.3区带, 蛋白质分子全长355个氨基酸,相对分子质量约为39100,等电点9.12。SIRT6在人皮肤癌中表达上调, 与正常小鼠比较,表皮SIRT6消融小鼠肿瘤减小,表明SIRT6的缺失抑制皮肤肿瘤的发生[12-13]。在前列腺癌和肝癌中,也有SIRT6蛋白较正常组织表达更高的报道[14-16],SIRT6下调和SIRT6缺失调控的基因在肝癌发生中具有致癌作用[17]。而在人非小细胞肺癌组织和细胞系中SIRT6 mRNA和蛋白水平降低,SIRT6过度表达可抑制NSCLC细胞的增殖[18],SIRT6表达下调可促进NSCLC恶性肿瘤的发生[19],SIRT6蛋白高表达患者的3年生存率高于SIRT6低表达者[20]。SIRT6通过抑制JAK2/STAT3途径抑制胃癌的生长[21]。在子宫内膜癌中SIRT6起到抗肿瘤作用[22]:与正常组织比较,卵巢癌组织中SIRT6表达水平明显降低,SIRT6的过度表达抑制卵巢癌细胞SKOV3和OVCAR3的增殖;相反,下调SIRT6表达可增强卵巢癌细胞的生长[23]。可见SIRT6在不同肿瘤中的表现不完全相同,可能是由SIRT6的组织特异性所决定。
本研究结果表明:SIRT6蛋白在结肠癌组织中主要表达在细胞核和细胞质中,在结肠癌组织中的表达高于癌旁组织,说明SIRT6蛋白与结肠癌发生发展可能存在联系。结肠癌组织中SIRT6蛋白在细胞质和细胞核中的表达水平,与患者性别、肿瘤大小、病理分级、T分期、N分期、M分期和临床分期等临床指标之间均无关联。本研究中单因素分析显示:患者年龄、临床分期、T分期、N分期、M分期和SIRT6在细胞核中的表达水平与患者的预后有关联;生存曲线分析显示:SIRT6蛋白在细胞核高表达、患者年龄小、临床分期低和T、N、M分期低的患者生存时间明显升高;多因素分析显示:SIRT6在细胞核中高表达、年龄小和T、N分期低的结肠癌患者预后好,而且是独立预后因子,而SIRT6在胞浆中的表达水平与结肠癌患者的总生存率无关联。
综上所述,SIRT6蛋白在结肠癌组织的表达主要定位于细胞核和细胞质中。SIRT6蛋白在结肠癌组织表达水平明显高于癌旁组织。SIRT6在细胞核中高表达、年龄小和T分期低的结肠癌患者预后好,而且是独立预后因子。结肠癌组织中SIRT6蛋白的表达对患者生存具有重要的评估作用,SIRT6蛋白可能是结肠癌的生物学标志物,本研究结果为结肠癌患者的预后评估提供了新的思路。
| [1] | GERTLER A A, COHEN H Y. SIRT6, a protein with many faces[J]. Biogerontology, 2013, 14(6): 629–639. DOI:10.1007/s10522-013-9478-8 |
| [2] | MICHISHITA E, MCCORD R A, BERBER E, et al. SIRT6 is a histone H3 lysine 9 deacetylase that modulates telomeric chromatin[J]. Nature, 2008, 452(7186): 492–496. DOI:10.1038/nature06736 |
| [3] | KAWAHARA T L, MICHISHITA E, ADLER A S, et al. SIRT6 links histone H3 lysine 9 deacetylation to NF-kappaB-dependent gene expression and organismal life span[J]. Cell, 2009, 136(1): 62–74. |
| [4] | TANG Y L, ZHOU Y, WANG Y P, et al. SIRT6/NF-kappa B signaling axis in ginsenoside Rg1-delayed hematopoietic stem/progenitor cell senescence[J]. Int J Clin Exp Pathol, 2015, 8(5): 5591–5596. |
| [5] | KUGEL S, MOSTOSLAVSKY R. Chromatin and beyond:the multitasking roles for SIRT6[J]. Trends Biochem Sci, 2014, 39(2): 72–81. DOI:10.1016/j.tibs.2013.12.002 |
| [6] | ZHONG L, D'URSO A, TOIBER D, et al. The histone deacetylase Sirt6 regulates glucose homeostasis via Hif1 alpha[J]. Cell, 2010, 140(2): 280–293. |
| [7] | CARDUS A, URYGA A K, WALTERS G, et al. SIRT6 protects human endothelial cells from DNA damage, telomere dysfunction, and senescence[J]. Cardiovasc Res, 2013, 97(3): 571–579. DOI:10.1093/cvr/cvs352 |
| [8] | KANFI Y, PESHTI V, GIL R, et al. SIRT6 protects against pathological damage caused by diet-induced obesity[J]. Aging Cell, 2010, 9(2): 162–173. |
| [9] | LIAO C Y, KENNEDY B K. Will the real aging Sirtuin please stand up?[J]. Cell Res, 2012, 22(8): 1215–1217. DOI:10.1038/cr.2012.62 |
| [10] | SHUN C T, LIN S K, HONG C Y, et al. Sirtuin 6 modulates hypoxia-induced autophagy in nasal polyp fibroblasts via inhibition of glycolysis[J]. Am J Rhinol Allergy, 2016, 30(3): 179–185. DOI:10.2500/ajra.2016.30.4282 |
| [11] | SEBASTIÁN C, ZWAANS B M, SILBERMAN D M, et al. The histone deacetylase SIRT6 is a tumor suppressor that controls cancer metabolism[J]. Cell, 2012, 151(6): 1185–1199. DOI:10.1016/j.cell.2012.10.047 |
| [12] | GARCIA-PETERSON L M, NDIAYE M A, Singh C K, et al. SIRT6 histone deacetylase functions as a potential oncogene in human melanoma[J]. Genes Cancer, 2017, 8(9/10): 701–712. |
| [13] | MING M, HAN W N, ZHAO B Z, et al. SIRT6 promotes COX-2 expression and acts as an oncogene in skin cancer[J]. Cancer Res, 2014, 74(20): 5925–5933. DOI:10.1158/0008-5472.CAN-14-1308 |
| [14] | LIU Y W, XIE Q R, WANG B S, et al. Inhibition of SIRT6 in prostate cancer reduces cell viability and increases sensitivity to chemotherapeutics[J]. Protein Cell, 2013, 4(9): 702–710. DOI:10.1007/s13238-013-3054-5 |
| [15] | LEE N, RYU H G, KWON J H, et al. SIRT6 depletion suppresses tumor growth by promoting cellular senescence induced by DNA damage in HCC[J]. PLoS One, 2016, 11(11): e0165835. DOI:10.1371/journal.pone.0165835 |
| [16] | RAN L K, CHEN Y, ZHANG Z Z, et al. SIRT6 overexpression potentiates apoptosis evasion in hepatocellular carcinoma via BCL2-associated X protein-dependent apoptotic pathway[J]. Clin Cancer Res, 2016, 22(13): 3372–3382. DOI:10.1158/1078-0432.CCR-15-1638 |
| [17] | MARQUARDT J U, FISCHER K, BAUS K, et al. Sirtuin-6-dependent genetic and epigenetic alterations are associated with poor clinical outcome in hepatocellular carcinoma patients[J]. Hepatology, 2013, 58(3): 1054–1064. DOI:10.1002/hep.26413 |
| [18] | HAN Z J, LIU L, LIU Y X, et al. Sirtuin SIRT6 suppresses cell proliferation through inhibition of Twist1 expression in non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2014, 7(8): 4774–4781. |
| [19] | ZHU B J, YAN Y J, SHAO B Y, et al. Downregulation of SIRT6 is associated with poor prognosis in patients with non-small cell lung cancer[J]. J Int Med Res, 2018, 46(4): 1517–1527. DOI:10.1177/0300060517750298 |
| [20] | CHEN T, SUN Z J, LIU F L, et al. RASSF1A and SIRT6 in non-small cell lung cancer:Relationship with clinical outcome[J]. Oncol Lett, 2017, 14(5): 5759–5764. |
| [21] | ZHOU J M, WU A, YU X T, et al. SIRT6 inhibits growth of gastric cancer by inhibiting JAK2/STAT3 pathway[J]. Oncol Rep, 2017, 38(2): 1059–1066. DOI:10.3892/or.2017.5753 |
| [22] | FUKUDA T, WADA-HIRAIKE O, ODA K, et al. Putative tumor suppression function of SIRT6 in endometrial cancer[J]. FEBS Lett, 2015, 589(17): 2274–2281. DOI:10.1016/j.febslet.2015.06.043 |
| [23] | ZHANG J, YIN X J, XU C J, et al. The histone deacetylase SIRT6 inhibits ovarian cancer cell proliferation via down-regulation of Notch 3 expression[J]. Eur Rev Med Pharmacol Sci, 2015, 19(5): 818–824. |
 2019, Vol. 45
2019, Vol. 45


