扩展功能
文章信息
- 张莹莹, 闫媛媛, 史海宏
- ZHANG Yingying, YAN Yuanyuan, SHI Haihong
- 斑点追踪超声心动图在心肌梗死模型大鼠检查中的应用及其意义
- Application of speckle tracing echocardiography in examination of rat models of myocardial infarction and its significance
- 吉林大学学报(医学版), 2019, 45(04): 882-886
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 882-886
- 10.13481/j.1671-587x.20190424
-
文章历史
- 收稿日期: 2018-09-10
心肌梗死是一类由于冠状动脉缺血缺氧引起心肌坏死、最终导致猝死(急性)和心肌重塑(慢性)的疾病,严重威胁人类生命,影响患者生活质量[1-2]。二维斑点追踪超声心动图具有较高的时间和空间分辨力, 无声束角度和帧频依赖性, 可对任何超声切面进行分析,可以评价运动心肌在纵向、径向与环向上的形变特征, 在心肌梗死的诊断中可用于心肌功能的评价[3-4]。但斑点追踪超声心动图在心肌梗死大鼠模型中的应用和依据尚不十分清楚且报道较少,本文作者通过建立大鼠心肌梗死模型,探讨斑点追踪超声心动图在大鼠心肌梗死模型诊断中的应用价值,为后续心肌梗死模型的成功建模提供依据,同时为临床心肌梗死的判断提供理论依据。
1 材料与方法 1.1 实验动物健康清洁级SD大鼠50只,雄性,体质量230~260g,购自北京金牧阳实验动物养殖有限责任公司,动物许可证号:SYXK(京)2014-0017。
1.2 大鼠分组和心肌梗死模型的建立50只大鼠随机分为模型组和假手术组,每组25只。模型组大鼠术中因麻醉意外死亡6只,假手术组大鼠因麻醉意外死亡5只。模型组大鼠采用水合氯醛麻醉成功后进行气管插管,连接动物呼吸机,刮净左侧胸部皮肤,消毒后于胸骨左缘0.5cm处切开皮肤,分离皮下组织和肌肉,从第四肋间开胸,暴露大鼠心脏,在大鼠左心耳下缘下方1mm处进针、在左冠状动脉前降支后方穿过手术丝线,丝线一端穿过聚乙烯管,收紧丝线压迫左前降支,造成缺血,结扎线松开行再灌注,结扎线收紧后前降支支配区域心肌发绀或颜色变苍白为结扎成功,缺血/再灌注预处理为结扎5min、恢复灌注5min,共2次,然后结扎30min,恢复24h[5]。假手术组大鼠仅在左冠状动脉前降支后方绕线但不结扎。
1.3 超声心动图检查大鼠建模前和建模后均行超声心动图检查。大鼠左侧卧位,采用Vivid-iTM超声系统(美国GE公司,型号Vivid E9)进行扫描,探头频率为10MHz,深度为2.5 cm。根据心电图R-R间隔计算大鼠心率(HR)和左心室射血分数(EF)。
1.4 斑点追踪超声心动图检查采用STE程序(美国GE公司,型号EchoPAC Dimension’ 08)将超声心动图扫描的左心室乳头肌短轴切片结果进行后续处理,测量前间隔、前壁、前侧壁、后壁、后侧壁和后间隔6个阶段心肌的环向应变(circumferential strain,CS)和径向应变(radial strain,RS),计算各阶段的CS峰值、收缩期CS峰值和到达CS峰值时间(timetopeak ofCS,TTP),TTP为每个阶段从第一次舒张末期到CS峰值的持续时间(单位为ms),标准化TTP为TTP时间占心脏周期总时间的百分比。
1.5 Masson染色观察大鼠心脏组织形态表现实验结束后颈椎离断处死大鼠,取心脏组织,置于多聚甲醛中过夜固定,沿心脏梗死区短轴剖开心脏,常规进行脱水、浸蜡包埋,切4μm厚组织切片,采用Masson染色,光镜下观察心肌梗死区位置及染色情况。采用ImageProplus图像分析系统测量并计算心肌梗死面积百分率。心肌梗死面积百分率=梗死区面积/(梗死区面积+缺血区面积)×100%。
1.6 统计学分析采用SPSS 20.0统计软件进行统计学分析。大鼠的HR、EF及心脏前间隔、前壁、前侧壁、后壁、后侧壁、后间隔心肌CS、RS和TTP以x±s表示,采用Kolmogorov-Smirnov检验对资料进行正态性检验,正态分布的计量资料组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组大鼠EF和HR与假手术组比较,模型组大鼠EF明显降低(P < 0.05),HR差异无统计学意义(P>0.05)。见表 1。
| (x±s) | |||
| Group | n | EF(η/%) | HR(min-1) |
| Sham operation | 20 | 91.84±1.77 | 261.92±14.25 |
| Model | 19 | 85.37±1.64* | 266.32±15.39 |
| *P < 0.05 compared withsham operation group. | |||
与假手术组比较,模型组大鼠前间隔、前壁和前侧壁CS峰值均明显降低(P < 0.05),后壁、后侧壁和后间隔CS峰值差异无统计学意义(P>0.05)。见表 2。
| (x±s, η/%) | |||||||
| Group | n | CS peak | |||||
| Front interval | Front wall | Front side wall | Back wall | Rear side wall | After interval | ||
| Sham operation | 20 | -18.96±1.87 | -20.15±1.84 | -20.57±1.96 | -15.83±1.64 | -16.65±1.54 | -16.51±1.47 |
| Model | 19 | -15.13±1.93* | -13.24±1.63* | -13.82±2.84* | -15.38±1.14 | -16.24±1.48 | -17.22±1.38 |
| *P < 0.05compared withsham operation group. | |||||||
与假手术组比较,模型组大鼠心脏前间隔、前壁和前侧壁收缩期CS峰值均明显降低(P < 0.05),心脏后壁、后侧壁和后间隔收缩期CS峰值差异无统计学意义(P>0.05)。见表 3。
| (x±s, η/%) | |||||||
| Group | n | Systolic CS peaks | |||||
| Front interval | Front wall | Front side wall | Back wall | Rear side wall | After interval | ||
| Sham operation | 20 | -18.35±2.54 | -17.96±2.31 | -19.06±2.35 | -17.05±1.86 | -16.84±2.35 | -16.79±2.46 |
| Model | 19 | -14.75±2.62* | -12.75±2.14* | -12.13±2.04* | -16.13±1.79 | -16.31±2.18 | -17.23±2.28 |
| *P < 0.05compared withsham operation group. | |||||||
与假手术组比较,模型组大鼠心脏前壁RS明显降低(P < 0.05),心脏前间隔、前侧壁、后壁、后侧壁和后间隔RS差异无统计学意义(P>0.05)。见表 4。
| (x±s, η/%) | |||||||
| Group | n | RS | |||||
| Front interval | Front wall | Front side wall | Back wall | Rear side wall | After interval | ||
| Sham operation | 20 | 33.73±4.98 | 33.53±4.94 | 33.57±5.24 | 32.83±5.02 | 32.15±4.96 | 32.16±5.02 |
| Model | 19 | 31.15±3.19 | 21.46±3.72* | 32.64±4.58 | 32.24±4.51 | 32.08±4.32 | 31.24±4.67 |
| *P < 0.05 compared withsham operation group. | |||||||
与假手术组比较,模型组大鼠心脏前壁标准化TTP明显升高(P < 0.05),心脏前间隔、前侧壁、后壁、后侧壁和后间隔标准化TTP差异无统计学意义(P>0.05)。见表 5。
| (x±s, η/%) | |||||||
| Group | n | Front interval | Front wall | Front side wall | Back wall | Rear side wall | After interval |
| Sham operation | 20 | 0.38±0.09 | 0.36±0.08 | 0.38±0.09 | 0.38±0.10 | 0.34±0.10 | 0.36±0.10 |
| Model | 19 | 0.42±0.10 | 0.47±0.12* | 0.36±0.10 | 0.37±0.08 | 0.35±0.11 | 0.38±0.07 |
| *P < 0.05compared withsham operation group. | |||||||
Masson染色检测结果显示:假手术组大鼠心肌组织形态表现正常,未见梗死灶;模型组大鼠心肌组织梗死面积百分率为(4.52± 1.41)%,梗死部位均位于心脏前壁,为小面积心肌细胞病变(图 1,见插页七)。
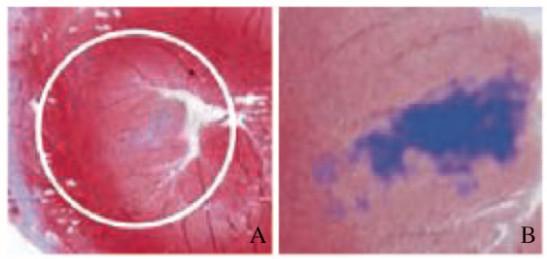
|
| A:×4;B:×20.The infarction area was the blue staining area. 图 1 模型组大鼠心肌组织Masson染色结果 Fig. 1 Results of Masson staining of myocardium tissue of rats in model group |
|
|
急性心肌梗死是严重危害人类生命和健康的疾病之一,在心肌梗死的治疗中降低心肌梗死的病死率是判断治疗效果的重要指标,因此早期发现心肌梗死并及时限制和缩小心肌梗死面积对降低心肌梗死病死率具有重要意义[6]。随着诊断技术水平的提高,区域性心肌梗死根据临床表现、心电图的特征性变化和血清心肌酶等可作出正确诊断[7-8];对于急性心肌梗死诊断较为困难,急性心肌梗死时心肌损伤从心内膜层心肌向心外膜层心肌发展(波前效应), 导致心肌梗死后心内膜层心肌至心外膜层心肌的跨壁力学状态发生了变化, 而心肌环向应变参数能敏感地反映这种病理变化。此外, 心内膜层心肌的CS是心外膜层心肌的2倍[9-10]。
临床常用的心电图和血清心肌酶等检查在心肌梗死面积和透壁程度判断方面具有局限性,组织学TTC染色是评价梗死心肌面积的“金标准”,但在临床工作中通过组织染色测量心肌梗死面积不切实际;增强核磁共振延迟扫描可较好地判断心肌梗死面积、部位和透壁程度,但其时间和空间分辨率低,且价格昂贵,未在临床上广泛应用。因此选择准确、简单的诊断心肌梗死的方法非常必要,超声心动图具有重复性好、无创和廉价等优点,是评价心功能的重要方法[11],斑点追踪技术是指在二维超声心动图图像的基础上根据组织灰阶追踪感兴趣区内不同像素心肌组织在图像中的位置,计算各节段心肌的变形情况,准确检测心脏的圆周、纵向和径向运动,可以更准确、全面评价心肌运动[12],在心肌梗死诊断中被广泛应用[13-14]。
斑点追踪超声心动图在大鼠心肌梗死模型中的诊断价值尚不十分清楚。缺血预处理可减少大鼠心肌梗死面积[15-17],本文作者采用缺血预处理建立大鼠心肌梗死模型,结果显示:模型大鼠梗死面积百分率为(4.52±1.41)%,均位于心脏前壁,为小面积心肌组织病变;对其进行斑点追踪超声心动图检查显示:模型组大鼠EF和CS降低,心脏前间隔、前壁和前侧壁CS峰值、收缩期CS峰值降低,前壁RS降低,标准化TTP升高。本研究结果表明:心肌梗死因梗死灶小,被周围组织包围,周围心肌组织可能仍能正常收缩,在梗死早期,周围正常收缩的心肌组织在心脏收缩期间向内拉动梗死组织,从而使梗死区域看起来收缩正常,使其在常规检测中难以被检测到[18];心肌梗死大鼠心脏斑点追踪超声心动图的CS峰值和收缩期CS峰值在心肌梗死区域及附近区域均降低,考虑心肌梗死的梗死区域及收缩过程中向内拉动梗死组织的周围心肌区域可被斑点追踪超声心动图的CS峰值、收缩期CS峰值检测到,但CS峰值、收缩期CS峰值无法区分心肌梗死区域和其周围向内拉动梗死组织的心肌区域;RS和TTP在心肌梗死区域降低,在心肌梗死组织周围向内拉动梗死组织的心肌区域无明显变化,RS和TTP可区分心肌梗死区域及其周围向内拉动梗死组织的心肌区域,在心肌梗死的诊断中具有重要意义[19-21]。
综上所述,大鼠发生心肌梗死时,斑点追踪超声心动图的CS峰值、收缩期CS峰值、RS和TTP均发生改变,RS和TTP在区分心肌梗死区域及其周围心肌组织中具有重要意义,可作为后续鉴定心肌梗死大鼠模型成功的指标之一。
| [1] | 胡贵珍. 急性心肌梗死中西医结合诊疗分析[J]. 光明中医, 2017, 32(2): 266–267. DOI:10.3969/j.issn.1003-8914.2017.02.049 |
| [2] | 陈可冀, 史大卓. 冠心病及急性心肌梗死中医临床辨证标准及防治指南[M]. 北京: 人民卫生出版社,2014: 50. |
| [3] | ZHU WH, LIU WG, TONG Y, et al. Three-dimensional speckle tracking echocardiography for the evaluation of the infarct size and segmental transmural involvement in patients with acute myocardial infarction[J]. Echocardiography, 2014, 31(1): 58–66. |
| [4] | WANG QS, ZHANG CH, HUANG DS, et al. Evaluation of myocardial infarction size with three-dimensional speckle trackingechocardiography:a comparison with single photon emission computed tomography[J]. Int J Cardiovasc Imaging, 2015, 31(8): 1571–1581. DOI:10.1007/s10554-015-0745-4 |
| [5] | 罗子娟.急性心肌梗死后早期不同阶段行非体外循环冠状动脉旁路移植术的效果比较[D].石家庄: 河北大学, 2018. |
| [6] | GRAF T, DESCH S, EITEL I, et al. Acute myocardial infarction and cardiogenic shock:pharmacologic and mechanical hemodynamic support pathways[J]. Coron Artery Dis, 2015, 26(6): 535–544. DOI:10.1097/MCA.0000000000000259 |
| [7] | SHAH A S, MCALLISTER D A, MILLS R, et al. Sensitive troponin assay and the classification ofmyocardial infarction[J]. Am J Med, 2015, 128(5): 493–501.e3. DOI:10.1016/j.amjmed.2014.10.056 |
| [8] | DALE O. Myocardial infarction in the wilderness of Peru[J]. Tidsskr Nor Laegeforen, 2015, 135(11): 1051–1053. DOI:10.4045/tidsskr.15.0045 |
| [9] | 娄梅琴, 汪芳. 长时间动态心电图对心肌梗死后心律失常的监测价值[J]. 中国心脏起搏与心电生理杂志, 2018, 11(6): 1–4. |
| [10] | 杨发春, 王才飞, 孙志刚, 等. 缺血后适应在急性心肌梗死介入治疗中对梗死面积及心功能的影响研究[J]. 当代医学, 2018, 3(32): 100–102. DOI:10.3969/j.issn.1009-4393.2018.32.042 |
| [11] | JANKAUSKIEN E, ORDA P, RUMBINAIT E, et al. Left ventricular function by speckle-tracking echocardiography in patients with low-T3 syndrome and acute myocardial infarction[J]. Medicina (Kaunas), 2015, 51(4): 209–216. DOI:10.1016/j.medici.2015.07.004 |
| [12] | HABERKA M, LISZKA J, KOZYRA A, et al. Two-dimensional speckle tracking echocardiography prognostic parameters in patients after acute myocardial infarction[J]. Echocardiography, 2015, 32(3): 454–460. DOI:10.1111/echo.12666 |
| [13] | 何昌颖, 方北, 徐云峰, 等. 探讨斑点追踪成像评价心肌梗塞室壁节段运动二维应变的应用价值[J]. 现代医用影像学, 2017, 26(06): 1801–1803. |
| [14] | JOYCE E, HOOGSLAG GE, AL AMRI I, et al. quantitative dobutamine stress echocardiography using speckle-tracking analysis versus conventional visual analysis for detection of significant coronary artery disease after ST-segment elevation myocardial infarction[J]. J Am Soc Echocardiogr, 2015, 28(12): 1379–1389. DOI:10.1016/j.echo.2015.07.023 |
| [15] | 李佳妮, 李嘉欣, 颜金鹏, 等. 缺血预处理对小鼠心肌缺血再灌注损伤的保护作用研究[J]. 生命科学研究, 2017, 21(2): 111–116. |
| [16] | 韩莹, 敖梦, 王志刚. 二维斑点追踪成像技术评价左心室功能的研究进展[J]. 中国介入影像与治疗学, 2017, 14(7): 448–451. |
| [17] | 许怀刚, 仲其飞. 二维斑点追踪成像与超声心动图在评估左心室功能中的临床比较[J]. 湖南师范大学学报:医学版, 2018, 15(4): 177–181. |
| [18] | 曾丽琴, 张军, 拓胜军, 等. 二维斑点追踪成像技术评价早期单纯性肥胖大鼠左心室收缩功能[J]. 中国医学影像技术, 2018, 34(4): 481–485. |
| [19] | PASHAKHANLOO F, HERZKA D A, ASHIKAGA H, et al. Myofiber architecture of the human atria as revealed by submillimeter diffusion tensor imaging[J]. Circ Arrhythm Electrophysiol, 2016, 9(4): e004133. |
| [20] | PATHAN F, D'ELIA N, NOLAN M T, et al. Normal ranges of left atrial strainby speckle-tracking echocardiography:a systematic review andMeta-analysis[J]. J Am Soc Echocardiography, 2017, 30(1): 59–70. |
| [21] | 黄红艳, 吴碧君, 崔楠, 等. 三维斑点追踪成像对不同程度冠状动脉狭窄患者左心室局部功能评价及冠心病诊断价值分析[J]. 中国医学物理学杂志, 2017, 34(6): 598–602. DOI:10.3969/j.issn.1005-202X.2017.06.012 |
 2019, Vol. 45
2019, Vol. 45


