扩展功能
文章信息
- 岳胜, 乔国华, 岳磊, 朱平
- YUE Sheng, QIAO Guohua, YUE Lei, ZHU Ping
- 小檗碱通过ROS/JNK信号通路对AngⅡ诱导的人脐静脉血管内皮细胞凋亡的抑制作用及其机制
- Inhibitory effect of berberine on Ang Ⅱ-induced apoptosis of human umbilical vein endothelial cells via ROS/JNK signaling pathway and its mechanism
- 吉林大学学报(医学版), 2019, 45(04): 872-876
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 872-876
- 10.13481/j.1671-587x.20190422
-
文章历史
- 收稿日期: 2018-10-29
血管内皮细胞是血液与组织间的重要屏障,覆盖于血管内膜表面,在维持血管的结构与功能及内环境稳态等方面发挥着重要作用, 其过度凋亡可通过增强血小板聚凝能力、细胞因子的活性以及促进血液凝固等促进动脉粥样硬化(atherosclerosis,AS)的发生发展[1-2]。血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)是公认最强的缩血管活性物质之一,可通过诱导血管内皮细胞损伤和凋亡参与AS的进程[3-4]。小檗碱是一种从包括黄连在内的多种清热解毒类中药中提取的生物碱,已被证实可通过抗炎和抑制氧化应激等途径发挥抗AS作用[5-6],但其对AngⅡ诱导的血管内皮细胞凋亡的影响其机制尚未见报道。本研究以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为研究对象,观察小檗碱对AngⅡ诱导的HUVECs凋亡的影响,并探讨其可能的分子机制,以期为阐明小檗碱抗AS机制提供新的参考依据。
1 材料与方法 1.1 细胞、主要试剂和仪器HUVECs购于中国典型培养物保藏中心。RPMI-1640培养基购于美国Invitrogen公司,MTT试剂、AngⅡ、二甲基亚砜和盐酸小檗碱(纯度≥98%)购于美国Sigma公司,胎牛血清购于美国Hyclone公司,磷酸化c-Jun氨基末端激酶(p-JNK)、B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase-3)抗体和β-actin抗体购于美国Cell Signal Technology公司,Annexin Ⅴ-FITC凋亡检测试剂盒购于北京众康志恒生物科技有限公司,活性氧(ROS)试剂盒购于上海碧云天生物技术研究所。流式细胞仪为美国BD公司产品,酶联免疫检测仪为美国Bio-Rad公司产品。
1.2 细胞培养和实验分组采用RPMI-1640培养基(含100 U·mL-1青链霉素双抗+ 10%胎牛血清)于含5% CO2的37℃恒温孵箱中常规培养HUVECs。收集生长良好的对数生长期的第3~ 5代细胞,将其分为对照组,AngⅡ组,低、中和高剂量小檗碱组。对照组不做处理;AngⅡ组加入终浓度为1 μmol·L-1 AngⅡ处理24 h;低、中和高剂量小檗碱组先以1μmol·L-1AngⅡ预处理3 h后,再分别加入终浓度为25、50和100 μmol·L-1小檗碱处理24 h。
1.3 细胞存活率检测将对数生长期的HUVECs接种至96孔细胞板,每孔接种细胞数为3.5×104个。于孵箱内培养24 h后,按照1.2中的分组方法给药处理,并设置不含细胞和药物的调零孔。每组实验设置5个复孔,实验重复3次。孵育24 h后,每孔加入20 μL浓度为5 g·L-1MTT试剂。反应4 h后,弃上清液,每孔加入150 μL二甲基亚砜溶液摇床震荡至紫蓝色结晶完全溶解。选取570 nm波长,采用酶联检测仪检测各孔细胞的吸光度(A)值,并计算出各组细胞存活率。细胞存活率=(药物组A值-调零组A值)/(对照组A值-调零组A值)×100%。
1.4 细胞凋亡率检测将对数生长期的HUVECs按照每孔1×104个细胞密度接种至12孔板上,按照1.2中的分组方法给药处理后,1500 r·min-1离心收集各组细胞,经预冷的PBS重悬细胞后,参照Annexin Ⅴ-FITC凋亡检测试剂盒说明书步骤采用流式细胞术检测各组细胞凋亡率, 结果以3次实验的均值表示。
1.5 细胞中ROS水平检测将对数生长期的HUVECs以每孔200 μL细胞悬液(细胞浓度为5×104mL-1)接种至96孔细胞板上。按照1.2中的分组方法进行给药处理后,弃上清液,以PBS洗涤后,加入100 μL PBS于-80℃处理5 min。常温下融化后,再以PBS反复冻融2次。收集上清液,参照ROS检测试剂盒说明书步骤测定各组细胞中ROS水平。结果以3次实验的均值表示。
1.6 Western blotting法检测细胞中p-JNK、Bcl-2、Bax和cleaved caspase-3蛋白表达水平将对数生长期的HUVECs以2.5×105个细胞接种至6孔板上,细胞分组同1.2。给药处理结束后,收集各组细胞,加入100 μL细胞裂解液提取总蛋白,并参照BCA蛋白检测试剂盒说明书步骤检测总蛋白的纯度及浓度。调整总蛋白浓度,使SDS-PAGE凝胶电泳的上样量为50 μg。电泳结束后,转膜。将含有蛋白样品的PVDF膜浸入TBST封闭液(含5%去脂奶粉)中常温下封闭1 h。4℃下,将膜放入特异性一抗溶液中孵育24 h;封闭液洗膜10 min×3次后,于室温下将膜放入辣根过氧化酶标记的二抗中孵育1 h。经封闭液洗膜10 min×3次后,暗室内滴加化学发光剂显影曝光。凝胶成像系统采集图片,Quantity One图像分析软件测定目的蛋白条带的灰度值,以β-actin为内参校正目的蛋白的相对表达水平。
1.7 统计学分析采用SPSS22.0统计软件进行统计学分析。细胞存活率,凋亡率及细胞中ROS水平和p-JNK、Bcl-2、Bax、cleaved caspase-3蛋白表达水平均以x±s表示,数据均符合正态分布,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组细胞存活率与对照组比较,AngⅡ组细胞存活率明显降低(P < 0.05);与AngⅡ组比较,不同剂量小檗碱组细胞存活率明显升高(P < 0.05),且呈现明显的剂量依赖性。见表 1。
| (n=3, x±s, η/%) | ||
| Group | Survival rate | Apoptotic rate |
| Control | 96.45±6.12 | 3.12±0.46 |
| AngⅡ | ||
| Berberine | 30.38±2.22* | 45.08±5.74* |
| Low dose | 46.16±5.05△ | 33.58±6.12△ |
| Medium dose | 55.62±4.11△ | 28.62±4.11△ |
| High dose | 71.36±6.28△ | 15.48±4.25△ |
| F | 76.854 | 37.623 |
| P | < 0.01 | < 0.01 |
| *P < 0.05 compared with control group; △P < 0.05 compared with AngⅡ group. | ||
与对照组比较,AngⅡ组细胞凋亡率明显升高(P < 0.05);与AngⅡ组比较,不同剂量小檗碱组细胞凋亡率明显降低(P < 0.05),且呈现明显量效关系。见表 1和图 1。
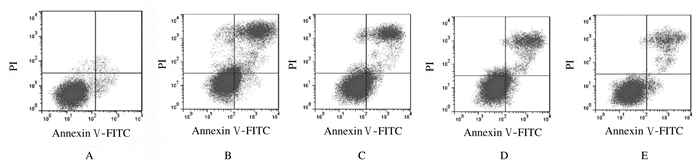
|
| A:Control group; B:AngⅡgroup; C-E:Low, medium, and high doses of berberine groups. 图 1 流式细胞术检测各组细胞凋亡率 Fig. 1 Apoptotic rates of cells in various groups detected by flow cytometry |
|
|
与对照组比较,AngⅡ组细胞中ROS水平明显升高(P < 0.05);与AngⅡ组比较,不同剂量小檗碱组细胞中ROS水平呈剂量依赖性降低(P < 0.05)。见表 2。
| [n=3, x±s, λB/(U·mL-1)] | |
| Group | ROS |
| Control | 35.48±2.35 |
| AngⅡ | |
| Berberine | 59.36±5.75* |
| Low dose | 43.15±4.03△ |
| Medium dose | 37.32±5.16△ |
| High dose | 28.16±4.27△ |
| F | 20.695 |
| P | < 0.01 |
| *P < 0.05compared with control group; △P < 0.05compared with AngⅡ group. | |
与对照组比较,AngⅡ组细胞中p-JNK、Bax和cleaved caspase-3蛋白表达水平明显升高(P < 0.05),Bcl-2蛋白表达水平明显降低(P < 0.05);与AngⅡ组比较,不同剂量小檗碱组中p-JNK、Bax和cleaved caspase-3蛋白表达水平明显降低(P < 0.05),Bcl-2蛋白表达水平明显升高(P < 0.05)。见图 2和表 3。

|
| Lane 1:Control group; Lane 2: AngⅡ group; Lane 3-5:Low, medium, and high doses of berberine groups. 图 2 Western blotting法检测各组细胞中p-JNK、Bcl-2、Bax和cleaved caspase-3蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of p-JNK, Bcl-2, Bax, and cleaved caspase-3 proteins in cells in various groups detected by Western blotting method |
|
|
| (n=3, x±s) | ||||
| Group | p-JNK | Bcl-2 | Bax | Cleaved caspase-3 |
| Control | 0.09±0.02 | 0.76±0.05 | 0.14±0.02 | 0.12±0.02 |
| AngⅡ | ||||
| Berberine | 0.41±0.03* | 0.23±0.02* | 0.66±0.05* | 0.53±0.03* |
| Low dose | 0.34±0.02△ | 0.33±0.03△ | 0.54±0.03△ | 0.45±0.03△ |
| Medium dose | 0.28±0.02△ | 0.42±0.03△ | 0.47±0.03△ | 0.38±0.02△ |
| High dose | 0.20±0.01△ | 0.61±0.04△ | 0.36±0.02△ | 0.25±0.03△ |
| F | 105.205 | 109.167 | 114.353 | 113.700 |
| P | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| *P < 0.05compared with control group; △P < 0.05 compared with AngⅡ group. | ||||
血管内皮细胞是血管的保护屏障,其功能异常与高血压、糖尿病和AS等多种疾病的发生发展有密切关联[2, 7-8]。AngⅡ是肾素-血管紧张素系统的组成成分,可通过刺激血管内皮细胞产生和释放内皮素,对血管收缩产生正反馈作用。通常情况下,低浓度AngⅡ在维持血管的构成和功能方面发挥着重要作用,而1 μmol·L-1AngⅡ可通过促进ROS生成,造成内皮细胞损伤并诱导HUVECs凋亡[9]。此外,JNK信号通路是细胞感受外界环境变化的重要桥梁,可被ROS活化,参与细胞增殖和凋亡等生物学过程[10-11]。细胞凋亡是一个受多种基因和信号通路共同调控的复杂过程。Bax和Bcl-2分别是公认的促凋亡和抑凋亡基因,caspase-3是凋亡过程的重要执行者,三者被证实是JNK信号通路下游相关基因,在细胞凋亡过程中发挥着重要作用[12-13]。张婧[14]和黄小燕等[15]研究证实:AngⅡ可通过上调Bax和caspase-3的表达和下调Bcl-2以及激活JNK信号通路诱导HUVECs凋亡。本研究结果显示:与对照组比较,以1 μmol·L-1AngⅡ处理后HUVECs存活率和Bcl-2蛋白表达水平明显降低,而HUVECs凋亡率、细胞中ROS水平以及p-JNK、Bax、cleaved caspase-3蛋白表达水平均明显升高,表明AngⅡ可激活ROS介导的JNK信号通路进而诱导HUVECs凋亡。
小檗碱又称黄连素,是一种异喹啉类生物碱,具有抗炎、抗血小板凝聚、抗肿瘤和抗心律失常等生物活性[16-17],在保护血管内皮细胞损伤方面发挥积极作用。XIONG等[18]发现:小檗碱可抑制金黄色葡萄球菌诱导的HUVECs凋亡,进而对病原菌感染引起的内皮组织损伤起到保护作用;郭君平等[19]研究显示:小檗碱可通过减少HUVECs凋亡和降低p-JNK表达有效减轻脂多糖诱导的HUVECs损伤。此外,KHODAYAR等[20]研究证实:小檗碱可通过减少ROS的产生保护砷致离体大鼠肝线粒体氧化损伤。本研究结果显示:与AngⅡ组比较,以25、50和100 μmol·L-1小檗碱处理后HUVEC存活率和Bcl-2蛋白表达水平明显升高,而细胞凋亡率、ROS水平以及p-JNK、Bax和cleaved caspase-3蛋白表达水平均降低,且呈现出剂量依赖性,提示小檗碱可通过抑制ROS/JNK信号通路的活化抑制AngⅡ诱导的HUVEC凋亡。
综上所述,激活ROS介导的JNK信号通路,进而影响凋亡相关蛋白Bcl-2、Bax和cleaved caspase-3蛋白的表达,可能是AngⅡ诱导HUVEC凋亡的重要机制,而小檗碱可通过抑制AngⅡ的上述作用发挥保护HUVECs损伤的作用。
| [1] | 闫杰, 陈静, 黄宇玲, 等. Let-7d靶向LOX-1逆转ox-LDL诱导血管内皮细胞凋亡观察[J]. 郑州大学学报:医学版, 2018, 53(5): 564–569. |
| [2] | CHEN L, YANG W, GUO Y, et al. Exosomal lncRNA GAS5 regulates the apoptosis of macrophages and vascular endothelial cells in atherosclerosis[J]. PLoS One, 2017, 12(9): e0185406. DOI:10.1371/journal.pone.0185406 |
| [3] | 位庚, 李红蓉, 常丽萍, 等. 血管紧张素Ⅱ诱导血管内皮细胞损伤及中药保护作用[J]. 中国老年学杂志, 2017, 37(13): 3353–3355. DOI:10.3969/j.issn.1005-9202.2017.13.107 |
| [4] | ZHANG L, WANG J, LIANG J, et al. Propofol prevents human umbilical vein endothelial cell injury from Ang Ⅱ-induced apoptosis by activating the ACE2-(1-7)-Mas axis and eNOS phosphorylation[J]. PLoS One, 2018, 13(7): e0199373. DOI:10.1371/journal.pone.0199373 |
| [5] | LI X M, WANG Q Z, GUO L. Beneficial effect of berberine on atherosclerosis based on attenuating vascular inflammation and calcification[J]. Chin J Pharm Toxicol, 2017, 31(10): 993–994. |
| [6] | 贾燕珺. 小檗碱的抗动脉粥样硬化作用及其机制[J]. 中国动脉硬化杂志, 2013, 21(4): 364–368. |
| [7] | REULE C A, GOYVAERTS B, SCHOEN C. Effects of an L-arginine-based multi ingredient product on endothelial function in subjects with mild to moderate hypertension and hyperhomocysteinemia-a randomized, double-blind, placebo-controlled, cross-over trial[J]. BMC Complement Altern Med, 2017, 17(1): 92–100. DOI:10.1186/s12906-017-1603-9 |
| [8] | 史海霞, 杨嘉君, 聂绪强, 等. 赤芍醇提物对血管内皮细胞一氧化氮合成和分泌的影响[J]. 郑州大学学报:医学版, 2017, 52(2): 159–163. |
| [9] | 刘永刚, 李芳君. 羟基红花黄色素A对AngⅡ诱导的人脐静脉内皮细胞凋亡的抑制作用[J]. 中药材, 2013, 36(7): 1128–1131. |
| [10] | SHAN F L, SHAO Z W, JIANG S H, et al. Erlotinib induces the human non-small-cell lung cancer cells apoptosis via activating ROS-dependent JNK pathways[J]. Cancer Med, 2016, 5(11): 3166–3175. DOI:10.1002/cam4.881 |
| [11] | LIN C L, LEE C H, CHEN C M, et al. Protodioscin induces apoptosis through ROS-mediated endoplasmic reticulum stress via the JNK/p38 activation pathways in human cervical cancer cells[J]. Cell Physiol Biochem, 2018, 46(1): 322–334. DOI:10.1159/000488433 |
| [12] | 李斌, 曾勉, 何婉媚, 等. Ghrelin通过JNK信号通路抑制LPS诱导的肺泡巨噬细胞凋亡[J]. 中山大学学报:医学科学版, 2015, 36(2): 181–188. |
| [13] | XIANG Y K, YE W, HUANG C H, et al. Brusatol inhibits growth and induces apoptosis in pancreatic cancer cells via JNK/p38 MAPK/NF-κB/Stat3/Bcl-2 signaling pathway[J]. Biochem Biophys Res Commun, 2017, 487(4): 820–826. DOI:10.1016/j.bbrc.2017.04.133 |
| [14] | 张婧.蓝莓花色苷对血管紧张素Ⅱ致人脐静脉血管内皮细胞凋亡的保护作用[D].长春: 吉林大学, 2013. |
| [15] | 黄小燕, 王宇光, 王怡, 等. 麦冬皂苷D通过上调CYP2J2/EETs抗Ang Ⅱ诱导的内皮细胞凋亡[J]. 中国中药杂志, 2018, 43(2): 377–384. |
| [16] | JIN Y, KHADKA D B, CHO W J. Pharmacological effects of berberine and its derivatives:a patent update[J]. Expert Opin Ther Pat, 2015, 26(2): 229–243. |
| [17] | 黄兴, 李艳芬, 寇冠军, 等. 小檗碱抗动脉粥样硬化作用机制研究进展[J]. 药物评价研究, 2016, 39(3): 469–473. |
| [18] | XIONG C Y, FU Y H, HU H B, et al. Berberine inhibited apoptosis of human umbilical vein endothelial cells induced by Staphylocoocus aureus:an experimental research[J]. Zhongguo Zhong Xi Yi Jie He Za Zhi, 2014, 34(6): 710–713. |
| [19] | 郭君平, 王丽君, 王宝明, 等. 小檗碱对脂多糖诱导的人脐静脉血管内皮细胞损伤的影响[J]. 中国急救医学, 2016, 36(9): 789–793. DOI:10.3969/j.issn.1002-1949.2016.09.005 |
| [20] | KHODAYAR M J, JAVADIPOUR M, KESHTZAR E, et al. Role of berberine against arsenic induced oxidative damage in isolated rat liver mitochondria[J]. J Environ Biol, 2016, 37(2): 285–290. |
 2019, Vol. 45
2019, Vol. 45
