扩展功能
文章信息
- 杨云, 马喜兴, 王大虎, 张环环, 马耀辉, 任翠敏, 刘强
- YANG Yun, MA Xixing, WANG Dahu, ZHANG Huanhuan, MA Yaohui, REN Cuimin, LIU Qiang
- 丹参酮ⅡA对过敏性紫癜肾炎小鼠肾组织中Cosmc和AOPP表达的影响及其治疗作用
- Influence of tanshinone Ⅱ A on expressins of Cosmc and AOPP in kidney tissue of allergic purpura nephritis mice and its mechanism
- 吉林大学学报(医学版), 2019, 45(04): 867-871
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 867-871
- 10.13481/j.1671-587x.20190421
-
文章历史
- 收稿日期: 2018-10-19
过敏性紫癜的主要病理表现为免疫复合物在血管内沉积,是一种常见的系统性小血管病,严重者可伴有肾脏损害,甚至危及患者生命。过敏性紫癜肾炎是继发性肾病,在儿科比较常见,多数预后良好,少数患者病情迁延,甚至发展为慢性肾功能不全[1]。过敏性紫癜肾炎的发病机制与氧化剂抗氧化系统失衡、IgA1异常糖基化、T-合酶及其分子伴侣半乳糖基转移酶伴侣蛋白(Cosmc)表达异常和凝血系统活性异常等有关[2-3]。过敏性紫癜肾炎的治疗西医方面尚无特异性治疗方法,而中药可提高患者免疫力,对其治疗具有独特优势。丹参酮ⅡA是丹参的主要活性成分,在过敏性紫癜肾炎治疗中具有较好疗效[4],但其治疗机制尚不清楚。本文作者通过建立过敏性紫癜肾炎小鼠模型,观察丹参酮ⅡA对模型小鼠肾组织中Cosmc、晚期氧化蛋白终末产物(AOPP)表达及细胞外调节蛋白激酶(ERK)/丝裂原活化蛋白激酶(MAPK)信号通路的影响,探讨其可能的治疗机制。
1 材料与方法 1.1 实验动物和主要试剂无特定病原体、清洁级C57BL/6小鼠38只,6~8周龄,雄雌不限,体质量17~21 g,尿蛋白阴性,购自上海斯莱克实验动物有限公司,动物许可证号:SCXK(沪)2012-0002。
丹参酮ⅡA(上海纯优生物科技有限公司),脂多糖(LPS)、牛血清白蛋白(BSA)和四氯化碳(CCl4)(美国Sigma公司),干姜(产地:四川,益丰大药房),ELISA试剂盒(美国TaKaRa公司),BCA试剂盒(美国RD公司),TRIzol试剂盒、RT-PCR试剂盒和逆转录试剂盒(美国Thermo Pierce公司),PCR引物和内参(上海生工生物工程股份有限公司设计合成),兔抗鼠ERK多克隆抗体、兔抗鼠p-ERK多克隆抗体和β-actin抗体(美国Invitrogen公司)。
1.2 实验动物分组和过敏性紫癜肾炎小鼠模型建立[5]将38只小鼠根据随机数字法分为对照组(n=12)、模型组(n=14)和丹参酮ⅡA组(n=12)。模型组和丹参酮ⅡA组小鼠建立过敏性紫癜肾炎模型:每只小鼠给予BSA(4 mL·kg-1,隔天1次,共8周)灌胃,尾静脉注射LPS(0.025% LPS 0.2 mL,第6、8、10和12周各1次),皮下注射CCl4(0.3 mL蓖麻油+ 0.1 mL CCl4,每周1次,共9周)建立IgA肾病模型;建模期间同时构建血热症模型,复合成为过敏性紫癜肾炎模型,建模期间室温为30℃,从第9周开始给予25%干姜水(10 mL·kg-1,隔天1次)灌服。对照组小鼠给予等量生理盐水灌胃,等量生理盐水尾静脉注射和皮下注射,温度为室温。12周建模结束,其中模型组2只小鼠用于检验造模是否成功,造模成功标准:出现皮下紫癜,光镜下皮损区和非皮损区都可见局灶性上皮细胞增多和少量炎性细胞浸润,肾脏病理改变。丹参酮ⅡA组小鼠从13周开始,每天腹腔注射丹参酮ⅡA(25μmol·L-1) 200 μL[6],对照组和模型组小鼠每天腹腔注射等量生理盐水,共4周。
1.3 各组小鼠尿红细胞计数和24 h尿蛋白水平测定用药结束后(16周末),收集3组小鼠24 h尿液。采用尿沉渣计数法测定尿红细胞计数,采用BCA法测量24 h尿蛋白水平。
1.4 标本制备收集尿液后,水合氯醛麻醉处死小鼠,取出小鼠双侧肾脏组织,一侧肾组织甲醛固定,用于病理检查;另一侧肾组织用于ELISA、Western blotting和RT-PCR法检测。
1.5 各组小鼠肾组织病理检查取出小鼠肾脏组织,分离各组小鼠肾脏皮质,用甲醛固定,石蜡包埋,切成5 μm厚的切片,采用PAS染色,显微镜下观察各组小鼠肾组织病理形态表现,拍照。
1.6 ELISA法检测小鼠肾组织中AOPP蛋白水平取小鼠部分肾组织,制成10%匀浆,离心取上清液,采用ELISA法测定肾组织中AOPP水平,操作步骤严格按说明书进行,通过吸光度及浓度曲线计算AOPP水平,单位μmol·L-1。
1.7 Western blotting法检测小鼠肾组织中ERK和p-ERK蛋白表达水平取小鼠肾组织研磨,加入细胞裂解液裂解,提取肾组织总蛋白,BCA法检测蛋白浓度,采用Western blotting法测定肾组织ERK和p-ERK蛋白水平,以兔抗鼠ERK多克隆抗体和兔抗鼠p-ERK多克隆抗体为一抗,β-actin为内参。采用Quantity One软件分析各条带灰度值,目的蛋白相对表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.8 RT-PCR法检测小鼠肾组织中ERK、p-ERK和Cosmc mRNA表达水平将小鼠肾组织在研磨仪中研磨至完全磨碎,提取肾组织总RNA,采用RT-PCR法测定各组小鼠肾组织中ERK、p-ERK和Cosmc mRNA表达水平,以GAPDH为内参。PCR反应条件:95℃、30 s;95℃、5 s,57℃、34 s,95℃、15 s,共40循环;60℃、1 min;95℃、5 s。各组小鼠肾组织中ERK、p-ERK和Cosmc mRNA相对表达水平采用2-ΔΔCt法计算。
1.9 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组小鼠尿红细胞计数,24 h尿蛋白及肾组织中AOPP蛋白水平,肾组织中ERK、p-ERK蛋白表达水平和ERK、p-ERK、Cosmc mRNA表达水平,均以x±s表示,经方差齐性检验呈正态分布,多组间样本均数比较采用单因素方差分析。Cosmc mRNA表达水平与AOPP蛋白水平和p-ERK蛋白表达水平相关性、AOPP蛋白表达水平与p-ERK蛋白表达水平相关性分析均采用Pearson相关性分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 各组小鼠尿红细胞计数和24 h尿蛋白水平与对照组比较,模型组和丹参酮ⅡA组小鼠尿红细胞计数和24 h尿蛋白水平升高(P < 0.01);与模型组比较,丹参酮ⅡA组小鼠尿红细胞计数和24 h尿蛋白水平降低(P < 0.01)。见表 1。
| (n=12, x±s) | ||
| Group | Urine red blood cell count(number/high power field) | 24 hurine protein level(m/g) |
| Control | 10.87±0.12 | 0.36±0.07 |
| Model | 18.93±3.41* | 1.93±0.54* |
| Tanshinone Ⅱ A | 11.65±1.48*△ | 1.06±0.38△ |
| *P < 0.01compared with control group;△P < 0.01compared with model group. | ||
对照组小鼠肾小球基底膜无增生,无肾小球硬化;模型组小鼠肾小球基底膜增生明显,可见炎症细胞浸润,出现肾小球硬化;丹参酮ⅡA组小鼠肾小球基底膜增生和炎症浸润不明显,有少量炎症细胞浸润。见图 1(插页七)。

|
| A:Control group; B: Model group; C: Tanshinone Ⅱ A group. 图 1 各组小鼠肾组织PAS染色结果(×200) Fig. 1 Results of PAS staining of kidney tissue of mice in various groups (×200) |
|
|
与对照组比较,模型组和丹参酮ⅡA组小鼠肾组织中AOPP蛋白水平升高(P < 0.05);与模型组比较,丹参酮ⅡA组小鼠肾组织中AOPP蛋白水平降低(P < 0.05)。
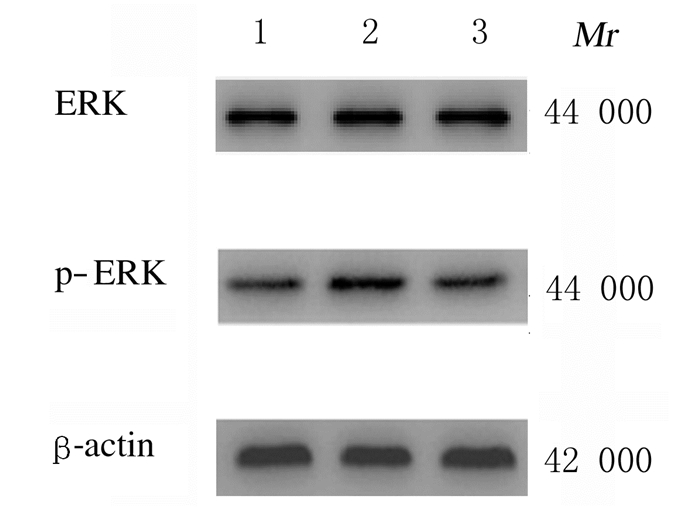
3组小鼠肾组织中ERK蛋白表达水平比较差异无统计学意义(P>0.05);与对照组比较,模型组和丹参酮ⅡA组小鼠肾组织中p-ERK蛋白表达水平升高(P < 0.01);与模型组比较,丹参酮ⅡA组小鼠肾组织中p-ERK蛋白表达水平降低(P < 0.01)。见表 2和图 2。
| (n=12, x±s) | |||
| Group | AOPP[cB/(μmol·L-1)] | ERK | p-ERK |
| Control | 32.14±6.73 | 0.51±0.08 | 0.28±0.05 |
| Model | 112.47±26.38* | 0.53±0.07 | 0.47±0.13** |
| Tanshinone Ⅱ A | 54.25±11.54*△ | 0.49±0.08 | 0.39±0.11**△ |
| *P < 0.05, **P < 0.01 compared with control group;△P < 0.01 compared with model group. | |||
|
| Lane 1: Control group; Lane 2: Model group; Lane 3: Tanshinone Ⅱ Agroup. 图 2 Western blotting法检测各组小鼠肾组织中ERK和p-ERK蛋白表达电泳图 Fig. 2 Electrophoregram of expressions ERK and p-ERK proteins in kidney tissue of mice in various groups detected by western blotting method |
|
|
3组小鼠肾组织中ERK mRNA表达水平比较差异无统计学意义(P>0.05)。与对照组比较,模型组和丹参酮ⅡA组小鼠肾组织中Cosmc mRNA表达水平降低(P < 0.01),p-ERK mRNA表达水平升高(P < 0.01);与模型组比较,丹参酮ⅡA组小鼠肾组织中Cosmc mRNA表达水平升高(P < 0.01),p-ERK mRNA表达水平降低(P < 0.01)。见表 3。
| (n=12, x±s) | |||
| Group | Cosmc mRNA | ERK mRNA | p-ERK mRNA |
| Control | 1.00±0.02 | 1.00±0.02 | 1.00±0.02 |
| Model | 0.47±0.06* | 0.98±0.13 | 1.87±0.13* |
| Tanshinone Ⅱ A | 0.63±0.12*△ | 1.01±0.11 | 1.42±0.14*△ |
| *P < 0.01 compared with control group;△P < 0.01 compared with model group. | |||
模型组小鼠肾组织中Cosmc mRNA表达水平与AOPP蛋白水平和p-ERK蛋白表达水平呈负相关关系(r=-0.573,P<0.01;r=-0.602,P<0.01),AOPP蛋白水平与p-ERK蛋白表达水平呈正相关关系(r=0.614, P<0.01)。
3 讨论过敏性紫癜肾炎是免疫复合物性肾病,以血尿和蛋白尿为主要临床表现,其主要为系膜增生性肾小球肾炎,常伴有新月体形成、阶段性肾小球毛细血管袢坏死等血管炎表现,其病理基础为细胞外基质过度沉积和系膜细胞增殖[7]。氧化应激参与过敏性紫癜的发病过程,AOPP是机体氧化应激的标志性产物之一,是在慢性肾衰竭患者血液中发现的尿毒症毒素;AOPP可刺激单核细胞核中性粒细胞合成、释放IL-8等多种炎性细胞因子,诱导血管内皮细胞产生活性氧,从而诱导组织细胞的损伤和凋亡[8],其诱导产生的活性氧还可通过调控MAPK等信号通路[9];在过敏性紫癜患者中AOPP水平升高,通过多种途径参与过敏性紫癜的发病[10]。
肾组织中IgA1沉积是过敏性紫癜肾炎肾组织损伤的重要环节,IgA1存在有17个氨基酸残基组成的铰链区,这些残基为O-糖基化连接位点。T-合酶为O-糖基化过程中的关键酶,在Tn抗原转化为T抗原的过程中具有重要作用,T-合酶的催化活性依赖于其分子伴侣Cosmc,在内质网中与T-合酶前体结合辅助T-合酶正常折叠,从而发挥正常生理功能,当Cosmc表达不足时则难以维持T-合酶的正确折叠[11],在肾炎发病过程中Cosmc水平降低[12]。
过敏性紫癜患者体内氧化系统激活,活性氧水平升高,活性氧可直接引起足细胞、系膜细胞和血管内皮细胞损伤,也可通过参与体液免疫造成组织损伤,还可通过调控MAPK等信号通路介导淋巴细胞增殖和分化[13];ERK/MAPK信号通路在肾小球硬化和肾间质纤维化等各种肾病中具有重要作用,可介导T淋巴细胞和B淋巴细胞等的增殖、分化和信号传导等[14-15]。
过敏性紫癜的治疗西医主要以免疫抑制剂和激素治疗为主,但免疫性治疗受免疫因子影响,对炎症抑制不足或者过度抑制都可促进炎症的发展,从而使免疫抑制剂的剂量难以控制,给治疗带来极大困难,效果也不甚理想。丹参酮ⅡA为丹参的主要活性成分[16],对多种系统损伤具有保护作用[17-18],可通过ERK等信号通路发挥对多个组织器官的保护作用[19]。研究[20]显示:丹参酮ⅡA对过敏性紫癜具有较好的治疗效果。本研究结果显示:过敏性紫癜肾炎小鼠肾组织中AOPP蛋白水平和p-ERK蛋白及mRNA表达水平升高,Cosms蛋白和mRNA表达水平降低,且三者之间有明显相关性,表明丹参酮ⅡA可降低过敏性紫癜肾炎小鼠肾组织中AOPP和p-ERK水平,升高Cosms水平。分析丹参酮ⅡA可能通过降低过敏性紫癜小鼠肾脏的氧化应激反应,抑制ERK/MAPK信号通路激活,升高Cosmc水平,增加其与T-合酶前体结合以维持T-合酶正确折叠,从而发挥对过敏性紫癜肾炎小鼠肾脏的保护作用。
本研究的不足之处在于只对过敏性紫癜肾炎小鼠肾组织Cosmc、AOPP和p-ERK表达水平及其相关性进行研究,三者之间具体以何种机制相互作用及相互的影响尚需进一步研究。
| [1] | CHEN JY, MAO JH. Henoch-Sch nlein purpura nephritis in children:incidence, pathogenesis and management[J]. World J Pediatr, 2015, 11(1): 29–34. DOI:10.1007/s12519-014-0534-5 |
| [2] | 李向新, 闫纪平, 姜威, 等. 护肾除癜方辅助西医药物治疗过敏性紫癜肾炎疗效及对凝血指标的影响[J]. 中国中医急症, 2018, 27(5): 877–880. DOI:10.3969/j.issn.1004-745X.2018.05.034 |
| [3] | XIE YX, HE LY, CHEN X, et al. Potential diagnostic biomarkers for IgA nephropathy:a comparative study pre-and post-tonsillectomy[J]. Int Urol Nephrol, 2016, 48(11): 1855–1861. DOI:10.1007/s11255-016-1372-2 |
| [4] | 胥会英, 童晓, 李成万. 丹参酮ⅡA提高小儿过敏性紫癜血浆组织因子途径抑制物水平及干预肾损害的研究[J]. 中医儿科杂志, 2018, 14(4): 26–28. |
| [5] | 李灵.芪元颗粒及有效部位对HSP模型大鼠治疗作用的实验研究[D].太原: 山西中医药大学, 2017. |
| [6] | 杨扬, 杨洁. 丹参酮ⅡA对EAE小鼠临床表现及外周Treg细胞的影响[J]. 天津医科大学学报, 2017, 23(1): 17–20. |
| [7] | 王恒东, 顾教伟, 王勇, 等. 复方甘草酸苷注射液联合他克莫司治疗过敏性紫癜肾炎的临床研究[J]. 现代药物与临床, 2018, 33(11): 3021–3025. |
| [8] | 邢丽娜, 任金海, 王颖, 等. 孟鲁司特钠对ITP模型小鼠T淋巴细胞亚群及晚期氧化蛋白产物的影响[J]. 中国免疫学杂志, 2018, 34(6): 826–829. DOI:10.3969/j.issn.1000-484X.2018.06.005 |
| [9] | 白晓峰, 冯梅, 李凯, 等. 晚期氧化蛋白产物抑制CD4+CD25+调节性T细胞的增殖[J]. 中华实验外科杂志, 2018, 35(1): 123–126. |
| [10] | 季伟星, 金慧英. 过敏性紫癜患儿血清骨桥蛋白、核转移因子含量检测及其与氧化应激、细胞免疫功能的相关关系[J]. 中国卫生检验杂志, 2018, 28(19): 2356–2358. |
| [11] | HU S, BAO H, XU XD, et al. Increased miR-374b promotes cell proliferation and the production of aberrant glycosylated IgA1 in B cells of IgA nephropathy[J]. FEBS Lett, 2015, 589(24 Pt B): 4019–4025. |
| [12] | 霍建丽.晚期氧化蛋白产物(AOPPs)在过敏性紫癜的血清水平及其与异常糖基化IgA1及Cosmc mRNA表达的关系[D].石家庄: 河北医科大学, 2017. |
| [13] | GAO J, WU LL, WANG Y, et al. Knockdown of Cxcl10 inhibits mesangial cell proliferation in murine habu nephritis via ERK signaling[J]. Cell Physiol Biochem, 2017, 42(5): 2118–2129. DOI:10.1159/000479914 |
| [14] | WU H, ZHOU SS, KONG LL, et al. Metallothionein deletion exacerbates intermittent hypoxia-induced renal injury in mice[J]. Toxicol Lett, 2015, 232(2): 340–348. DOI:10.1016/j.toxlet.2014.11.015 |
| [15] | 曾辉.儿童过敏性紫癜血浆miRNAs差异表达谱研究[D].衡阳: 南华大学, 2016. |
| [16] | REN B, ZHANG Y X, ZHOU H X, et al. Tanshinone ⅡA prevents the loss of nigrostriatal dopaminergic neurons by inhibiting NADPH oxidase and iNOS in the MPTP model of Parkinson's disease[J]. J Neurol Sci, 2015, 348(1/2): 142–152. |
| [17] | 范茂虓, 何飞, 丁岚, 等. 丹参酮ⅡA磺酸钠注射液对过敏性紫癜患者紫癜消退及肾受累的影响[J]. 中国临床研究, 2016, 29(2): 262–265. |
| [18] | 王乐琪, 谢志茹, 李莎莎, 等. 丹参及其复方制剂用于与微循环障碍有关疾病的研究进展[J]. 中国药房, 2018, 29(23): 3297–3302. DOI:10.6039/j.issn.1001-0408.2018.23.28 |
| [19] | LIU X, GUO C Y, MA X J, et al. Anti-inflammatory effects of tanshinone ⅡA on atherosclerostic vessels of ovariectomized ApoE mice are mediated by estrogen receptor activation and through the ERK signaling pathway[J]. Cell Physiol Biochem, 2015, 35(5): 1744–1755. DOI:10.1159/000373986 |
| [20] | 叶丽娟, 李锦开, 萧庆文. 孟鲁司特联合丹参酮ⅡA磺酸钠治疗儿童单纯型过敏性紫癜的临床效果分析[J]. 广西医科大学学报, 2018, 35(10): 1452–1455. |
 2019, Vol. 45
2019, Vol. 45


