扩展功能
文章信息
- 张新, 巨朝娟, 张剑, 赵燕
- ZHANG Xin, JU Zhaojuan, ZHANG Jian, ZHAO Yan
- 形觉剥夺性近视模型大鼠巩膜成纤维细胞中TGF-β1表达及Wnt/β-catenin信号通路的调控作用
- Expression of TGF-β1 in scleral fibroblasts of rats with form deprivation myopia and regulation of Wnt/β-catenin signaling pathway
- 吉林大学学报(医学版), 2019, 45(04): 861-866
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 861-866
- 10.13481/j.1671-587x.20190420
-
文章历史
- 收稿日期: 2018-09-26
2. 佳木斯大学附属第一医院眼科, 黑龙江 佳木斯 154007
2. Department of Ophthalmology, First Affiliated Hospital, Jiamusi University, Jiamusi 154007, China
近视在全球范围内有较高的发病率,在亚洲地区发病率尤其高,高度近视可引起严重并发症,是成人致盲的常见原因之一,其发病机制尚不十分清楚,目前仍无有效的治疗方法,因此探讨近视的发病机制可为近视的治疗提供依据[1-2]。Wnt/β-连环蛋白(β-catenin)信号通路对多种生命活动具有重要的调控作用,在眼相关疾病的调节中也具有重要作用,Wnt/β-catenin信号通路与近视的发生关系密切,在近视的发病过程中Wnt/β-catenin信号通路被激活,通过对细胞凋亡、炎症反应和血管生成的调节参与近视的发生发展[3]。转化生长因子β1(transforming growth factor-β1,TGF-β1)在巩膜、视网膜和脉络膜中均有表达[4],研究[5]显示:近视大鼠巩膜组织中TGF-β1水平降低,但在细胞水平上,TGF-β1在巩膜成纤维细胞中的表达及其与Wnt/β-catenin信号通路的关系尚不清楚。本文作者通过建立形觉剥夺性近视(form deprivation myopia,FDM)模型大鼠,研究巩膜成纤维细胞中TGF-β1的表达及其与Wnt/β-catenin信号通路的关系,为近视的治疗提供新的依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器3周龄SD大鼠40只,体质量66~72g,雌雄不限,购自上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2007-0005。逆转录-聚合酶链反应(RT-PCR)试剂盒、胎牛血清、TRIzol、高糖DMEM培养基、BCA试剂盒和Dickkopf相关蛋白1(DDK1)(Wnt/β-catenin信号通路抑制剂)(美国Invitrogen公司),β-actin抗体、兔抗鼠TGF-β1多克隆抗体、兔抗鼠3型核糖核酸酶(DCL3)多克隆抗体、兔抗鼠结肠腺瘤样息肉蛋白(APC)多克隆抗体、兔抗鼠糖原合成酶激酶3β(GSK3β)多克隆抗体、兔抗鼠p21-GSK3β多克隆抗体和兔抗鼠β-catenin多克隆抗体(美国Sigma公司),TGF-β1、DCL3、APC、GSK3β、p21-GSK3β和β-catenin引物由上海生物工程技术有限公司设计合成。BIO-RAD型PCR仪(美国BIO公司),OLYMPUS BX41型数码显微镜(日本OLYMPUS公司)。
1.2 实验动物分组和FDM模型建立40只大鼠随机分为对照组和FDM模型组,每组20只。FDM模型组大鼠建立FDM模型:将自制的半球形塑料眼罩粘贴在大鼠右眼周围,眼睑可自由运动,每天检查眼罩是否脱落或松动,眼罩出现脱落或松动及时用胶水粘好,左眼不做处理;对照组大鼠眼睛不做处理,共持续28 d。每组取15只大鼠用于测量眼轴长度和巩膜组织TGF-β1水平测定;每组剩余5只用于巩膜成纤维细胞培养。
1.3 各组大鼠眼轴长度测定大鼠建模结束后,过量麻醉处死大鼠,摘取大鼠右眼眼球,游标卡尺测量眼轴长度。
1.4 各组大鼠巩膜组织中TGF-β1蛋白和mRNA水平检测测量大鼠眼轴长度后,分离大鼠眼球巩膜组织,加入细胞裂解液裂解,提取巩膜组织总蛋白,BCA法测量巩膜组织蛋白浓度,采用Western blotting法测定巩膜组织中TGF-β1蛋白表达水平,以兔抗鼠TGF-β1多克隆抗体为一抗,β-actin为内参。采用Quantity One软件进行条带灰度分析,TGF-β1蛋白相对表达水平=TGF-β1蛋白条带灰度值/β-actin条带灰度值。将大鼠巩膜组织在研磨仪中研磨至完全磨碎,提取巩膜组织总RNA,采用RT-PCR法测定各组大鼠巩膜组织中TGF-β1 mRNA,以β-actin为内参,PCR反应条件:95℃、30s;95℃、15s,60℃、30s,95℃、15s,共40循环;60℃、1min;95℃、15s。大鼠巩膜组织中TGF-β1 mRNA相对表达水平采用2-ΔΔCt法计算。
1.5 大鼠巩膜成纤维细胞培养和鉴定将每组剩余5只大鼠处死,取眼巩膜组织,剪成碎片,接种到培养瓶中,加入EMEM培养基孵育,3 d换液1次,细胞达85%以上融合后用胰蛋白酶消化,进行传代培养,每天倒置显微镜下观察巩膜细胞生长情况。取第3代生长状态良好的细胞制备爬片,采用免疫荧光细胞化学法进行鉴定:细胞爬片后用多聚甲醛固定15 min,破膜30 min,血清封闭30 min,加入波形蛋白单克隆抗体过夜孵育,加入羊抗鼠IgG-FITC孵育2h,加入DAPI工作液孵育10 min,封片,观察染色情况。
1.6 巩膜成纤维细胞分组和处理对照组大鼠巩膜培养的成纤维细胞作为对照组,FDM模型组大鼠巩膜培养的成纤维细胞分为FDM组和FDM+DDK1组,将生长良好的第3代各组巩膜成纤维细胞接种到96孔板中(细胞密度为每孔5×103个/细胞),每组设8个复孔,加入DMEM培养基培养24h细胞贴壁生长后,FDM+DDK1组巩膜成纤维细胞中加入DDK1(100 μg·L-1),对照组和FDM组巩膜成纤维细胞加入等量培养基,培养48h后收集细胞备用。
1.7 各组大鼠巩膜成纤维细胞中TGF-β1、DCL3、APC、GSK3β、p21-GSK3β和β-catenin蛋白及mRNA表达水平检测提取各组巩膜成纤维细胞总蛋白,采用Western blotting法测定巩膜成纤维细胞中TGF-β1、DCL3、APC、GSK3β、p21-GSK3β和β-catenin蛋白表达水平,一抗为兔抗鼠TGF-β1多克隆抗体、兔抗鼠DCL3多克隆抗体、兔抗鼠APC多克隆抗体、兔抗鼠GSK3β多克隆抗体、兔抗鼠p21-GSK3β多克隆抗体和兔抗鼠β-catenin多克隆抗体为一抗,方法同1.4。提取各组巩膜成纤维细胞总RNA,采用RT-PCR法测定巩膜成纤维细胞中TGF-β1、DCL3、APC、GSK3β、p21-GSK3β和β-catenin mRNA表达水平,方法同1.4。
1.8 统计学分析采用SPSS 20.0统计软件进行统计学分析。大鼠眼轴长度,大鼠巩膜组织中TGF-β1蛋白和mRNA表达水平,大鼠巩膜成纤维细胞中TGF-β1、DCL3、APC、GSK3β、p21-GSK3β和β-catenin蛋白及mRNA表达水平以x±s表示,经F检验方差齐性,2组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以α=0.05为检验水准。
2 结果 2.1 2组大鼠眼轴长度与对照组[(7.36± 0.12)mm]比较,FDM模型组大鼠眼轴长度[(7.68± 0.15)mm]明显增加(P < 0.05)。
2.2 2组大鼠巩膜组织中TGF-β1蛋白和mRNA表达水平与对照组比较,FDM模型组大鼠巩膜组织中TGF-β1蛋白和mRNA表达水平明显降低(P < 0.01)。见表 1和图 1。
| (n=15, x±s) | ||
| Group | TGF-β1 protein | TGF-β1 mRNA |
| Control | 0.62±0.14 | 1.00±0.01 |
| FDM model | 0.28±0.07 | 0.57±0.12 |
| t | 8.413 | 13.830 |
| P | < 0.01 | < 0.01 |
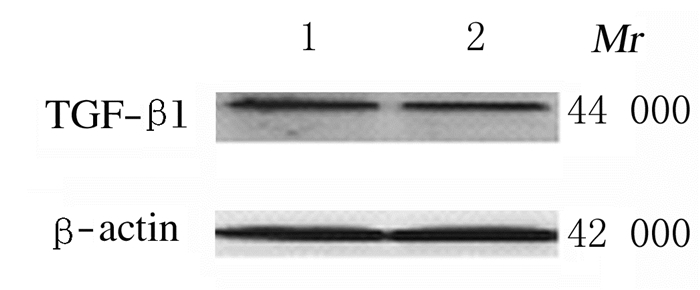
|
| Lane 1:Control group; Lane 2:FDM model group. 图 1 Western blotting法检测2组大鼠巩膜组织中TGF-β1蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of TGF-β1 protein in sclera tissue of rats in two groups detected by Western blotting method |
|
|
原代培养3 d有细胞从组织块边缘爬出,呈长梭形,胞质透明;培养12 d后细胞融合成单层细胞。传代24 h后细胞开始贴壁生长,呈梭形;传代3d后细胞融合。见图 2。免疫细胞化学鉴定:培养的细胞95%以上表达波形蛋白,表明培养细胞为巩膜成纤维细胞。

|
| A: Primary culture for 3 d; B: Subculture for 24 h; C: Subculture for 3 d. 图 2 培养不同时间后大鼠巩膜成纤维细胞形态(×200) Fig. 2 Morphology of scleral fibroblasts of rats after cultrured for different time (×200) |
|
|
各组大鼠巩膜成纤维细胞中GSK3β蛋白表达水平比较差异无统计学意义(P>0.05)。与对照组比较,FDM组大鼠巩膜成纤维细胞中TGF-β1和APC蛋白表达水平均降低(P < 0.05),DCL3、p21-GSK3β和β-catenin蛋白表达水平升高(P < 0.05),FDM+DDK1组大鼠巩膜成纤维细胞中上述各指标蛋白表达水平差异均无统计学意义(P>0.05);与FDM组比较,FDM+DDK1组大鼠巩膜成纤维细胞中TGF-β1和APC蛋白表达水平升高(P < 0.05),DCL3、p21-GSK3β和β-catenin蛋白表达水平降低(P < 0.05)。见表 2和图 3。
| (n=8, x±s) | ||||||
| Group | TGF-β1 protein | DCL3 protein | APC protein | GSK3β protein | p21-GSK3β protein | β-catenin protein |
| Control | 0.58±0.14 | 0.25±0.05 | 0.61±0.12 | 0.41±0.06 | 0.31±0.07 | 0.37±0.09 |
| FDM | 0.26±0.08* | 0.61±0.13* | 0.35±0.08* | 0.43±0.05 | 0.72±0.15* | 0.85±0.18* |
| FDM+DDK1 | 0.54±0.12△ | 0.30±0.07△ | 0.57±0.11△ | 0.42±0.07 | 0.35±0.14△ | 0.42±0.11△ |
| F | 18.059 | 37.564 | 14.298 | 0.218 | 26.094 | 31.772 |
| P | < 0.01 | < 0.01 | < 0.01 | 0.806 | < 0.01 | < 0.01 |
| * P < 0.05 compared with control group;△P < 0.05 compared with FDM group. | ||||||

|
| Lane 1:Control group; Lane 2:FDM group; Lane 3:FDM+DDK1 group. 图 3 Western blotting法检测各组大鼠巩膜成纤维细胞中TGF-β1、DCL3、APC、GSK3β、p21-GSK3β和β-catenin蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of TGF-β1, DCL3, APC, GSK3β, p21-GSK3β, and β-catenin proteins in scleral fibroblasts of rats in various groups detected by Western blotting method |
|
|
各组巩膜成纤维细胞中GSK3β mRNA表达水平比较差异无统计学意义(P>0.05)。与对照组比较,FDM组大鼠巩膜成纤维细胞中TGF-β1和APC mRNA表达水平降低(P < 0.05),DCL3、p21-GSK3β和β-catenin mRNA表达水平升高(P < 0.05),FDM+DDK1组大鼠巩膜成纤维细胞中上述各指标mRNA表达水平差异均无统计学意义(P>0.05);与FDM组比较,FDM+DDK1组大鼠巩膜成纤维细胞中TGF-β1和APC mRNA表达水平升高(P < 0.05),DCL3、p21-GSK3β和β-catenin mRNA表达水平降低(P < 0.05)。见表 3。
| (n=8, x±s) | ||||||
| Group | TGF-β1 mRNA | DCL3 mRNA | APC mRNA | GSK3β mRNA | p21-GSK3β mRNA | β-catenin mRNA |
| Control | 1.00±0.03 | 1.00±0.02 | 1.00±0.01 | 1.00±0.02 | 1.00±0.03 | 1.00±0.01 |
| FDM | 0.42±0.07* | 2.31±0.42* | 0.51±0.13* | 0.97±0.015 | 2.53±0.38* | 1.97±0.34* |
| FDM+DDK1 | 0.96±0.14△ | 1.07±0.21△ | 0.96±0.17△ | 0.99±0.113 | 1.09±0.17△ | 1.06±0.25△ |
| F | 99.150 | 59.006 | 38.710 | 0.141 | 101.552 | 39.789 |
| P | < 0.01 | < 0.01 | < 0.01 | 0.869 | < 0.01 | < 0.01 |
| *P < 0.05 compared with control group;△P < 0.05 compared with FDM group. | ||||||
近视为常见的屈光不正,在正常状态下,眼轴长度和眼屈光系统相互配合,使来自外来物体的平行光线经屈光系统聚焦在视网膜黄斑中心形成清晰物象,当眼轴长度增加时,来自外来物体的平行光线经屈光系统后在视网膜之前成像,从而形成近视[6-7]。随着近视发病率的升高,高度近视引起的严重并发症也越来越多,高度近视主要的并发症有后巩膜葡萄肿、视网膜出血、裂孔、萎缩变性、视网膜下新生血管、视网膜脱离、青光眼和白内障等,严重影响人类健康[8-9]。在胚胎发育、细胞分化、免疫反应和组织再生中TGF-β发挥重要作用[10-11],TGF-β1为TGF-β亚型之一,在巩膜、脉络膜和视网膜中均有表达;TGF-β1在视网膜中主要分布在神经节细胞、无长突细胞和双极细胞上,通过调节胶原产生和成纤维细胞的增生、刺激巩膜成纤维细胞和软骨细胞增生参与巩膜重塑的调节作用,在FDM大鼠巩膜组织中TGF-β1表达水平降低[12-13]。本文作者通过建立FDM大鼠模型发现:FDM模型组大鼠眼轴长度增加,巩膜组织中TGF-β1表达水平降低,分析其原因可能是TGF-β1参与FDM的形成过程。本研究进一步分离巩膜成纤维细胞,FDM模型组大鼠分离培养的巩膜成纤维细胞中TGF-β1表达水平低于对照组,细胞层面的研究进一步表明FDM大鼠巩膜成纤维细胞中TGF-β1表达水平降低。
Wnt/β-catenin信号通路为经典的Wnt信号通路,参与炎症反应、纤维化和血管新生等生理病理过程,调控细胞分化、增殖、凋亡和迁移过程[14-15],包括Wnt、β-catenin、APC、GSK3β、DCL3和p21-GSK3β等,Wnt/β-catenin信号通路失活时,胞质内β-catenin附着在细胞骨架上介导细胞间的黏附,细胞质中APC和GSK3β等蛋白组成复合体,调节β-catenin水平,使β-catenin在细胞中处于低水平状态,对其下游靶基因的转录发挥抑制作用[16-18];Wnt/β-catenin信号通路被激活时,β-catenin进入细胞核,募集其他激活因子,促进其下游靶基因的表达[19-20]。在近视的发生过程中,Wnt/β-catenin信号通路被激活,通过参与新生血管生成、细胞凋亡和细胞外基质代谢等生物学功能参与近视及其并发症的发生[21]。本研究对FDM大鼠巩膜成纤维细胞中Wnt/β-catenin信号通路进行研究结果显示:FDM组大鼠巩膜成纤维细胞中β-catenin负向调控蛋白APC水平降低,正向调控蛋白DCL3和p21-GSK3β水平升高,β-catenin水平也升高,表明FDM大鼠巩膜成纤维细胞Wnt/β-catenin信号通路被激活,给予Wnt/β-catenin信号通路抑制剂DDK1后,Wnt/β-catenin信号通路活性被抑制,并升高细胞中TGF-β1表达水平,推测Wnt/β-catenin可能通过调节TGF-β1表达水平参与近视的发生过程。
综上所述,Wnt/β-catenin信号通路可能通过调节TGF-β1水平参与近视的发生,抑制Wnt/β-catenin信号通路可升高TGF-β1水平,在控制近视中具有重要作用。
| [1] | XIONG SY, SANKARIDURG P, NADUVILATH T, et al. Time spent in outdoor activities in relation tomyopiaprevention and control:A meta-analysis and systematic review[J]. Acta Ophthalmol, 2017, 95(6): 551–566. DOI:10.1111/aos.13403 |
| [2] | SUHR THYKJAER A, LUNDBERG K, GRAUSLUND J. Physical activity in relation to development and progression of myopia-a systematic review[J]. Acta Ophthalmol, 2017, 95(7): 651–659. DOI:10.1111/aos.13316 |
| [3] | SEKO Y, AZUMA N, YOKOI T, et al. Anteroposterior patterning of gene expression in the human infant sclera:chondrogenic potential and wnt signaling[J]. Curr Eye Res, 2017, 42(1): 145–154. DOI:10.3109/02713683.2016.1143015 |
| [4] | ZHANG Y, ZHAO D W, YANG S, et al. Protective effects of fucoidan on epithelial-mesenchymal transition of retinal pigment epithelial cells and progression of proliferative vitreoretinopathy[J]. Cell Physiol Biochem, 2018, 46(4): 1704–1715. DOI:10.1159/000489246 |
| [5] | 左韬, 马贤德, 张祝强, 等. 形觉剥夺性近视模型大鼠巩膜组织中bFGF、TGF-β mRNA及蛋白表达规律的实验研究[J]. 辽宁中医杂志, 2014, 41(9): 2001–2004. |
| [6] | GALVIS V, TELLO A, CAMACHO P A, et al. Bio-environmental factors associated withmyopia:An updated review[J]. Arch Soc Esp Oftalmol, 2017, 92(7): 307–325. DOI:10.1016/j.oftal.2016.11.016 |
| [7] | 石晶, 谭小波, 杨洁, 等. 虾青素对凹透镜所致的豚鼠近视模型屈光状态及病理组织形态的影响[J]. 吉林大学学报:医学版, 2017, 43(5): 932–936. |
| [8] | SANKARIDURG P. Contact lenses to slow progression of myopia[J]. Clin Exp Optom, 2017, 100(5): 432–437. DOI:10.1111/cxo.12584 |
| [9] | IRVING E L, YAKOBCHUK-STANGER C. Myopia progression control lens reverses induced myopia in chicks[J]. Ophthalmic Physiol Opt, 2017, 37(5): 576–584. DOI:10.1111/opo.12400 |
| [10] | PARK G B, KIM D. Cigarette smoke-induced EGFR activation promotes epithelial mesenchymal migration of human retinal pigment epithelial cells through regulation of the FAK-mediated Syk/Src pathway[J]. Mol Med Rep, 2018, 17(3): 3563–3574. |
| [11] | IRNATEN M, ZHDANOV A, BRENNAN D, et al. Activation of the NFAT-calcium signaling pathway in human lamina cribrosa cells in glaucoma[J]. Invest Ophthalmol Vis Sci, 2018, 59(2): 831–842. DOI:10.1167/iovs.17-22531 |
| [12] | 张兰兰, 刘琼, 于健, 等. 转化生长因子-β(TGF-β)影响豚鼠巩膜成纤维细胞增殖和α-平滑肌肌动蛋白(α-SMA)表达的研究[J]. 眼科新进展, 2016, 36(11): 1011–1015. |
| [13] | WEI Q, LIU Q, REN C, et al. Effects of bradykinin on TGF β1 induced epithelial mesenchymal transition in ARPE 19 cells[J]. Mol Med Rep, 2018, 17(4): 5878–5886. |
| [14] | VALLÉE A, LECARPENTIER Y, GUILLEVIN R, et al. Interactions between TGF-β1, canonical WNT/β-catenin pathway and PPAR γ in radiation-induced fibrosis[J]. Oncotarget, 2017, 8(52): 90579–90604. |
| [15] | MAZZONI J, SMITH J R, SHAHRIAR S, et al. The Wnt inhibitor apcdd1 coordinates Vascular remodeling and barrier maturation of retinal blood vessels[J]. Neuron, 2017, 96(5): 1055–1069. DOI:10.1016/j.neuron.2017.10.025 |
| [16] | ZHANG B X, SHEN C F, GE F Y, et al. Epigenetically controlled Six3 expression regulates glioblastoma cell proliferation and invasion alongside modulating the activation levels of WNT pathway members[J]. J Neurooncol, 2017, 133(3): 509–518. DOI:10.1007/s11060-017-2476-y |
| [17] | GONG Y Y, PENG M Y, YIN D Q, et al. Long non-coding RNA H19 promotes the osteogenic differentiation of rat ectomesenchymal stem cells via Wnt/β-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(24): 8805–8813. |
| [18] | MA S, LEI Y, ZHANG L, et al. Research on the inhibiting effect of tanshinone ⅡA on colon cancer cell growth via COX-2-Wnt/β-catenin signaling pathway[J]. J BUON, 2018, 23(5): 1337–1342. |
| [19] | LIU M, GAO X, LIU C L. Increased expression of lncRNA FTH1P3 promotes oral squamous cell carcinoma cells migration and invasion by enhancing PI3K/Akt/GSK3b/Wnt/β-catenin signaling[J]. Eur Rev Med Pharmacol Sci, 2018, 22(23): 8306–8314. |
| [20] | GAO L, XU F M, SHI W J. High-glucose promotes proliferation of human bladder cancer T24 cells by activating Wnt/β-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(23): 8151–8160. |
| [21] | MA M M, ZHANG Z W, DU E G, et al. Wnt signaling in form deprivation myopia of the mice retina[J]. PLoS One, 2014, 9(4): e91086. DOI:10.1371/journal.pone.0091086 |
 2019, Vol. 45
2019, Vol. 45


