扩展功能
文章信息
- 杨东伟, 桂雨农
- YANG Dongwei, GUI Yunong
- BRD4基因对TGF-β1诱导的心肌细胞凋亡和p38MAPK信号通路的影响
- Effects of BRD4 gene on apoptosis and p38MAPK signaling pathway of cardiomyocytes induced by TGF-β1
- 吉林大学学报(医学版), 2019, 45(04): 855-860
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 855-860
- 10.13481/j.1671-587x.20190419
-
文章历史
- 收稿日期: 2019-03-08
2. 新乡医学院全过程教学基地, 河南 新乡 453000
2. Whole Process Teaching Base, Xinxiang Medical College, Xinxiang 453000, China
转化生长因子β1 (transforming growth factor-β1,TGF-β1)是TGF-β超家族的重要分子之一,是一种调控细胞生长的重要细胞因子,参与细胞增殖、细胞凋亡、胚胎发生、免疫调节及骨髓造血等过程的调控[1]。研究[2-3]表明:TGF-β1参与心力衰竭、心肌梗死、心肌肥厚和心肌病等多种心血管疾病的发生发展。心肌细胞凋亡贯穿于心血管疾病发生发展的整个过程[4],因此抑制TGF-β1诱导的心肌细胞凋亡对于心血管疾病治疗具有重要意义。溴结构域蛋白4(bromodomain-containing protein 4,BRD4)是溴结构域和超末端结构家族成员,可通过招募不同的转录因子调节靶基因表达,在炎症、细胞周期和细胞基因转录等调节过程中发挥重要作用[5]。目前BRD4在心血管疾病中的研究较少,有研究[6]显示:抑制BRD4表达可通过核因子κB(NF-κB)信号降低心肌梗死模型大鼠心肌细胞凋亡率。提示BRD4可能在心血管疾病发生发展过程中起重要作用。本研究采用TGF-β1诱导建立心肌细胞凋亡模型,观察细胞活力和细胞凋亡率变化,研究抑制BRD4表达对TGF-β1诱导的大鼠H9c2心肌细胞凋亡的影响,并初步探讨其作用机制。
1 材料与方法 1.1 细胞株、主要试剂和仪器大鼠心肌细胞株H9c2购自中科院上海细胞研究所细胞库。DMEM培养基和胎牛血清(FBS)均购自美国Gibco公司,LipofectamineTM2000试剂盒购自美国Invitrogen公司,TGF-β1和MTT试剂盒购自美国Sigma公司,Annexin Ⅴ-FITC/PI双染细胞凋亡试剂盒购自南京凯基公司,BRD4、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase3)、P38和磷酸化P38(p-P38)抗体均购自美国CST公司。FC型酶标仪购自美国Thermo公司。
1.2 细胞培养H9c2细胞置于含10% FBS的DMEM完全培养液中,于37℃恒温、5%CO2和饱和湿度培养箱培养。生长至对数期的细胞用于实验。
1.3 实验分组和处理首先将H9c2细胞分为空白对照组、si-CN组(转染阴性对照siRNA)和si-BRD4组(转染BRD4特异性siRNA), 采用Western blotting法检测各组细胞中BRD4蛋白表达水平。再将H9c2细胞随机分为对照组、TGF-β1组、si-NC+TGF-β1组和si-BRD4+TGF-β1组。对照组:细胞常规培养;TGF-β1组:20μg·L-1TGF-β1处理细胞24 h;si-NC+TGF-β1组:细胞转染阴性对照siRNA后,采用TGF-β1处理细胞24 h;si-BRD4+TGF-β1组:细胞转染BRD4特异性siRNA后,采用TGF-β1处理细胞24h。siRNA转染前24 h,接种H9c2心肌细胞于6孔板(每孔3.5×105个细胞),细胞密度达80%~90%时进行转染,转染参照LipofectamineTM2000试剂盒说明书进行。
1.4 Western blotting法检测细胞中BRD4、Bcl-2、Bax、Cleaved caspase3、P38和p-P38蛋白表达水平各组细胞加适量细胞裂解液,冰上裂解反应30 min,离心,弃掉上清液,BCA法测定总蛋白浓度。蛋白与上样缓冲液混匀,100℃变性5 min。取40 μg蛋白上样,经10% SDS-PAGE电泳分离,电泳后电转至PVDF膜,5%脱脂奶粉封闭膜1 h,加BRD4、Bcl-2、Bax、Cleaved caspase3、P38和p-P38抗体(1:500稀释),4℃孵育过夜,洗膜,加HRP标记的二抗(1:2000稀释),室温孵育2 h,洗膜,ECL化学发光剂显色,Quantity One软件分析各蛋白条带灰度值。以目的蛋白与内参GAPDH灰度值比值代表各蛋白的相对表达水平。实验重复3次。
1.5 细胞增殖活性检测以1×105 mL-1细胞接种对数生长期的H9c2细胞于96孔板,每孔200 μL细胞悬液,每组设置6个复孔,于培养箱内常规培养24 h后,按照上述分组方法处理细胞,处理结束后,每孔中加入20 μL MTT溶液,培养箱内常规孵育4 h,弃掉上清液,每孔中加入150 μL DMSO溶液,震荡10 min,使结晶能够溶解充分。酶标仪测定波长490 nm处的吸光度(A)值。细胞增殖活性=(实验组A值/对照组A值)× 100%。实验重复3次。
1.6 细胞凋亡率检测细胞分组和处理方法同1.3,离心,收集细胞,PBS洗涤细胞,加1×Binding buffer重悬细胞,然后分别加入Annexin Ⅴ-FITC和PI各5 μL,于培养箱内常规孵育1 h,通过BD FACScan流式细胞术检测各组细胞凋亡情况。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。每组设置3个重复,实验重复3次。
1.7 统计学分析采用SPSS21.0统计软件进行统计学分析。各组细胞增殖活性、凋亡率及BRD4、Bcl-2、Bax、Cleaved caspase3、P38和p-P38蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,两两多重比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组细胞中BRD4蛋白表达水平Western blotting法检测BRD4特异性siRNA转染的H9c2细胞BRD4蛋白表达水平,结果见图 1。空白对照组、si-NC组和si-BRD4组H9c2细胞中BRD4蛋白表达水平分别为0.563±0.051、0.556±0.050和0.129±0.015。si-BRD4组细胞中BRD4蛋白表达水平明显低于空白对照组(P < 0.05),si-NC组与空白对照组比较差异无统计学意义(P>0.05)。
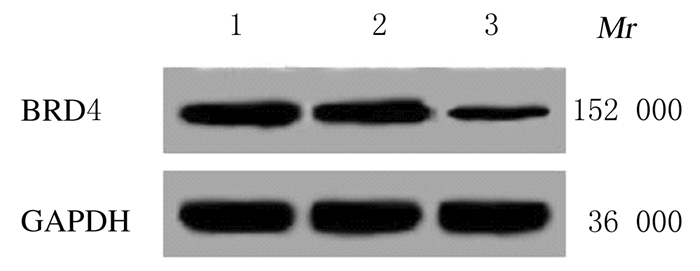
|
| Lane 1:Blank control group; Lane 2:si-NC group; Lane 3:si-BRD4 group. 图 1 转染si-BRD4的H9c2细胞中BRD4蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of BRD4 protein in H9c2 cells transfected with si-BRD4 |
|
|
与对照组比较,TGF-β1组细胞增殖活性明显降低(P < 0.05),细胞凋亡率明显升高(P < 0.05);与TGF-β1组比较,si-BRD4+TGF-β1组细胞增殖活性明显升高,细胞凋亡率降低(P < 0.05)。见图 2和表 1。

|
| A:Control group; B:TGF-β1 group; C:si-NC+TGF-β1 group; D:si-BRD4+TGF-β1 group. 图 2 流式细胞术检测各组H9c2细胞凋亡率 Fig. 2 Apoptotic rates of H9c2 cells in various groups detected by flow cytometry |
|
|
| (n=3, x±s) | ||
| Group | Proliferation activity | Apoptotic rate (η/%) |
| Control | 0.674±0.058 | 2.34±0.21 |
| TGF-β1 | 0.351±0.037* | 33.11±2.68* |
| si-NC+TGF-β1 | 0.362±0.035 | 32.29±2.54 |
| si-BRD4+TGF-β1 | 0.551±0.049△ | 14.49±0.89△ |
| F | 35.010 | 183.524 |
| P | < 0.001 | < 0.001 |
| *P < 0.05 compared with control group; △P < 0.05 compared with TGF-β1 group. | ||
与对照组比较,TGF-β1组H9c2细胞中Bcl-2蛋白表达水平明显降低(P < 0.05),Bax和Cleaved caspase3蛋白表达水平明显升高(P < 0.05);与TGF-β1组比较,si-BRD4+TGF-β1组H9c2细胞中Bcl-2蛋白表达水平明显升高(P < 0.05),Bax和Cleaved caspase3蛋白表达水平明显降低(P < 0.05)。见图 3和表 2。

|
| Lane1:Control group; Lane 2:TGF-β1 group; Lane 3:si-NC+TGF-β1 group; Lane 4:si-BRD4+TGF-β1 group. 图 3 各组H9c2细胞凋亡相关蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of apoptosis-related proteins in H9c2 cells in various groups |
|
|
| (n=3, x±s) | |||||
| Group | Bcl-2 | Bax | Cleaved caspase3 | P38 | p-P38 |
| Control | 0.525±0.051 | 0.104±0.012 | 0.110±0.013 | 0.665±0.061 | 0.021±0.005 |
| TGF-β1 | 0.093±0.010* | 0.321±0.032* | 0.052±0.007* | 0.652±0.060 | 0.106±0.012* |
| si-NC+TGF-β1 | 0.090±0.009 | 0.350±0.036 | 0.046±0.006 | 0.669±0.063 | 0.109±0.013 |
| si-BRD4+TGF-β1 | 0.334±0.032△ | 0.158±0.017△ | 0.096±0.010△ | 0.648±0.057 | 0.063±0.007△ |
| F | 139.342 | 63.493 | 34.260 | 0.084 | 53.507 |
| P | < 0.001 | < 0.001 | < 0.001 | 0.967 | < 0.001 |
| * P < 0.05 compared with control group; △P < 0.05 compared with TGF-β1 group. | |||||
与对照组比较,TGF-β1组H9c2细胞中p-P38蛋白表达水平升高(P < 0.05);与TGF-β1组比较,si-BRD4+TGF-β1组H9c2细胞中p-P38蛋白表达水平降低(P < 0.05)。各组细胞中P38蛋白表达水平比较差异无统计学意义(P>0.05)。见表 2和图 4。

|
| Lane 1:Control group; Lane 2:TGF-β1 group; Lane 3:si-NC+TGF-β1 group; Lane 4:si-BRD4+TGF-β1 group. 图 4 各组H9c2细胞中P38和p-P38蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of P38 and p-P38 proteins in H9c2 cells in various groups |
|
|
BRD4为溴结构域蛋白的一个主要成员,是一种特殊的染色体结合因子,与一般的核转录调节因子不同,可在有丝分裂的整个过程中始终结合到染色体上, 与乙酰化组蛋白结合,并招募其他染色体修饰蛋白,从而引起靶基因抑制或活化[7-8]。BRD4还可与乙酰化的组蛋白结合,调控基因转录、细胞周期及DNA复制等活动[9]。目前对BRD4的研究多集中于肿瘤方面,已有多项研究表明BRD4与肿瘤细胞生长有密切关联[10-11]。近年来研究[6]表明:抑制BRD4表达可降低心肌梗死模型大鼠心肌细胞凋亡率,提示BRD4与心肌细胞凋亡相关。但目前BRD4对心肌细胞的影响及其作用机制尚不完全清楚。本研究致力于探讨抑制BRD4对心肌细胞凋亡影响及其机制。
RNA干扰(RNA interference,RNAi)是一项可阻断特定基因表达的新技术,具有稳定性强、高效性和可传递性等特点,在基因调控和基因功能研究等领域中有广泛的应用,为基因治疗开辟了新的途径[12-13]。本研究将BRD4特异性siRNA转染H9c2细胞,结果显示:BRD4蛋白表达水平明显降低,说明成功建立了抑制BRD4表达的H9c2细胞模型。
TGF-β1是一种具有诱导生长能力的多肽因子,TGF-β1及受体在心肌间质细胞、心肌细胞中均有表达,在心血管疾病发生发展过程中有重要作用[14]。有研究[15-16]表明:血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)和神经肽Y(neuropeptide Y,NPY)等一些与高血压、心肌肥厚有关的体液因素均可刺激心肌细胞TGF-β1分泌,并可通过TGF-β1引起心肌肥大,血清中TGF-β1水平与高血压水平呈正相关关系。因此TGF-β1诱导可模拟心肌细胞凋亡[17]。本研究采用TGF-β1建立心肌细胞凋亡模型,细胞增殖活性和细胞凋亡率检测结果显示:TGF-β1可明显抑制H9c2细胞增殖活性,诱导细胞凋亡,而抑制BRD4表达可减弱这一效应,提示干扰BRD4对TGF-β1引起的心肌细胞损伤有保护作用。
细胞凋亡受到分子水平的调控。Caspase是一个关键的与细胞凋亡有关的酶家族,是细胞凋亡的执行者和介导者,其激活或表达超量可导致细胞凋亡,又称为凋亡蛋白酶。Caspase3是Caspase家族成员之一,位于Caspase级联反应下游,其激活可导致细胞凋亡不可逆,被认为是引起细胞凋亡的真正实施者[18]。Bcl-2和Bax均为Bcl-2家族成员,发挥抑凋亡和促凋亡作用,Bax可与Bcl-2形成异源二聚体,提高Bax表达可拮抗Bcl-2作用,两者互作可决定细胞是否继续存活[19]。心肌细胞凋亡与Caspase3、Bcl-2、Bax表达和Bcl-2/Bax比值有密切关联[20]。本研究结果显示:抑制BRD4表达可减弱TGF-β1对Bcl-2表达的抑制及对Bax和Cleaved caspase3表达的促进作用,提示BRD4可通过调节Bcl-2及Caspase家族相关蛋白表达影响心肌细胞凋亡。
P38-丝裂原活化蛋白激酶(MAPK)信号通路是体内一条重要的信号转导途径,涉及细胞生长、分化和发育等过程,与肿瘤、心血管疾病和炎症等多种疾病发生发展有密切关联[21]。P38丝裂原活化蛋白激酶(P38MAPK)是MAPK家族成员之一,卢永浩等[22]研究表明:Aβ-(25~35)可通过激活P38-MAPK信号通路促进大鼠心肌细胞凋亡,提示P38-MAPK信号通路激活可促进心肌细胞凋亡。本研究结果显示:抑制BRD4表达可减弱TGF-β1对p-P38蛋白表达的上调作用,提示干扰BRD4可通过抑制P38-MAPK信号通路减弱心肌细胞损伤。
综上所述,抑制BRD4基因表达可减弱TGF-β1诱导的心肌细胞凋亡,其机制可能与抑制P38-MAPK信号通路有关。目前BRD4在心血管疾病方面研究较少,值得进一步深入探讨。
| [1] | QIN G H, LUO M, CHEN J Z, et al. Reciprocal activation between MMP-8 and TGF-β1 stimulates EMT and malignant progression of hepatocellular carcinoma[J]. Cancer Lett, 2016, 374(1): 85–95. DOI:10.1016/j.canlet.2016.02.001 |
| [2] | DUBASH A D, KAM C Y, AGUADO B A, et al. Plakophilin-2 loss promotes TGF-β1/p38 MAPK-dependent fibrotic gene expression in cardiomyocytes[J]. J Cell Biol, 2016, 212(4): 425–438. DOI:10.1083/jcb.201507018 |
| [3] | KODO K, ONG S G, JAHANBANI F, et al. iPSC-derived cardiomyocytes reveal abnormal TGF-β signalling in left ventricular non-compaction cardiomyopathy[J]. Nat Cell Biol, 2016, 18(10): 1031–1042. DOI:10.1038/ncb3411 |
| [4] | BARILE L, LIONETTI V, CERVIO E, et al. Extracellular vesicles from human cardiac progenitor cells inhibit cardiomyocyte apoptosis and improve cardiac function after myocardial infarction[J]. Cardiovasc Res, 2014, 103(4): 530–541. DOI:10.1093/cvr/cvu167 |
| [5] | DEVAIAH B N, CASE-BORDEN C, GEGONNE A, et al. BRD4 is a histone acetyltransferase that evicts nucleosomes from chromatin[J]. Nat Struct Mol Biol, 2016, 23(6): 540–548. DOI:10.1038/nsmb.3228 |
| [6] | SUN Y, XIE Y, DU L, et al. Inhibition of BRD4 attenuates cardiomyocyte apoptosis via NF-κB pathway in a rat model of myocardial infarction[J]. Cardiovasc Therapeut, 2018, 36(2): e12320. DOI:10.1111/1755-5922.12320 |
| [7] | BLEE A M, LIU SJ, WANG L G, et al. BET bromodomain-mediated interaction between ERG and BRD4 promotes prostate cancer cell invasion[J]. Oncotarget, 2016, 7(25): 38319–38332. |
| [8] | SAKAMAKI J I, WILKINSON S, HAHN M, et al. Bromodomain protein BRD4 is a transcriptional repressor of autophagy and lysosomal function[J]. Mol Cell, 2017, 66(4): 517–532. DOI:10.1016/j.molcel.2017.04.027 |
| [9] | CHEUNG K L, ZHANG F, JAGANATHAN A, et al. Distinct roles of Brd2 and Brd4 in potentiating the transcriptional program for Th17 cell differentiation[J]. Mol Cell, 2017, 65(6): 1068–1080. DOI:10.1016/j.molcel.2016.12.022 |
| [10] | LIAO Y F, WU Y B, LONG X, et al. High level of BRD4 promotes non-small cell lung cancer progression[J]. Oncotarget, 2016, 7(8): 9491–9500. |
| [11] | GAO X M, WU X C, ZHANG X, et al. Inhibition of BRD4 suppresses tumor growth and enhances iodine uptake in thyroid cancer[J]. Biochem Biophys Res Commun, 2016, 469(3): 679–685. DOI:10.1016/j.bbrc.2015.12.008 |
| [12] | 郭爱叶, 胡金龙, 郭思, 等. 转染Chk1 siRNA的人胃癌SGC7901细胞对顺铂的敏感性[J]. 郑州大学学报:医学版, 2017, 52(6): 722–725. |
| [13] | ZHANG X X, CHENG X W, LAI Y Y, et al. Salmonella VNP20009-mediated RNA interference of ABCB5 moderated chemoresistance of melanoma stem cell and suppressed tumor growth more potently[J]. Oncotarget, 2016, 7(12): 14940–14950. |
| [14] | LV Y, LIU B, WANG H P, et al. Intramyocardial implantation of differentiated rat bone marrow mesenchymal stem cells enhanced by TGF-β1 improves cardiac function in heart failure rats[J]. Braz J Med Biol Res, 2016, 49(6): e5273. |
| [15] | 赵金红, 王伟, 张新金, 等. 促红细胞生成素抑制AngⅡ诱导的大鼠心肌细胞肥大及其可能的信号通路[J]. 基础医学与临床, 2014, 34(3): 295–300. |
| [16] | ZHANG R, NIU H F, KANG X H, et al. Long-Term administration of neuropeptide Y in the subcutaneous infusion results in cardiac dysfunction and hypertrophy in rats[J]. Cell Physiol Biochem, 2015, 37(1): 94–104. DOI:10.1159/000430336 |
| [17] | 沈宇腾, 张羽飞, 顾冬雪, 等. FGF-1对TGF-β1诱导的H9c2心肌细胞凋亡的影响及机制研究[J]. 牡丹江医学院学报, 2017, 38(1): 4–7. |
| [18] | 张瑞涛, 史惠蓉, 任芳, 等. CHK1-CDK1通路介导的G2/M检验点对卵巢癌细胞增殖和凋亡的影响[J]. 郑州大学学报:医学版, 2018, 53(2): 159–165. |
| [19] | TIAN X, SHI Y F, LIU N, et al. Upregulation of DAPK contributes to homocysteine-induced endothelial apoptosis via the modulation of Bcl2/Bax and activation of caspase 3[J]. Mol Med Rep, 2016, 14(5): 4173–4179. DOI:10.3892/mmr.2016.5733 |
| [20] | GAO C K, LIU H, CUI C J, et al. Roles of MicroRNA-195 in cardiomyocyte apoptosis induced by myocardial ischemia-reperfusion injury[J]. J Genet, 2016, 95(1): 99–108. |
| [21] | JIANG C K, GONG F. BMP-2 and icariin synergistically promote p38MAPK-mediated cardiomyocyte differentiation of mesenchymal stem cells via enhanced NOX4-driven ROS generation[J]. Med Chem Res, 2017, 26(10): 2547–2556. DOI:10.1007/s00044-017-1954-2 |
| [22] | 卢永浩, 吴昊, 张恒谦. Aβ-(25~35)通过激活p38MAPK信号通路促进大鼠心肌细胞凋亡[J]. 重庆医学, 2015, 44(34): 4771–4773, 4776. DOI:10.3969/j.issn.1671-8348.2015.34.007 |
 2019, Vol. 45
2019, Vol. 45
