扩展功能
文章信息
- 周丽程, 刘先发, 李强, 李蓉, 黄家淦, 张琼, 李晓飞
- ZHOU Licheng, LIU Xianfa, LI Qiang, LI Rong, HUANG Jiagan, ZHANG Qiong, LI Xiaofei
- 小檗碱联合辛伐他汀对动脉粥样硬化模型大鼠的抗动脉粥样硬化作用及其机制
- Anti-atherosclerosis effect of berberine combined with simvastatin in atherosclerosis model rats and its mechanism
- 吉林大学学报(医学版), 2019, 45(04): 849-854
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 849-854
- 10.13481/j.1671-587x.20190418
-
文章历史
- 收稿日期: 2018-09-27
2. 赣南医学院第二附属医院心血管内科, 江西 赣州 341000
2. Department of Cardiology, second affiliated hospital, Gannan Medical College, Ganzhou 341000, China
动脉粥样硬化(atherosclerosis,AS)是危害人类健康的一大类疾病,20世纪60年代,欧美等发达国家AS发病率大幅增加,成为常见流行病。目前,AS已成为危害人类健康的第一位杀手,成为冠心病的主要死因[1-2]。随着我国人民生活节奏、饮食结构和生活方式的改变,以及老龄化社会的到来,城市冠心病患者的死亡率高达34.3%,而在农村由冠心病导致的死亡率达到了22.7%[3-6]。目前临床治疗AS的方法主要为药物治疗、介入疗法和手术治疗,但长期服用西药的不良反应较多,严重的可引起心动过缓和心律失常等[7]。炎症反应贯穿AS发病的各个阶段,可能是多种致AS因素致病机制的共同环节或通路。血管内皮生长因子(vascular endothelial growth factor,VEGF)及转化生长因子β1(transforming growth factor-β1,TGF-β1)能促进血管内皮细胞分裂。白细胞介素18(interleukin-18,IL-18)和白细胞介素10 (interleukin-10,IL-10)共同参与AS的发生发展,调整炎性细胞因子的释放,改善AS预后。小檗碱又称黄连素,现代药理学研究[8-11]证实:小檗碱具有抗AS和调节糖脂代谢等作用。研究[12]证实:小檗碱可以抑制AS的形成,对AS具有良好的防治作用,但其作用机制尚未明确。迄今为止,国内外对小檗碱抗AS炎症的作用机制鲜有报道。本研究通过建立AS大鼠模型,探讨小檗碱联合辛伐他汀对AS模型大鼠血清和胸主动脉组织中VEGF、TGF-β1、IL-18和IL-10表达的影响,阐述小檗碱对AS的免疫炎症机制。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器清洁级SD大鼠52只,雄性,3~4周龄,体质量180~210 g,购于新疆医科大学动物中心,动物许可证号: SCXK(新)2016-0002。小檗碱(成都德思特生物技术有限公司),辛伐他汀(海正辉瑞制药有限公司),维生素D3(上海通用药业股份有限公司),VEGF兔抗鼠多克隆抗体、TGF-β1兔抗鼠多克隆抗体、IL-18兔抗鼠多克隆抗体和IL-10兔抗鼠多克隆抗体(北京博奥森生物技术有限公司),DAB显色试剂盒(深圳晶美生物工程有限公司),无水乙醇(国药集团化学试剂有限公司)。Neofuge 15R台式高速冷冻离心机(上海力新仪器有限公司),Olympus光学显微镜(日本BHS公司),DV800型全自动生化测定仪(美国Bechman公司),YNZ-35-50液氮生物容器(上海亚荣生化仪器厂)。
1.2 大鼠AS模型的制备和分组随机选取8只大鼠作为对照组,给予普通饲料喂养。其余大鼠参照文献[13]建立AS模型:大鼠腹腔注射维生素D3(70万IU·kg-1),12 h后开始高脂饲料喂饲,10周后腹腔注射2.5 mg·kg-1卵白蛋白致敏,每周3次,连续注射4周,随机取大鼠3只,处死,采集主动脉及心脏冠状动脉,置于4%多聚甲醛溶液中固定48 h,制备病理切片置于光学显微镜下观察病变,发现AS形成,提示建模成功。40只建模成功大鼠随机分为模型组,辛伐他汀组,低、中和高剂量小檗碱联合辛伐他汀组。模型组和对照组大鼠每天灌胃生理盐水,其余4组大鼠给予辛伐他汀溶液20 mg·kg-1·d-1灌胃,同时低、中和高剂量小檗碱联合辛伐他汀组大鼠再给予50、100和200 mg·kg-1·d-1小檗碱溶液灌胃,小檗碱及辛伐他汀剂量根据文献[8]换算成大鼠用量,连续给药4周。
1.3 标本采集和处理取材前大鼠禁食不禁水12 h,腹腔注射10%水合氯醛麻醉,内眦静脉取血5 mL,低温离心分离血清,存放-80℃冰箱备用。处死大鼠,剖开胸腹腔,取胸主动脉组织标本,生理盐水冲洗后置于4%多聚甲醛中固定,包埋,切片。
1.4 HE染色观察大鼠胸主动脉组织病理形态学表现取4%多聚甲醛固定的胸主动脉组织,常规石蜡包埋、切片及HE染色,光镜下观察胸主动脉组织的病理形态表现。
1.5 大鼠血清中血脂水平的检测采用全自动生物化学分析仪检测各组大鼠血清中总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平,单位为mmol·L-1。
1.6 大鼠血清中VEGF、TGF-β1、IL-18和IL-10水平检测取血清样品,通过全自动生化检测仪采用酶法及双抗体夹心ABC-ELISA法检测各组大鼠血清中VEGF、TGF-β1、IL-18和IL-10水平,单位为μg ·L-1。
1.7 免疫组织化学法检测大鼠胸主动脉组织中VEGF、TGF-β1、IL-18和IL-10蛋白表达水平取4%多聚甲醛固定的胸主动脉组织,常规进行脱水、石蜡包埋和切片,采用常规免疫组织化学法检测大鼠胸主动脉组织中VEGF、TGF-β1、IL-18和IL-10蛋白表达水平,步骤严格按照试剂盒说明书进行操作,利用显微镜图像软件系统采集图像,显微镜下以胸主动脉组织细胞质出现棕黄色颗粒者为阳性,采用Image-proplus分析软件统计阳性显色的平均积分光密度(IOD)值,即为阳性细胞VEGF、TF-β1、IL-18和IL-10蛋白相对表达水平。
1.8 统计学分析采用SPSS18.0统计软件进行统计学分析。各组大鼠血清中TC、TG、LDL-C、HDL-C、VEGF、TGF-β1、IL-18、IL-10水平和胸主动脉组织中VEGF、TGF-β1、IL-18、IL-10蛋白表达水平以x ±s表示,对各组数据进行正态性检验, 符合正态分布的数据组间比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠胸主动脉组织病理形态表现大鼠胸主动脉组织HE染色结果显示:对照组大鼠主动脉血管壁完整光滑,无脂质沉积现象,内膜无增生,中膜平滑厚薄均匀,无斑块形成。模型组大鼠主动脉内膜明显增厚,细胞内外有脂质沉积,内膜下可见坏死物沉积,内壁出现斑块、不平整,血管腔狭窄,提示造模成功。辛伐他汀组大鼠较模型组AS明显好转,内膜增厚减少,血管内壁可见小的斑块出现,动脉仍有小的狭窄段。高剂量小檗碱联合辛伐他汀组大鼠动脉血管壁无明显斑块出现,内膜增厚不平整明显改善。见图 1(插页六)。
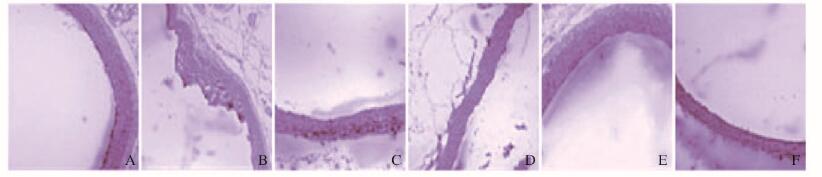
|
| A: Control group; B: Model group; C: Simvastatin group; D: Low dose of berberine combined with simvastatin group; E: Middle dose of berberine combined with simvastatin group: F: High dose of berberine combined with simvastatin group. 图 1 各组大鼠胸主动脉组织病理形态表现(HE,×200) Fig. 1 Pathomorphology of thoracic aorta tissue of rats in various groups (HE, ×200) |
|
|
与对照组比较,模型组大鼠血清中TC、TG和LDL-C水平均明显升高(P < 0.05或P < 0.01),HDL-C水平明显降低(P < 0.05)。与模型组比较,辛伐他汀组和不同剂量小檗碱联合辛伐他汀组大鼠血清中TC、TG和LDL-C水平明显降低(P < 0.05或P < 0.01),HDL-C水平明显升高(P < 0.05),高剂量小檗碱联合辛伐他汀组大鼠上述指标变化更明显。见表 1。
| [n=8, x±s, cB/(mmol·L-1)] | ||||
| Group | TC | TG | LDL-C | HDL-C |
| Control | 2.19±0.48 | 0.38±0.06 | 0.45±0.07 | 1.46±0.42 |
| Model | 5.21±0.55* | 2.49±0.19** | 5.43±0.41** | 0.67±0.11* |
| Simvastatin | 3.76±0.84△ | 0.77±0.42△△ | 1.68±0.51△ | 1.11±0.31△ |
| Berberine combined with simvastatin | ||||
| Low dose | 3.10±0.51△ | 0.75±0.22△ | 1.66±0.48△ | 1.37±0.50△ |
| Middle dose | 2.67±0.30△ | 0.43±0.09△ | 0.98±0.07△△ | 1.64±0.24△ |
| High dose | 2.04±0.19△ | 0.34±0.04△ | 0.46±0.06△△ | 1.82±0.31△ |
| *P < 0.05, ** P < 0.01 vs control group;△P < 0.05, △△P < 0.01 vs model group. | ||||
与对照组比较,模型组、辛伐他汀组和不同剂量小檗碱联合辛伐他汀组大鼠血清中VEGF、TGF-β1、IL-18和IL-10水平明显升高(P < 0.05);与模型组比较,辛伐他汀组及不同剂量小檗碱联合辛伐他汀组大鼠血清中VEGF和IL-18水平明显降低(P < 0.05或P < 0.01),TGF-β1和IL-10水平明显升高(P < 0.05)。见表 2。
| [n=8, x±s, ρB/(μg·L-1)] | ||||
| Group | VEGF | TGF-β1 | IL-18 | IL-10 |
| Control | 75.35±15.87 | 3.41±0.77 | 16.01±4.27 | 16.72±4.17 |
| Model | 254.87±40.41** | 8.33±1.01* | 66.79±8.31** | 25.18±2.99* |
| Simvastatin | 125.29±20.38△ | 11.71±2.47△ | 56.21±7.91△ | 41.22±8.35△ |
| Berberine combined with simvastatin | ||||
| Low dose | 117.45±18.12△ | 11.96±2.14△ | 52.31±5.84△ | 38.62±6.76△ |
| Middle dose | 86.74±13.29△△ | 13.47±2.01△ | 52.47±8.81△ | 35.89±6.02△ |
| High dose | 71.55±10.27△△ | 14.39±2.76△ | 50.64±7.94△ | 34.23±5.17△ |
| * P < 0.05, ** P < 0.01 vs control group; △P < 0.05, △△P < 0.01 vs model group. | ||||
大鼠胸主动脉组织中VEGF、TGF-β1、IL-18和IL-10均有阳性表达,主要表达于动脉内皮细胞胞浆,阳性染色为棕黄色。对照组大鼠VEGF、TGF-β1、IL-18、IL-10少量表达于血管。与对照组比较,模型组大鼠胸主动脉组织中VEGF和IL-18蛋白表达水平明显升高(P < 0.01),TGF-β1和IL-10蛋白表达水平明显降低(P < 0.05);与模型组比较,辛伐他汀组大鼠胸主动脉组织中IL-18蛋白表达水平明显降低(P < 0.05),TGF-β1蛋白表达水平明显升高(P < 0.05),不同剂量小檗碱联合辛伐他汀组大鼠胸主动脉组织中VEGF和IL-18表达水平均明显降低(P < 0.05或P < 0.01),TGF-β1和IL-10表达水平明显升高(P < 0.05)。见表 3和图 2(插页七)。
| (n=8, x±s) | ||||
| Group | VEGFprotein | TGF-β1 protein | IL-18 protein | IL-10 protein |
| Control | 13.52±3.08 | 15.23±2.34 | 8.52±3.04 | 16.66±3.08 |
| Model | 35.44±8.06** | 10.22±3.67* | 36.21±12.31** | 11.20±2.65* |
| Simvastatin | 33.24±10.21 | 19.21±3.02△ | 20.24±8.76△ | 15.22±4.92 |
| Berberine combined with simvastatin | ||||
| Low dose | 25.67±7.38△ | 18.59±4.22△ | 21.85±9.03△ | 15.84±5.32 |
| Middle dose | 23.45±9.53△ | 18.24±5.02△ | 18.56±8.72△ | 18.27±7.09△ |
| High dose | 18.24±8.32△△ | 19.03±4.87△ | 15.01±5.83△△ | 19.88±6.88△ |
| *P < 0.05, ** P < 0.01 vs control group.△P < 0.05, △△P < 0.01 vsmodel group. | ||||
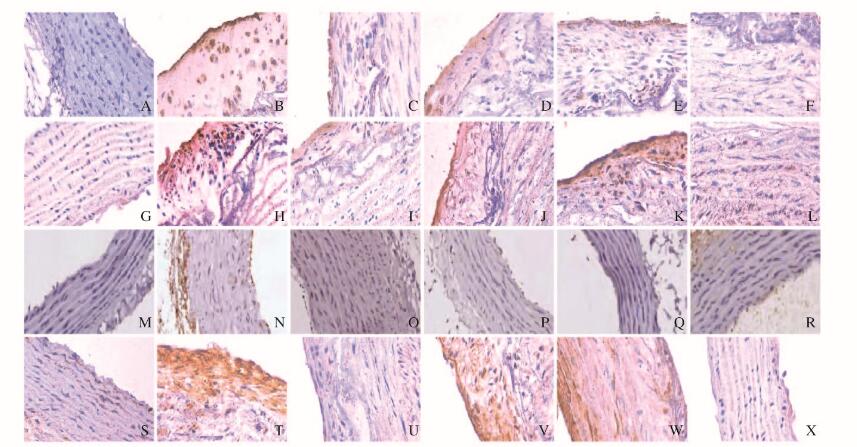
|
| A-F: VEGF; G-L: TGF-B1; M-R: IL-18; S-X: IL-10; A, G, M, S: Control group; B, H, N, T: Model group; C, I, O, U: Simvastatin group; D, , P, V: Low dose of berberine combined with simvastatin group; E, K, Q, w: Middle dose of berberine combined with simvastatin group; F, L, R, X: High dose of berberine combined with simvastatin group. 图 2 各组大鼠胸主动脉组织免疫组织化学染色结果(×400) Fig. 2 Immunohistochemistry staining results of thoracic aorta tissue of rats in various groups(×400) |
|
|
研究[14-15]显示:炎症因子介导的血管壁慢性炎症反应、血管内皮受损及其通透性、黏附性和血管再生等功能紊乱,是AS发生发展的重要机制。当损伤因素长期存在时,会产生大量炎症因子和细胞因子,进而引起大量细胞凋亡,最终导致粥样斑块的形成。因此,炎症反应是AS斑块脂质中心形成的重要因素之一。VEGF是一种作用于血管内皮细胞高度特异性的有丝分裂原,对维持正常血管内皮细胞功能以及修复受损内皮起重要的作用[16]。AS发生时,缺血缺氧的组织诱发多种细胞分泌VEGF,促使内皮细胞分裂、增殖,并促进炎性细胞在血管壁的黏附,促进新生血管在动脉粥样斑块中形成,进而加重AS[17]。TGF-β1属于细胞生长增殖调节蛋白,参与细胞功能的调节[18]。研究[19]表明:TGF-β1在动脉内皮的损伤、炎性细胞浸润、动脉壁脂质聚集以及细胞外基质的沉积等引起AS的过程中均发挥重要作用。也有研究[20]显示:TGF-β1可诱导内皮细胞产生前列环素,防止血小板聚集及血栓形成,发挥强大的非特异性抗炎作用,延缓AS的形成。本研究结果显示:模型组大鼠血清中VEGF水平和胸主动脉组织中VEGF蛋白表达水平增加,TGF-β1水平降低,证明AS模型大鼠炎症因子变化符合血管受损时的机体应激状态。血清IL-18是较强的致AS细胞因子,具有前炎症因子活性,参与斑块形成,增加斑块面积[21]。IL-10是一种多效细胞免疫因子,能抑制炎症因子的释放和产生,同时抑制细胞增生,具有非常强的免疫抑制和抗炎作用[22]。研究[23]显示:IL-18/IL-10代表机体炎性的动态平衡状态,是观察AS斑块稳定性的重要指标。血脂代谢异常是AS发病的重要因素,与AS的发生发展有着密切的关系,能够反映AS的病变水平。本实验证明:模型组大鼠IL-18和IL-10水平的变化符合AS发病时IL-18和IL-10水平变化的规律。
小檗碱联合辛伐他汀在临床上可用于治疗脑梗死和调节血脂,但是对于其联合应用的作用机制尚不明确。本实验中的HE染色结果显示:辛伐他汀组大鼠AS较模型组明显好转,内膜增厚减少,血管内壁可见小的斑块出现,动脉仍有小的狭窄段,而高剂量小檗碱联合辛伐他组大鼠胸主动脉血管壁无明显斑块出现,内膜增厚不平整明显改善,表明小檗碱联合辛伐他汀可明显抑制AS斑块的形成,对辛伐他汀改善内皮血管的修复功能具有一定的增效作用,采用中西药结合的方法对于大鼠可以达到标本兼顾的治疗作用。本研究结果显示:辛伐他汀组和不同剂量小檗碱联合辛伐他汀组大鼠血清中TC、TG和LDL-C水平明显降低,同时HDL-C明显升高,提示小檗碱具有明显的降脂作用,HDL-C水平提高有利于外周组织清除胆固醇,从而防止AS的形成,结合组织病理学形态观察,提示小檗碱能够通过调节脂质代谢,抑制AS斑块的形成;同时,与模型组比较,不同剂量小檗碱联合辛伐他汀组大鼠血清和胸主动脉组织中VEGF、TGF-β1、IL-18和IL-10水平和蛋白表达水平均有明显的改变,提示小檗碱联合辛伐他汀可能是通过下调VEGF和IL-18水平、上调TGF-β1和IL-10水平,发挥治疗AS的作用。
综上所述,VEGF、TGF-β1、IL-18和IL-10可能成为免疫调节治疗AS的新部位和新靶点,因此寻找能直接抑制VEGF、IL-18活性,同时提升TGF-β1和IL-10水平的基因药物是生物医药科研领域一个重要的研究方向。
| [1] | BONOW R O, SMAHA L A, SMITH S C JR, et al. World Heart Day 2002:the international burden of cardiovascular disease:responding to the emerging global epidemic[J]. Circulation, 2002, 106(13): 1602–1605. DOI:10.1161/01.CIR.0000035036.22612.2B |
| [2] | 张建彬.颈动脉和冠状动脉粥样硬化并存疾病的流行病学及临床治疗研究[D].北京: 北京协和医学院, 2017. |
| [3] | 刘俊田. 动脉粥样硬化发病的炎症机制的研究进展[J]. 西安交通大学学报:医学版, 2015, 36(2): 141–152. |
| [4] | YANG W, LU J, WENG J, et al. Prevalence of diabetes among men and women in China[J]. N Eng1 J Med, 2010, 362(12): 1090–1101. DOI:10.1056/NEJMoa0908292 |
| [5] | 张珺, 陈嘉龙, 王思雯. Homer1及炎症细胞因子在冠心病患者外周血白细胞中的mRNA表达水平研究[J]. 现代医学, 2017, 45(10): 1475–1478. |
| [6] | 刘强, 宇辉. 颈动脉粥样硬化斑块及血清炎症因子与老年脑梗死发病的相关性分析[J]. 山东医药, 2017, 57(45): 98–100. DOI:10.3969/j.issn.1002-266X.2017.45.033 |
| [7] | WEBER C, NOELS H. Atherosclerosis:current pathogenesis and therapeutic options[J]. Nat Med, 2011, 17(11): 1410–1422. DOI:10.1038/nm.2538 |
| [8] | 吴威. 盐酸小檗碱联合阿托伐他汀治疗急性脑梗死的疗效及对颈动脉粥样硬化斑块的影响[J]. 中国老年学杂志, 2016, 36(18): 4459–4460. DOI:10.3969/j.issn.1005-9202.2016.18.025 |
| [9] | 陈坚, 刘杰. 小檗碱的临床新用途及其作用机制研究进展[J]. 上海医药, 2016, 37(3): 26–30. |
| [10] | 郭会敏, 栾天竹, 梁兆光. 小檗碱抗动脉粥样硬化机制的研究进展[J]. 心血管病学进展, 2018, 39(1): 72–75. |
| [11] | 李晓明, 王青竹, 石婧, 等. 小檗碱改善动脉粥样硬化小鼠的血管炎性反应和钙化[J]. 基础医学与临床, 2018, 38(2): 163–168. DOI:10.3969/j.issn.1001-6325.2018.02.004 |
| [12] | 李旸, 王晓华, 吴晓琴, 等. 小檗碱抗动脉粥样硬化作用及其机制研究进展[J]. 医学与哲学(B), 2018, 39(11): 64–67. |
| [13] | 张福庄, 陶红, 王国宏, 等. 肥胖动脉粥样硬化大鼠模型的建立及验证[J]. 现代生物医学进展, 2017, 17(35): 6801–6805, 6827. |
| [14] | ROTELLA C M, ZANINELLI A, LE GRAZIE C, et al. Ezetimibe/simvastatin vs simvastatin in coronary heart disease patients with or withoutdiabetes[J]. Lipids Health Dis, 2010, 9: 80. DOI:10.1186/1476-511X-9-80 |
| [15] | BYEON H E, UM S H, YIM J H, et al. Ohioensin F suppresses TNF-α-induced adhesion molecule expression by inactivation of the MAPK, Akt and NF-κB pathways in vascular smooth muscle cells[J]. Life Sci, 2012, 90(11/12): 396–406. |
| [16] | 刘永萍, 杨如意. 蒲参胶囊联合辛伐他汀对老年动脉粥样硬化患者临床疗效及血清VEGF、TGF-β1、TNF-α和IL-6水平的影响[J]. 中国地方病防治杂志, 2018, 33(6): 685–688. |
| [17] | 江海宙, 苏兰利. TNF-α与常见血管类疾病的关系[J]. 健康研究, 2018, 38(5): 529–531, 537. DOI:10.3969/j.issn.1674-6449.2018.05.015 |
| [18] | 丽群, 耿爱华. 转化生长因子β_1在不同程度冠状动脉粥样硬化中表达变化的意义[J]. 中西医结合心脑血管病杂志, 2018, 16(5): 660–661. |
| [19] | CASTANARES C, REDOND-HORCAJO M, MAGAN-MARCHAL N, et al. Signaling by ALK5mediates TGF-β-induced ET-l expression in endothelial cells:a role for migration and proliferation[J]. J Cell Sci, 2007, 20(7): 1256–1266. |
| [20] | 李文, 胡继红, 李兴国, 等. KLF6通过上调TGF-β1诱导静脉内皮细胞endoglin, P-selectin表达, 引发血小板粘附、聚集, 促进TDVT形成的实验研究[J]. 中国矫形外科杂志, 2011, 19(16): 1365–1368. |
| [21] | 叶迪, 王梦龙, 刘剑芳, 等. 促炎性细胞因子白细胞介素-18在心血管疾病中的意义[J]. 中国循证心血管医学杂志, 2018, 10(8): 1006–1008. DOI:10.3969/j.issn.1674-4055.2018.08.33 |
| [22] | 朱太卿, 张莉峰, 袁学谦, 等. 颈动脉粥样硬化患者外周血细胞因子IFN-Y和IL-10水平的研究[J]. 中国实用神经疾病杂志, 2014, 17(5): 49–50. |
| [23] | 张琼, 陈慎, 王亚林. 白介素6、白介素10及白介素18在急性冠脉综合征患者中的表达及其临床意义[J]. 中国全科医学, 2016, 19(S1): 126–127. |
 2019, Vol. 45
2019, Vol. 45


