扩展功能
文章信息
- 张晓璇, 朱江, 李佳佳, 焦光美, 单海雷, 赵亮, 窦志杰
- ZHANG Xiaoxuan, ZHU Jiang, LI Jiajia, JIAO Guangmei, SHAN Hailei, ZHAO Liang, DOU Zhijie
- 丁苯酞对急性缺血性脑卒中大鼠的脑保护作用及其机制
- Protective effect of butylphthalide on brain in rats with acute ischemic stroke and its mechanism
- 吉林大学学报(医学版), 2019, 45(04): 843-848
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 843-848
- 10.13481/j.1671-587x.20190417
-
文章历史
- 收稿日期: 2018-10-19
缺血性脑卒中是最常见的脑血管病事件,可引起患者肢体残疾和认知功能障碍等,严重影响患者的生活质量。缺血性脑卒中的重要病变基础为脑动脉狭窄闭塞,脑缺血的治疗核心为血管再通和神经元损伤的保护。溶栓治疗常不能及时应用,且溶栓有诸多禁忌证,溶栓过程中有出现脑缺血再灌注损伤的可能,因此对缺血性脑卒中后的神经保护具有重要意义[1]。然而,临床上外源性神经保护剂效果并不明显,寻找内源性神经保护措施是一种新的研究思路。丁苯酞是一种我国自主研发的化学合成的新药,研究[2-3]表明:丁苯酞能通过多个病理环节阻断脑组织缺血性损害的发生发展,对于急性缺血性脑卒中具有明显治疗作用,但国内外研究对于其作用靶点和机制尚未阐明。肝细胞生长因子(hepatocyte growth factor,HGF)具有多种生物活性,能刺激血管生成[4]。本文作者通过对缺血性脑卒中大鼠脑组织中HGF、血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶2 (matrix metalloproteinase 2,MMP-2)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、核转录因子κB抑制蛋白α(IκBα)和核转录因子κB亚单位p65(NF-κB p65)蛋白及mRNA表达水平进行研究,探讨丁苯酞对缺血性脑卒中大鼠脑保护作用的可能机制。
1 材料与方法 1.1 实验动物、药品和主要试剂雄性、清洁级、健康SD大鼠48只,体质量260~300 g,购自上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2007-0005。丁苯酞注射液(石药集团恩必普药业有限公司,批号:618150411)。苏木素和伊红(国药集团化学试剂有限公司),BCA试剂盒、HGF单克隆抗体、VEGF单克隆抗体、MMP-2单克隆抗体、MMP-9单克隆抗体、IκBα单克隆抗体、NF-κB p65单克隆抗体、HRP标记的山羊抗兔抗体和β-actin抗体(美国Sigma公司),TTC试剂(美国Gibco公司)。HGF、VEGF、MMP-2、MMP-9、IκBα和NF-κB p65引物设计和合成由上海生物工程技术有限公司完成。
1.2 大鼠分组和模型制备48只大鼠根据随机分为假手术组、模型组和丁苯酞组,每组16只。模型组和丁苯酞组大鼠采用改良ZeaLonga法制备局灶性脑缺血大鼠模型:大鼠麻醉成功后剪开额顶部皮肤,暴露颅骨前囟和左侧半颅骨,采用激光多普勒血流仪记录左侧大脑中动脉供血区血流情况至血流数值平稳,将大鼠仰卧位固定,取颈部正中切口剪开皮肤,暴露分离颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉近心端和颈外动脉,动脉夹夹闭远端颈内动脉,显微剪刀在距颈内动脉分叉1 cm处剪一切口,将头端涂上硅胶的尼龙线自左侧颈总动脉插入颈内动脉至有少许阻力,线栓到达大脑中动脉分叉处,激光多普勒血流仪显示大脑中动脉血流下降至基础值的20%~30%表示栓塞成功,然后固定线栓,缝合伤口,缺血2 h回抽线栓,恢复再灌注,局灶性脑缺血大鼠模型制备完成。假手术组大鼠不结扎和插线,其余步骤同模型组。建模成功的标准为提尾悬空实验阳性、同侧眼裂减小、向对侧转弯和对侧肢体瘫痪。实验过程中,假手术组大鼠无死亡,模型组和丁苯酞组大鼠各死亡1只,模型组大鼠1只建模失败,予以排除。建模成功后,丁苯酞组大鼠每天腹腔注射丁苯酞注射液4.5 mg·kg-11次,假手术组和模型组大鼠每天腹腔注射等量生理盐水,共2周。
1.3 各组大鼠神经症状评分及脑梗死面积百分率测定用药结束后对各组大鼠进行神经症状评分:无神经缺损症状为0分,健侧前爪不能完全伸展为1分,向健侧转圈为2分,向健侧倾倒为3分,意识丧失、不能自发行走为4分。以平均分作为神经症状评分结果。大鼠麻醉成功后快速取出大脑放冰箱中预冷10 min,将大鼠大脑切成6片,放在TTC磷酸盐缓冲液中染色,被染成红色的为正常脑细胞,不被染色的为梗死脑细胞。每只大鼠取4个视野计算脑梗死面积,脑梗死面积百分率=脑梗死面积/脑组织总面积×100%。
1.4 各组大鼠脑组织HE染色麻醉大鼠,打开腹腔、暴露心脏,将针扎入大鼠左心尖,将右心耳剪口,采用注射器灌注生理盐水200 mL,再灌注4%多聚甲醛200 mL,取出大鼠大脑,石蜡包埋脑组织,将石蜡块切成厚4 μm切片,进行常规HE染色。
1.5 Western blotting法检测大鼠脑组织中HGF、VEGF、MMP-2、MMP-9、IκBα和NF-κB p65蛋白表达水平将各组大鼠脑组织放入EP管中、加入蛋白裂解液研磨均匀,13 000 r·min-1离心15 min,留取上清液,采用BCA法测定脑组织蛋白浓度,采用Western blotting法测定大鼠脑组织中上述6种蛋白表达水平,以目标蛋白单克隆抗体为一抗,以β-actin为内参照,以HRP标记的山羊抗兔抗体为二抗。目标蛋白的相对表达水平=目标蛋白条带灰度值/β-actin条带灰度值。
1.6 RT-PCR法检测大鼠脑组织中HGF、VEGF、MMP-2、MMP-9、IκBα和NF-κB p65mRNA表达水平取100g脑组织在冰上匀浆器中剪碎,加入TRIzol研磨混匀,提取脑组织总RNA,采用RT-PCR法测定各组大鼠脑组织中上述6种因子mRNA表达水平。PCR反应条件:95℃、5 min;95℃、15 s,56℃、30 s,72℃、15 s,共45个循环;72℃、5 min。以β-actin为内参,大鼠脑组织6种因子mRNA相对表达水平以2-ΔΔCt表示。
1.7 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠神经功能评分、脑梗死面积百分率和脑组织中HGF、VEGF、MMP-2、MMP-9、IκBα和NF-κB p65蛋白及mRNA表达水平以x±s表示,所有数据均符合正态分布,3组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
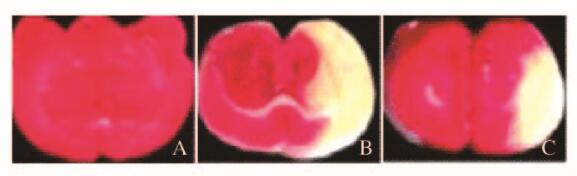
2 结果 2.1 各组大鼠神经功能评分和脑梗死面积百分率假手术组大鼠未出现神经功能缺损症状,神经功能评分为0分,模型组和丁苯酞组大鼠均出现神经功能缺损症状,表现为左侧瘫痪、身体蜷缩、身体平衡力下降、倾倒和旋转等,丁苯酞组大鼠神经功能评分明显低于模型组(P < 0.01)。假手术组大鼠脑组织呈均一性红色,无梗死灶形成;模型组和丁苯酞组大鼠脑组织均出现白色点片状梗死灶,丁苯酞组大鼠脑梗死面积百分率明显小于模型组(P < 0.01)。见表 1和图 1(插页六)。
| (x±s) | |||
| Group | n | Neurological function score | Percentage of cerebral infarction area (η/%) |
| Sham operation | 16 | 0.15±0.02 | 8.54±0.78 |
| Model | 14 | 2.93±0.24* | 31.24±1.17* |
| Butylphthalide | 15 | 0.95±0.12*△ | 14.63±0.82*△ |
| F | 28.399 | 44.525 | |
| P | < 0.01 | < 0.01 | |
| *P < 0.01 compared with sham operation group; △P < 0.01 compared with model group. | |||
|
| A: Sham operation group; B: Model group; C: Butylphthalide group. 图 1 各组大鼠脑组织TTC染色结果 Fig. 1 Results of ttc staining of brain tissue of rats in various groups |
|
|
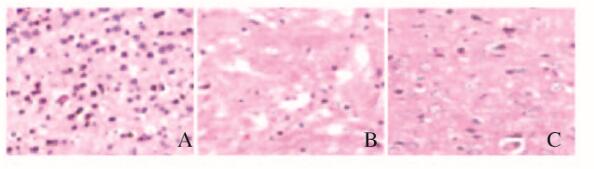
假手术组大鼠脑组织细胞结构完整、分布均匀;模型组大鼠脑组织细胞结构间隙增宽,大部分细胞坏死,胞浆破裂,细胞核破裂、凝缩;丁苯酞组大鼠脑组织有少量细胞肿胀和坏死。见图 2(插页六)。
|
| A: Sham operation group; B: Model group; C: Butylphthalide group. 图 2 各组大鼠脑组织形态表现(HE,×100) Fig. 2 Morphology of brain tissue of rats in various groups (HE, ×100) |
|
|
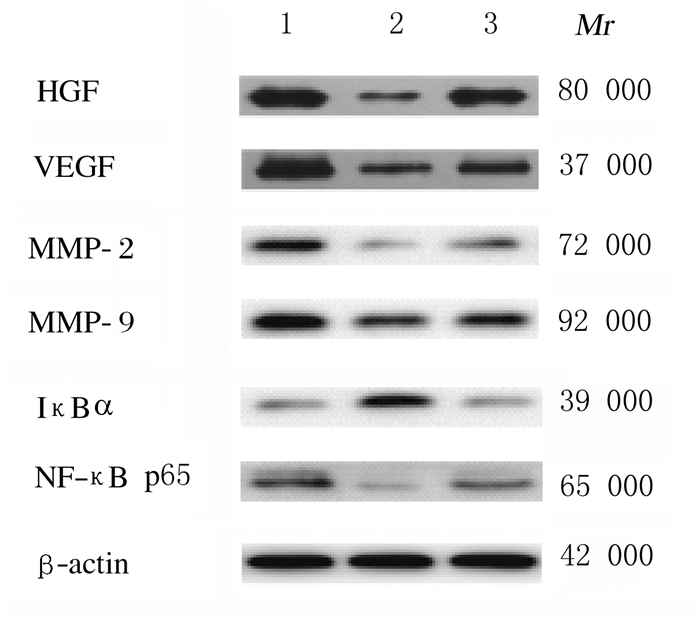
各组大鼠脑组织中HGF、VEGF、MMP-2、MMP-9、IκBα和NF-κB p65蛋白表达水平比较差异有统计学意义(P < 0.01)。与假手术组比较,模型组和丁苯酞组大鼠脑组织中的HGF、VEGF、MMP-2、MMP-9和NF-κB p65蛋白表达水平明显降低(P < 0.01),而IκBα蛋白表达水平明显升高(P < 0.01);与模型组比较,丁苯酞组大鼠脑组织中HGF、VEGF、MMP-2、MMP-9和NF-κB p65蛋白表达水平明显升高(P < 0.01),而IκBα蛋白表达水平明显降低(P < 0.01)。见表 2和图 3。
| (x±s) | |||||||
| Group | n | HGF protein | VEGF protein | MMP-2 protein | MMP-9 protein | IκBα protein | NF-κB p65 protein |
| Sham operation | 16 | 0.83±0.14 | 0.91±0.17 | 0.51±0.09 | 0.36±0.08 | 0.41±0.09 | 0.78±0.14 |
| Model | 14 | 0.42±0.13* | 0.38±0.07* | 0.24±0.05* | 0.09±0.01* | 0.78±0.11* | 0.31±0.07* |
| Butylphthalide | 15 | 0.67±0.15*△ | 0.55±0.12*△ | 0.37±0.08*△ | 0.21±0.05*△ | 0.63±0.08*△ | 0.52±0.11*△ |
| F | 32.055 | 66.844 | 47.093 | 87.314 | 59.545 | 66.371 | |
| P | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | |
| *P < 0.01 compared with sham operation group;△P < 0.01 compared with model group. | |||||||
|
| Lane 1: Sham operation group; Lane 2: Model group; Lane 3:Butyl phthalide group. 图 3 Western blotting法检测各组大鼠脑组织中HGF、VEGF、MMP-2、MMP-9、IκBα和NF-κB p65蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of HGF, VEGF, MMP-2, MMP-9, IκBα, and NF-κB p65 proteins in brain tissue of rats in various groups detected by Western blotting method |
|
|
各组大鼠脑组织中HGF、VEGF、MMP-2、MMP-9、IκBα和NF-κB p65mRNA表达水平比较差异均有统计学意义(P < 0.01)。与假手术组比较,模型组和丁苯酞组大鼠脑组织中的HGF、VEGF、MMP-2、MMP-9和NF-κB p65 mRNA表达水平明显降低(P < 0.01),IκBα mRNA表达水平明显升高(P < 0.01);与模型组比较,丁苯酞组大鼠脑组织中HGF、VEGF、MMP-2、MMP-9和NF-κB p65 mRNA表达水平明显升高(P < 0.01),IκBα mRNA表达水平明显降低(P < 0.01)。见表 3。
| (x±s) | |||||||
| Group | n | HGF mRNA | VEGF mRNA | MMP-2 mRNA | MMP-9 mRNA | IκBα mRNA | NF-κB p65 mRNA |
| Sham operation | 16 | 1.00±0.01 | 1.00±0.01 | 1.00±0.03 | 1.00±0.02 | 1.00±0.02 | 1.00±0.03 |
| Model | 14 | 0.53±0.08* | 0.43±0.09* | 0.31±0.06* | 0.47±0.07* | 2.24±0.31* | 0.54±0.11* |
| Butylphthalide | 15 | 0.79±0.13*△ | 0.64±0.11*△ | 0.59±0.012*△ | 0.81±0.09*△ | 1.79±0.21*△ | 0.83±0.14*△ |
| F | 107.860 | 191.165 | 291.251 | 244.322 | 133.751 | 75.467 | |
| P | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | |
| * P < 0.01 compared with sham operation group; △ P < 0.01 compared with model group. | |||||||
急性缺血性脑卒中是比较复杂的神经系统疾病之一,近年来脑卒中防治方面的研究取得了很大进步,丁苯酞为神经保护药物,在缺血性脑卒中的治疗中取得较好效果,可保护缺血引起的神经细胞损伤抑制神经细胞凋亡,改善患者的神经功能和认知功能障碍。但丁苯酞的治疗机制尚不十分清楚,可能通过改善线粒体功能、抗自由基、抑制细胞内钙超载、降低脑水肿、抗细胞凋亡和抑制炎症反应等多重作用发挥神经保护作用[5-6]。近年来研究[7-8]显示:丁苯酞可促进脑缺血去VEGF表达,促进微血管新生,保护血管内皮细胞,因此考虑其具有增加缺血区血管数量,在血管重构方面具有重要作用。HGF具有多种生物学功能,可促进细胞分裂、迁移和形态变化,在神经系统形态功能变化中具有重要作用;HGF与肝细胞生长因子受体c-met结合发挥作用,可以作用于内皮细胞等多种靶细胞[9];HGF与受体结合作用于内皮细胞而发挥血管生成作用,HGF在缺血损伤组织中分泌增加,促进损伤血管内皮细胞增生和修复,加快侧支循环的建立[10-11]。本研究结果显示:丁苯酞可改善急性缺血性脑卒中大鼠的神经功能,减少脑梗死面积,升高脑组织中HGF表达水平,推测丁苯酞可能通过升高脑组织中HGF表达水平,作用于内皮细胞,促进血管生成,从而发挥对急性缺血性脑卒中大鼠的脑保护作用。
新生血管的形成主要依赖促血管生成因子的作用,VEGF为作用最强、特异性最高的促血管生成因子,在多种因素作用下,VEGF表达水平升高可促进血管新生[12-13]。血管基底膜和细胞外基质蛋白的降解对血管新生也具有重要作用,MMP-2和MMP-9可降解细胞外基质蛋白和血管基底膜,细胞外基质蛋白和血管基底膜的降解对血管内皮细胞的迁移具有重要作用,因此二者在血管新生中发挥重要作用[14-15]。研究[16]显示:HGF可诱导VEGF、MMP-2和MMP-9等促血管形成因子的生成。丁苯酞通过改善线粒体功能,提高脑血管内皮细胞释放一氧化氮及前列环素的水平;抑制谷氨酸释放,降低细胞内钙浓度和花生四烯酸含量; 抑制氧自由基并提高体内抗氧化酶的活性,从而发挥多靶位抗脑缺血效果,改善脑组织局部血流灌注、避免脑缺血所致能量代谢耗竭,延缓脑缺血所致水肿的发生,并具备一定抗血栓形成的效果。本研究结果显示:丁苯酞治疗可使急性缺血性脑卒中大鼠脑组织VEGF、MMP-2和MMP-9表达水平升高,分析其可能通过HGF诱导VEGF、MMP-2和MMP-9等促血管形成因子的生成,从而促进新生血管生成,发挥对脑损伤的保护作用。
NF-κB在静息状态下以无活性形式存在,与其抑制性蛋白IκBα结合在细胞浆中存在,在多种因素作用下,IκBα被降解,NF-κB从胞浆中移位至细胞核内,启动相关基因转录,IκBα为NF-κB的抑制性蛋白,IκBα的降解水平影响NF-κB的转录活性[17]。VEGF基因启动子区域含有NF-κB调节序列,NF-κB的持续活化可使VEGF表达水平升高[15, 18],MMP-2和MMP-9等血管生成相关因子的表达也受NF-κB调控[19-21]。本研究结果显示:丁苯酞可增加急性缺血性脑卒中大鼠脑组织中NF-κB p65表达水平,降低IκBα表达水平,因此分析丁苯酞对急性缺血性脑卒中大鼠的脑保护作用可能与NF-κB的活化有关。
综上所述,丁苯酞对急性缺血性脑卒中大鼠的脑组织具有保护作用,其机制可能为:丁苯酞升高脑组织中HGF表达水平,HGF通过活化NF-κB诱导VEGF、MMP-2和MMP-9等促血管形成因子生成,从而通过血管形成发挥脑保护作用。但其具体的作用机制尚需通过细胞实验或动物实验进行深入研究。
| [1] | HASEGAWA Y, NAKAGAWA T, MATSUI K, et al. Renal denervation in the acute phase ofischemicstroke provides brain protection in hypertensive rats[J]. Stroke, 2017, 48(4): 1104–1107. DOI:10.1161/STROKEAHA.116.015782 |
| [2] | YAN R Y, WANG S J, YAO G T, et al. The protective effect and its mechanism of 3-n-butylphthalide pretreatment on cerebral ischemia reperfusion injury in rats[J]. Eur Rev Med Pharmacol Sci, 2017, 21(22): 5275–5282. |
| [3] | 陈婷, 李雪, 罗凡, 等. 丁苯酞联合依达拉奉对大鼠局灶性脑缺血细胞中Drp1及Mfn2动态变化的影响及其保护机制[J]. 医学研究生学报, 2018, 31(3): 284–289. |
| [4] | TOSUNER Z, BOZKURT S U, KILIÇ T, et al. The role of EGFR, hepatocyte growth factorreceptor (c-Met), c-ErbB2(HER2-neu) and clinicopathological parameters in the pathogenesis and prognosis of chordoma[J]. Turk Patoloji Derg, 2017, 33(2): 112–120. |
| [5] | ZHOU J, ZHANG Y H, SONG H Z, et al. 5d, a novel analogue of3-n-butylphthalide, decreases NADPH oxidase activity through the positive regulation of CK2 after ischemia/reperfusion injury[J]. Oncotarget, 2016, 7(26): 39444–39457. |
| [6] | TANG S C, LUO C J, ZHANG K H, et al. Effects of dl-3-n-butylphthalide on serum VEGF and bFGF levels in acute cerebral infarction[J]. Eur Rev Med Pharmacol Sci, 2017, 21(19): 4431–4436. |
| [7] | 韦俊杰, 李吕力, 李晓峰, 等. 丁苯酞对脑缺血再灌注大鼠血管内皮生长因子和血管生成素-1的影响[J]. 中华行为医学与脑科学杂志, 2016, 25(9): 774–777. DOI:10.3760/cma.j.issn.1674-6554.2016.09.002 |
| [8] | 骆高明. 丁苯酞联合常规抗凝、抗氧化治疗对急性脑梗死患者神经功能、血管新生及自由基生成的影响[J]. 海南医学院学报, 2018, 24(1): 109–112. |
| [9] | TONG F, ZHANG H. Poly (ethylene glycol)-block-brush poly (L-lysine) copolymer as an efficient nanocarrier for human? hepatocyte growth factor with enhanced bioavailability and anti-ischemia reperfusion injury efficacy[J]. Kidney Blood Press Res, 2017, 42(3): 495–508. DOI:10.1159/000479642 |
| [10] | ZHANG S L, CHEN D H, HUANG C Q, et al. Expression of HGF, MMP-9 and TGF-β1 in the CSF and cerebral tissue of adult rats with hydrocephalus[J]. Int J Neurosci, 2013, 123(6): 392–399. DOI:10.3109/00207454.2012.762363 |
| [11] | WRIGHT J W, HARDING J W. The brain hepatocyte growth factor/c-met receptor system:A new target for the treatment of Alzheimer's disease[J]. J Alzheimers Dis, 2015, 45(4): 985–1000. DOI:10.3233/JAD-142814 |
| [12] | VIALLARD C, LARRIVÉE B. Tumor angiogenesis and vascular normalization:alternative therapeutic targets[J]. Angiogenesis, 2017, 20(4): 409–426. DOI:10.1007/s10456-017-9562-9 |
| [13] | ADINI A, ADINI I, CHI Z L, et al. A novel strategy to enhance angiogenesis in vivo using the small VEGF-binding peptide PR1P[J]. Angiogenesis, 2017, 20(3): 399–408. DOI:10.1007/s10456-017-9556-7 |
| [14] | DIESSLER M, VENTUREIRA M, HERNANDEZ R, et al. Differential expression and activity of matrix metalloproteinases 2 and 9 in canine early placenta[J]. Reprod Domest Anim, 2017, 52(1): 35–43. DOI:10.1111/rda.12791 |
| [15] | ARUMUGAM P, SUBRAMANIAN R, PRIYADHARSINI J V, et al. Thymoquinone inhibits the migration of mouse neuroblastoma (Neuro-2a) cells by down-regulating MMP-2 and MMP-9[J]. Chin J Nat Med, 2016, 14(12): 904–912. |
| [16] | 王理, 施维, 薛均, 等. 缺氧诱导因子1α异常表达对肝细胞癌血管生成的调控作用[J]. 临床肝胆病杂志, 2017, 33(2): 369–374. DOI:10.3969/j.issn.1001-5256.2017.02.037 |
| [17] | ZHANG B, WANG D, JI T F, et al. Overexpression of lncRNA ANRIL up-regulates VEGF expression and promotes angiogenesis of diabetes mellitus combined with cerebral infarction by activating NF-κB signaling pathway in a rat model[J]. Oncotarget, 2017, 8(10): 17347–17359. |
| [18] | LUO M, HOU L, LI J, et al. VEGF/NRP-1axis promotes progression of breast cancer via enhancement of epithelial-mesenchymal transition and activation of NF-κB and β-catenin[J]. Cancer Lett, 2016, 373(1): 1–11. DOI:10.1016/j.canlet.2016.01.010 |
| [19] | ZHU G H, DAI H P, SHEN Q, et al. Curcumin induces apoptosis and suppresses invasion through MAPK and MMP signaling in human monocytic leukemia SHI-1 cells[J]. Pharm Biol, 2016, 54(8): 1303–1311. |
| [20] | 幸思忠. URG4/URGCP激活NF-κB通路调控肝细胞癌血管增生的实验研究[D].广州: 南方医科大学, 2016. |
| [21] | 杨子恒, 张英, 刘海京, 等. NF-κB在原发性肝细胞癌侵袭转移中的作用研究进展[J]. 临床医学研究与实践, 2018, 3(31): 197–198. |
 2019, Vol. 45
2019, Vol. 45


