扩展功能
文章信息
- 曹爽, 范紫薇, 王映映, 孙利娟, 古虹, 李贺, 孙靖辉, 王春梅, 陈建光, 陈曦, 张成义
- CAO Shuang, FAN Ziwei, WANG Yingying, SUN Lijuan, GU Hong, LI He, SUN Jinghui, WANG Chunmei, CHEN Jianguang, CHEN Xi, ZHANG Chengyi
- 毛樱桃总黄酮对RAW264.7细胞中炎症因子水平的影响及其机制
- Effects of prunus tomentosa thunb total flavonoids on levels of inflammatory factors in RAW264.7 cells and their mechanisms
- 吉林大学学报(医学版), 2019, 45(04): 836-842
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 836-842
- 10.13481/j.1671-587x.20190416
-
文章历史
- 收稿日期: 2018-09-05
2. 北华大学医学院病原学教研室, 吉林 吉林 132013
2. Department of Etiology, College of Medical, Beihua University, Jilin 132013, China
毛樱桃味甘、性温,含有维生素、有机酸和黄酮等物质,可以治疗冻疮、风湿和贫血等疾病。黄酮是一种广泛存在于植物及其浆果中的化合物,具有抗肿瘤、抗真菌和抗炎等作用[1-3]。本课题组前期研究[4-5]显示:毛樱桃总黄酮(prunus tomentosa thunb total flavones, PTTTF)对冻伤和巴豆油等诱因所致小鼠炎症具有明显改善作用,但其具体机制尚不清楚。研究[6]表明:炎症的发生发展与白细胞介素1β(interleukin-1 beta, IL-1β)、白细胞介素6(interleukin 6, IL-6)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)和高迁移率族蛋白B1(high mobility group box-1, HMGB1)等炎症因子的释放有密切关联,而巨噬细胞和中性粒细胞等炎细胞的细胞周期进程、凋亡及细胞内核转录因子κB(nuclear factor-κB, NF-κB)、细胞外调节蛋白激酶(extracellular regulated protein kinases 1/2, ERK1/2)和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)等炎症相关信号通路的激活均参与了上述炎症因子的调控。本研究通过(lipopolysaccharide, LPS)诱导小鼠RAW264.7细胞和人中性粒细胞(polymorphonuclear neutrophil,PMN)炎症模型,探讨PTTTF对炎症状态下细胞内炎症因子、细胞周期、细胞凋亡及信号通路的影响,进一步阐明毛樱桃的抗炎作用机制。
1 材料与方法 1.1 实验材料、主要试剂和仪器RAW264.7细胞由吉林大学药学院提供。PTTTF由北华大学药学院自制。RPMI 1640培养基购自美国Hyclone公司,标准胎牛血清购自天津灏洋有限公司,二甲基亚砜(DMSO)、噻唑蓝(MTT)和LPS均购自美国Sigma公司,BCA蛋白定量试剂盒和细胞周期检测试剂盒购自上海碧云天生物制品有限公司,醋酸地塞米松(DXM)购自中国食品药品检定研究院,磷酸缓冲盐溶液(PBS)、TBST电泳缓冲液、聚偏氟乙烯(PVDF)、RIPA细胞裂解液、苯甲基磺酰氟(PMSF)和磷酸酶抑制剂均购自北京鼎国生物技术有限公司,ECL发光液、甘油醛-3-磷酸脱氢酶(GAPDH)购自Vazyme(南京)生物制品有限公司,抗体NF-κB、ERK1/2、p-JNK和JNK购自武汉Abclone公司。680型酶标仪和凝胶成像分析系统(GelDoc XR+型)购自美国Bio-Rad公司,PCR仪(Mastercycler gradient 5331型)和5810R型多功能台式冷冻离心机购自美国Eppendorf公司。
1.2 PMN细胞的提取和鉴定本研究获得北华大学医学伦理委员会批准,健康供血者签署知情同意书。(20±2)℃条件下无菌操作,按照PMN细胞提取试剂盒操作提取PMN细胞,以0.5mL含10%胎牛血清的DMEM重悬细胞,将分离到的细胞进行台盼蓝染色,以排斥实验计数并评价细胞存活率。形态学观察PMN纯度达92%~98%,按照瑞氏-吉姆萨染液试剂说明书操作,观察细胞和细胞核的形态表现和染色性,鉴定PMN。
1.3 RT-PCR法检测RAW264.7细胞中IL-1β、IL-6、iNOS、TNF-α和HMGB1 mRNA表达水平取对数生长期RAW264.7细胞,调整细胞密度为5×105mL-1,按每孔1 mL接种于6孔板培养24 h后,细胞分为对照组、模型组、DXM组和不同剂量PTTTF组,每组设置6复孔,PTTTF组给药物终浓度分别为0.4、4.0和40.0mg·L-1,DXM组给药终浓度为0.869mg·L-1(2 μmol·L-1),给药干预4 h,每孔加入LPS(终浓度为1 mg·L-1),继续培养24 h后,按照试剂盒操作提取总RNA,进行RT-PCR法检测。逆转录条件: 72℃、5 min,45℃、50 min;GAPDH扩增条件: 94℃、30 s,55℃、30 s,72℃、45 s,共30个循环;IL-1β和IL-6扩增条件: 94℃、30 s,61℃、30 s,72℃、45 s,共32个循环;TNF-α、iNOS和HMGB1扩增条件: 94℃、30 s,62℃、30 s,72℃、45 s,共24个循环。将扩增后的产物行琼脂糖凝胶电泳,采用Image6.0软件进行灰度分析,以目的条带与内参物条带灰度值的比值作为目的基因mRNA表达水平。RT-PCR引物见表 1。
| Taget gene | Forward primer (5′-3′) | Reverse primer (5′-3′) | Length (bp) |
| GAPDH | GAGGGGCCATCCACAGTCTTC | CATCACCATCTTCCAGGAGCG | 357 |
| IL-10 | AGCCTTATCGGAAATGATCCAG | GGCCTTGTAGACACCTTGGT | 229 |
| TNF-α | TGTCTCAGCCTCTTCTCATTCCT | CTCCTCCACTTGGTGGTTTGT | 168 |
| IL-6 | CTGCAAGAGACTTCCATCCAG | AGTGGTATAGACAGGTCTGTTGG | 131 |
| IL-1β | GAAATGCCACCTTTTGACAGTG | TGGATGCTCTCATCAGGACAG | 116 |
| INOS | GGGTCACAACTTTACAGGGAGT | GAGTGAACAAGACCCAAGCG | 149 |
| HMGB1 | GCTGACAAGGCTCGTTATGAA | CCTTTGATTTTGGGGCGGTA | 149 |
RAW264.7细胞分组及处理方法同1.3。细胞培养24 h后按照试剂盒操作收集细胞于1.5 mL EP管中,加入1 mL预冷70%乙醇,4℃过夜,1 000 r·min-1离心5min,吸弃上清,加入1 mL PBS重悬细胞,流式细胞仪于激发波长488 nm处检测,计算S期细胞占总细胞数百分率。
1.5 Western blotting法检测各组细胞中NF-κB、ERK1/2和JNK蛋白表达水平RAW264.7细胞分组及处理方法同1.3。按照试剂盒操作提取总蛋白,SDS-PAGE电泳后转至PVDF膜,室温封闭2 h。将膜与1:1 000稀释的GADPH、NF-κB、ERK1/2和JNK抗体共孵育,4℃过夜。洗膜后与1:500稀释的标记有辣根过氧化物酶(HRP)的抗鼠IgG或抗兔IgG抗体共孵育,室温2 h,洗膜后ECL显色,采用ACDSee3.1软件对目的条带进行灰度分析。以NF-κB、ERK1/ERK2和p-JNK/JNK蛋白灰度值与GADPH蛋白灰度值的比值作为目的蛋白表达水平。
1.6 流式细胞术检测各组PMN细胞凋亡率按1.3中的方法将PMN细胞进行分组及处理,培养后按照Annexin Ⅴ-FITC凋亡检测试剂盒说明书进行检测,激发波长为488nm,发射波长为530nm。Annexin Ⅴ-FITC的绿色荧光通过FITC通道(FL1)检测,PI红色荧光通过PI通道(FL3)检测。采用Cell Quest软件分析细胞凋亡结果,计算细胞凋亡率。
1.7 统计学分析采用SPSS 17.0软件进行统计学分析。各组细胞中IL-1β、IL-6、TNF-α、iNOS和HMGB1 mRNA表达水平,NF-κB、ERK1/2和p-JNK蛋白表达水平,S期细胞百分率及细胞凋亡率以x±s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组RAW264.7细胞中IL-1β、IL-6、TNF-α、iNOS和HMGB1mRNA表达水平与对照组比较,模型组细胞中IL-1β、IL-6、TNF-α、iNOS和HMGB1 mRNA表达水平明显升高(P < 0.05或P < 0.01);与模型组比较,DXM组、4.0和40.0 mg·L-1PTTTF组细胞中IL-1β、TNF-α、iNOS和HMGB1 mRNA表达水平明显降低(P < 0.05或P < 0.01),IL-6 mRNA表达水平比较差异无统计学意义(P>0.05),0.4 mg·L-1PTTTF组上述各炎症因子mRNA表达水平比较差异均无统计学意义(P>0.05);不同剂量PTTTF组间上述各炎症因子mRNA表达水平比较差异无统计学意义(P>0.05)。见图 1和2。
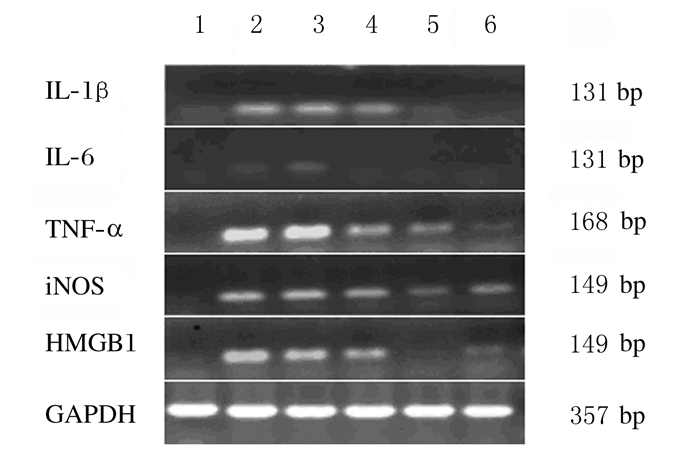
|
| Lane1:Control group; Lane2:Model group; Lane3-5:0.4, 4.0, and 40.0 mg·L-1PTTTF groups; Lane6:DXM group. 图 1 各组RAW264.7细胞中IL-1β、IL-6、TNF-α、iNOS和HMGB1 mRNA表达电泳图 Fig. 1 Electrophoregram of expressions of IL-1β, IL-6, TNF-α, iNOS, and HMGB1 mRNA in RAW264.7 cells in various groups |
|
|
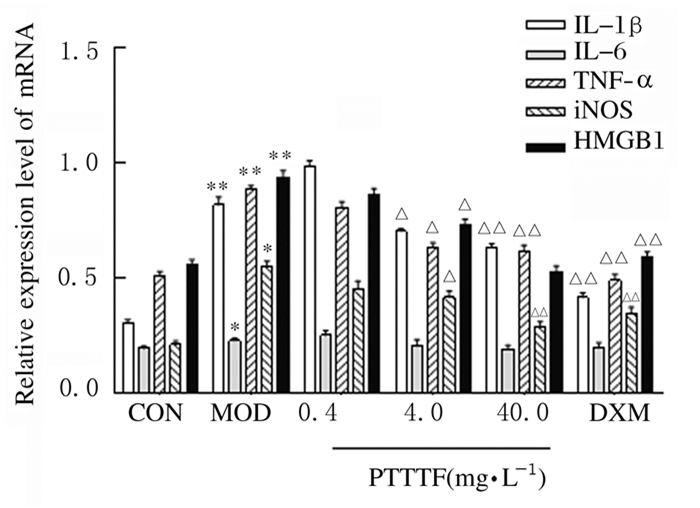
|
| CON:Control group; MOD:Model group; PTTTF:PTTTF group; DXM:DXM group; *P < 0.05, * *P < 0.01 compared with control group; △P < 0.05, △△P < 0.01 compared with model group. 图 2 各组RAW264.7细胞中IL-1β、IL-6、TNF-α、iNOS和HMGB1 mRNA表达水平 Fig. 2 Expressions levels of IL-1β, IL-6, TNF-α, iNOS, and HMGB1 mRNA in RAW264.7 cells in various groups |
|
|
与对照组(31.66%±1.07%)比较,模型组细胞中S期细胞百分率(38.07%±0.70%)明显增加(P < 0.05);与模型组比较,4.0和40.0 mg·L-1PTTTF组及DXM组细胞中S期细胞百分率(31.73%±0.47%、20.50%±0.89%和28.07%± 0.76%)明显降低(P < 0.05或P < 0.01),0.4 mg·L-1 PTTTF组细胞中S期细胞百分率(34.60%±0.72%)差异无统计学意义(P>0.05);不同剂量PTTTF组间S期细胞百分率比较差异无统计学意义(P>0.05)。
2.3 各组RAW264.7细胞中NF-κB、ERK1/2和JNK蛋白表达水平与对照组比较,模型组细胞中NF-κB、ERK1/2和JNK蛋白表达水平明显升高(P < 0.01);与模型组比较,4.0和40.0 mg·L-1PTTTF组及DXM组细胞中NF-κB、ERK1/2和JNK蛋白表达水平明显降低(P < 0.05或P < 0.01);与0.4和4.0 mg·L-1PTTTF组比较,40.0 mg·L-1PTTTF组细胞中ERK1/2表达水平明显降低(P < 0.05或P < 0.01);0.4和4.0 mg·L-1PTTTF组细胞中NF-κB和JNK蛋白表达水平比较差异无统计学意义(P>0.05)。见图 3和4。

|
| Lane1:Control group; Lane2:Modelgroup; Lane3-5:0.4, 4.0, and 40.0 mg·L-1 PTTTF groups; Lane6:DXM group. 图 3 各组RAW264.7细胞中NF-κB、ERK1/2和JNK蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of NF-κB, ERK1/2, and JNK proteins in RAW264.7 cells in various groups |
|
|

|
| CON:Control group; MOD:Model group; PTTTF:PTTTF group; DXM:DXM group.*P < 0.01 compared with control group; △P < 0.05, △△P < 0.01 compared with model group; #P < 0.05 compared with 4.0 mg·L-1 PTTTF groups; ○P < 0.01 compared with 0.4 mg·L-1 PTTTF group. 图 4 各组RAW264.7细胞中NF-κB、ERK1/2和JNK蛋白表达水平 Fig. 4 Expression levels of NF-κB, ERK1/2, and JNK protein in RAW264.7 cells in various groups |
|
|
与对照组(9.1%±0.11%)比较,模型组细胞凋亡率(3.5%±0.87%)明显降低(P < 0.05);与模型组比较,各剂量PTTTF组和DXM组细胞凋亡率(10.5%± 0.57%、23.6%±0.56%、29.7%±1.21%和47.8%±0.43%)均明显升高(P < 0.05或P < 0.01);不同剂量PTTTF组间细胞凋亡率比较差异无统计学意义(P>0.05)。见图 5。
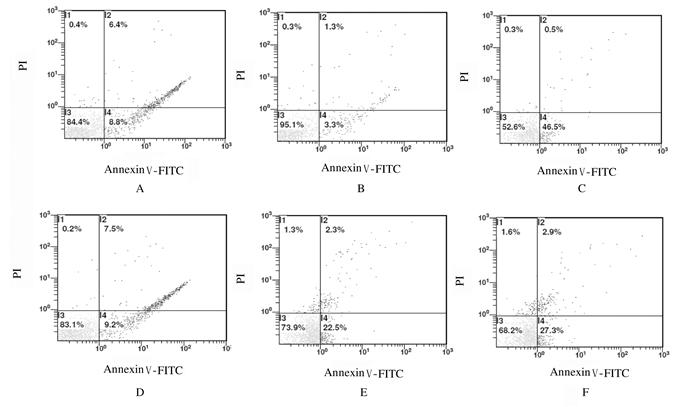
|
| A:Control group; B:Model group; C:DXM group; D-F:0.4, 4.0, and 40.0 mg·L-1PTTTF groups. 图 5 流式细胞术检测各组PMN细胞凋亡率 Fig. 5 Apoptotic rates of PMN in vrious groupsdetected by flow cytometry |
|
|
巨噬细胞是机体的固有免疫细胞,当外来病原体进入机体后, 可以被LPS激活而产生TNF-α、IL-1β和IL-6等[7]。PMN细胞是一类存在于炎症部位的主要的炎性细胞,主要通过自身的调控作用(细胞凋亡)影响炎症部位的组织损伤。炎症组织中,PMN细胞与巨噬细胞、自然杀伤细胞、B细胞和T细胞通过复杂的双向调控作用,产生大量TNF-α、IL-1β、IL-6和iNOS等细胞因子[8-9]。LPS是革兰阴性菌的主要成分,LPS刺激下,炎症细胞迅速浸润感染组织,引起PMN和巨噬细胞浸润等炎症细胞聚集,进一步导致其他相关炎性细胞激活,释放大量炎症因子,加重组织损伤[10]。
炎症状态下,炎症细胞内与炎症相关的一系列信号通路被激活,产生具有破坏性的细胞因子如TNF-α、IL-1β、IL-6和iNOS等,从而加重炎症反应,而HMGB1是一种广泛存在于真核生物中的非组蛋白,是内毒素致死效应的晚期重要炎症介质[11]。动物实验研究[12]显示:活化的ERK1/2可通过使NF-κB结合活性增强,进而激活TNF-α,引起ERK1/2的持续活化,从而形成一个循环,放大炎症反应。
本研究选用的RAW264.7细胞是鼠源性腹腔巨噬细胞, 是常用的炎症细胞模型之一。本研究通过构建RAW264.7炎症细胞模型显示:PTTTF可明显抑制RAW264.7细胞中炎症因子TNF-α、IL-1β、IL-6、iNOS和HMGB1的表达,推测PTTTF抗炎作用与降低前炎性细胞因子TNF-α、IL-1β、IL-6、iNOS和HMGB1的水平有关。CONNELL等[13]发现:细胞周期、DNA合成和细胞凋亡三者之间有密切的关联。细胞周期包含4个时期, 即DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)和分裂期(M期)[14]。本研究结果显示:PTTTF可明显下调LPS诱导后RAW264.7细胞的S期细胞百分率。由于S期主要完成细胞内DNA合成,因此PTTTF抗炎作用的产生可能与抑制DNA合成有关。
NF-κB和ERK1/2是调节炎症反应的经典信号通路,在大多数细胞中,NF-κB与抑制蛋白IκB家族结合,使得NF-κB在细胞浆中以静息状态稳定存在;当机体受到外源微生物刺激或出现炎症时,细胞就会产生TNF-α和IL-1β等促炎症因子磷酸化细胞内的IκB激酶(IKK),使IκB通过蛋白酶泛素化被降解,细胞质中的NF-κB暴露,使其得以进入细胞核,调控细胞内炎症因子的释放[15-16]。ERK1/2可以促进包括代谢酶、结构蛋白、与细胞凋亡有关的调节因子和转录因子在内的一系列的蛋白磷酸化。此外,ERK1/2还可以通过多种复杂的机制,诱导调节细胞周期的正向调控因子的表达,促进细胞周期由G1期向S期的转化,进而促进细胞周期进程[17]。持续性激活的ERK1/2会促进细胞的异常增殖和分化,在炎症的发生发展过程中起重要作用[18]。本研究结果显示:模型组细胞中ERK1/2和NF-κB蛋白表达水平明显高于对照组,PTTTF呈剂量依赖性下调ERK1/2和NF-κB蛋白的表达,提示PTTTF可通过抑制ERK1/2和NF-κB蛋白的表达,下调炎症因子IL-1β、IL-6、iNOS、TNF-α和HMGB1表达水平。有学者[19-20]提出:细胞中JNK的活化,既可以作为促凋亡信号,也可以作为生长信号。本研究结果显示:PTTTF可抑制JNK和ERK1/2蛋白表达,提示PTTTF的抑增殖作用可能与抑制JNK、ERK1/2蛋白表达有关。
综上所述,PTTTF主要是通过抑制信号通路NF-κB、ERK1/2和JNK的表达抑制细胞中TNF-α、IL-1β、IL-6、iNOS和HMGB1的表达,并抑制炎性细胞增殖和促进炎性细胞凋亡进而产生抗炎作用。本研究初步阐明了PTTTF在分子水平上的抗炎作用机制,为PTTTF作为抗炎药物的研发提供了理论依据。
| [1] | BEER MF, FRANK FM, GERMÁN ELSOO, et al. Trypanocidal and leishmanicidalactivities of flavonoids isolated from Stevia satureiifolia var. Satureiifolia[J]. Pharm Biol, 2016, 54(10): 2188–2195. DOI:10.3109/13880209.2016.1150304 |
| [2] | COELHO PL, OLIVEIRA M N, DA SILVA AB, et al. The flavonoid apigenin from Croton betulaster Mull inhibits proliferation, induces differentiation and regulates the inflammatory profile of glioma cells[J]. Anticancer Drugs, 2016, 27(10): 960–969. DOI:10.1097/CAD.0000000000000413 |
| [3] | SHALINI V, BHASKAR S, KUMAR K S, et al. Molecular mechanisms of anti-inflammatory action of the flavonoid, tricin from Njavara rice (Oryza sativa L.) in human peripheral blood mononuclear cells:possible role in the inflammatory signaling[J]. Int Immunopharmacol, 2012, 14(1): 32–38. |
| [4] | 师继超, 赵东双, 刘圆圆, 等. 不同制备工艺所得毛樱桃总黄酮的抗炎活性研究[J]. 北华大学学报:自然科学版, 2017, 18(3): 345–347. |
| [5] | 张成义, 邵世和, 史玉玲. 长白山毛樱桃总黄酮对冻伤及炎症相关性的影响[J]. 中国免疫学杂志, 2010, 26(11): 977–981. DOI:10.3969/j.issn.1000-484X.2010.11.004 |
| [6] | ALLAWI A A D. Malnutrition, inflamation and atherosclerosis (MIA syndrome) in patients with end stage renal disease on maintenance hemodialysis (a single centre experience)[J]. Diabetes Metab Syndr, 2018, 12(2): 91–97. DOI:10.1016/j.dsx.2017.09.003 |
| [7] | 王晓菲, 秦再生. 厄洛替尼对脂多糖诱导的巨噬细胞炎症反应和小鼠急性肺损伤的影响[J]. 吉林大学学报:医学版, 2016, 42(3): 457–461. |
| [8] | BRAZIL J C, PARKOS C A. Pathobiology of neutrophil-epithelial interactions[J]. Immunol Rev, 2016, 273(1): 94–111. DOI:10.1111/imr.12446 |
| [9] | BRAZIL J C, LOUIS N A, PARKOS C A. The role of polymorphonuclear leukocyte trafficking in the perpetuation of inflammation during inflammatory bowel disease[J]. Inflamm Bowel Dis, 2013, 19(7): 1556–1565. DOI:10.1097/MIB.0b013e318281f54e |
| [10] | 池明, 高玲, 吴巍巍, 等. 黄连素对脂多糖诱导的小鼠急性肺损伤和炎症的改善用及其机制[J]. 吉林大学学报:医学版, 2018, 44(6): 1194–1199. |
| [11] | YANG H, WANG H, CZURA C J. The cytokine activity of HMGB1[J]. Leukoc Biol, 2005, 78(1): 1–8. |
| [12] | PAPA S, ZAZZERONI F, PHAM C G, et al. Linking JNK signaling to NF-kappaB:a key to surviva[J]. Cell Sci, 2004, 117(1): 5197–5208. |
| [13] | CONNELL M J, WALWORTH N C, CARR A M. The G2-phase DNA-damage checkpoint[J]. Trends Cell Biol, 2000, 10(1): 296–303. |
| [14] | 苏日古嘎, 孟峻. 细胞分裂周期蛋白Cdc14A功能的研究进展[J]. 吉林大学学报:医学版, 2018, 44(5): 1105–1108. |
| [15] | BONIZZI G, KARIN M. The two NF-kappa B activation pathways and their role in innate and adaptive immunity[J]. Trends Immunol, 2004, 25(6): 280–288. DOI:10.1016/j.it.2004.03.008 |
| [16] | HOSH S, HAYDEN M S. New regulators of NF-kappa B in inflammation[J]. Nat Rev Immunol, 2008, 8(11): 837–848. DOI:10.1038/nri2423 |
| [17] | MELOCHE S, POUYSSÉGUR J. The ERK1/2 mitogen-activated protein kinase pathway as a master regulator of the G1-to S-phase transition[J]. Oncogene, 2007, 26(22): 3227–3239. DOI:10.1038/sj.onc.1210414 |
| [18] | DHILON A S, HAGAN S, RATH O, et al. MAP kinase signalling pathway in a cancer[J]. Oncogene, 2007, 27(22): 3279–3290. |
| [19] | SAKURUI T, MACDA S, CHANG L, et al. Loss of hepatic NF-kappa B activity enhaneces chemical hepalocarcinogenesis through suslained c-Jun N-terminal kinase 1 activation[J]. Proc Natl Acad Sci U S A, 2006, 103(28): 10544–10551. DOI:10.1073/pnas.0603499103 |
| [20] | KUNTZEN C, SONUC N, DE TONI E N, et al. Inhibition of c-Jun-N-terminal-kinase sensitizes tumor cells to CD95-induced apoptosis and induces G2/M cells ceyle arrest[J]. Cancer Res, 2005, 65(15): 6780–6788. DOI:10.1158/0008-5472.CAN-04-2618 |
 2019, Vol. 45
2019, Vol. 45


