扩展功能
文章信息
- 刘静乔, 郑燕, 王玉静, 孟亚丽, 徐淑稳, 张华林
- LIU Jingqiao, ZHENG Yan, WANG Yujing, MENG Yali, XU Shuwen, ZHANG Hualin
- 戊酸雌二醇联合阿司匹林对大鼠宫腔黏连的改善作用
- Improvement effect of estradiol valerate combined with aspirin on intrauterine adhesion in rats
- 吉林大学学报(医学版), 2019, 45(04): 830-835
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 830-835
- 10.13481/j.1671-587x.20190415
-
文章历史
- 收稿日期: 2018-12-25
宫腔黏连(intrauterine adhesions, IUA)是在物理创伤、微生物感染和炎症反应等因素作用下,引起子宫内膜纤维化,宫腔内壁相互黏连,导致子宫生理功能失常[1]。研究[2-3]显示:宫内膜纤维化与转化生长因子β1(transforming growth factor-β1,TGF-β1)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)和纤溶酶原激活物抑制剂1 (plasminogen activator inhibitor type-1, PAI-1)等细胞因子有关。目前IUA分离术是治疗IUA的主要方法,术后采用节育器辅助手段和服用雌激素可促进子宫内膜修复,但由于宫内膜修复的过程需要较长的时间周期,IUA再次发生的概率较高[4]。阿司匹林具有抗炎、抗风湿、抑制血小板黏附聚集和防止血栓形成等作用[5],但临床上阿司匹林对行宫腔镜IUA分离术后患者的子宫内膜发育、再黏连及整体疗效影响的报道较少。本研究主要通过观察大鼠子宫内膜TGF-β1、PAI-1和MMP-9的表达情况,探讨戊酸雌二醇联合阿司匹林对大鼠IUA的治疗效果,为其临床应用提供科学依据。
1 材料与方法 1.1 实验动物和主要试剂健康SD大鼠50只,8周龄,雌性,体质量250~300 g,购自河北省实验动物中心,动物合格证号:SYXK(冀)2013-0026。饲养条件:室温(24±3)℃,相对湿度40%~60%,自由摄水,适应性饲养7 d。
戊酸雌二醇(拜耳医药保健有限公司),HE染色试剂盒(上海碧云天生物技术有限公司),Masson染色试剂盒(南京森贝伽生物科技有限公司),GF-β1多克隆抗体(上海康朗生物科技有限公司),PAI-1(武汉博士德生物工程有限公司),MMP-9多克隆抗体(艾美捷科技有限公司),雌二醇ELISA试剂盒(上海康朗生物技术有限公司)。
1.2 实验动物分组和模型建立50只大鼠随机分为对照组、模型组、戊酸雌二醇组、阿司匹林组和戊酸雌二醇联合阿司匹林组(联合组),每组10只。除对照组外,其余各组大鼠采用刮宫加感染双重损伤法[6-7]建立IUA模型:大鼠腹腔给予10%水合氯醛麻醉后,解剖下腹部,暴露子宫,于宫颈上方5 mm处作长度约4 mm纵切口,行刮宫术,直至宫腔四壁出现粗糙感,将浸泡于6 mg·L-1脂多糖溶液中的棉线置于宫腔,生理盐水冲洗腹腔,缝合大鼠腹壁,24 h后取出脂多糖棉线,9 d后形成稳定的大鼠IUA模型。各组大鼠造模后恢复良好,无伤口感染情况发生,无死亡,存活时间均可达到24 d。戊酸雌二醇组大鼠于造模第9天后灌胃给予0.2 mg·L-1戊酸雌二醇(剂量参照文献[7]),阿司匹林组大鼠于造模第9天后灌胃给予10 mg·L-1阿司匹林(剂量参照文献[5]),联合组大鼠同时灌胃给予0.2 mg·L-1的戊酸雌二醇和10 mg·L-1阿司匹林,连续给药24 d。
1.3 ELISA法检测大鼠血清中雌二醇水平末次给药24 h后大鼠眼眶取血,3000 r·min-1离心10 min,分离血清,按照ELISA试剂盒说明书的方法检测各组大鼠血清中雌二醇水平,单位为ng·L-1。
1.4 大鼠子宫组织病理形态表现检查末次给药24 h后将大鼠处死,取双侧子宫,称质量,置于10%甲醛溶液中固定,常规切片,进行HE染色,光学显微镜下观察子宫内膜组织病理形态表现和腺体数量,Masson染色观察子宫内膜纤维化程度。子宫内膜腺体数量计数方法:取3张切片,每张切片取3个视野,计算子宫内膜腺体数,取平均值,作为该组织腺体计数值。子宫内膜纤维化面积比计算方法:随机选取3个视野,观察记录视野中子宫内膜间质的纤维化面积,计算子宫内膜纤维化面积比,子宫内膜纤维化面积比=子宫内膜间质纤维化面积/视野总面积×100%,取平均值。
1.5 免疫组织化学法检测大鼠子宫内膜组织中TGF-β1、PAI-1和MMP-9蛋白表达水平切片常规脱蜡至水,3% H2O2灭活内源性酶,热修复抗原,加稀释一抗TGF-β1(1:100)、MMP-9(1:75)和PAI-1(1:25),4℃过夜;加入二抗37℃孵育30 min;加入辣根过氧化酶标记链霉素卵蛋白(HRP/A-V)1:200,37℃孵育30 min;DAB显色,苏木素复染,以棕黄色为阳性信号,阴性对照用PBS代替一抗。高倍显微镜下观察,每个子宫组织选取5个视野,采用Image Pro Plus6.0病理图片分析系统分别测定TGF-β1、PAI-1和MMP-9阳性染色区域的平均光密度(A)值,以A值代表蛋白表达水平。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。大鼠血清雌二醇水平、子宫内膜腺体数量、子宫内膜纤维化面积比和子宫内膜组织中TGF-β1、PAI-1和MMP-9蛋白表达水平均以x±s表示,正态性检验采用Shapir-Wilk法,服从正态分布的数据多组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠血清雌二醇水平与对照组[(14.88±1.87) ng·L-1]比较,模型组大鼠血清雌二醇水平[(12.31±2.19) ng·L-1]明显降低(P < 0.05);与模型组比较,戊酸雌二醇组、阿司匹林组和联合组大鼠血清雌二醇水平[(20.95±3.14)、(15.31±2.04)和(22.75±3.85) ng·L-1]明显升高(P < 0.05);与阿司匹林组比较,联合组大鼠血清雌二醇水平明显升高(P < 0.05)。
2.2 各组大鼠子宫组织病理形态表现和腺体数量对照组大鼠子宫内膜腺体丰富,结构规则,宫腔无黏连,无积液,腔壁排列整齐,无炎性细胞浸润,子宫内膜被覆低柱状上皮细胞。模型组大鼠子宫内膜腺体数量减少,宫腔发生黏连、扩大,腔内有积液,宫腔壁细胞排列紊乱,炎性细胞浸润明显,上皮细胞被破坏。戊酸雌二醇组大鼠宫腔无黏连,部分扩张,有少量积液,宫腔壁细胞排列整齐,有轻度炎性细胞浸润。阿司匹林组大鼠宫腔部分黏连,有少量积液,宫腔壁细胞排列较整齐,无明显炎性细胞浸润。联合组大鼠宫腔无黏连或积液,宫腔壁细胞排列整齐,无明显炎性细胞浸润。见图 1(插页五)。
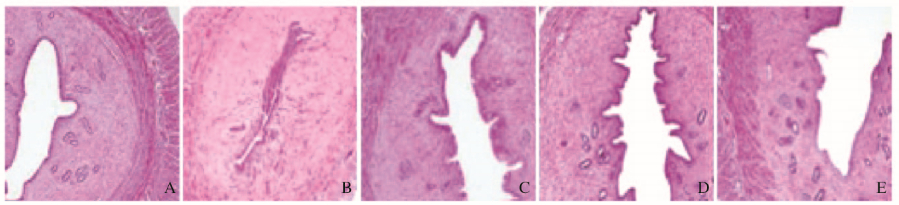
|
| A:Control group; B:Model group; C:Estradiol valerate group; D:Aspirin group; E:Combination group 图 1 各组大鼠子宫组织病理形态表现(HE,×100) Fig. 1 Pathomorphology of uterus tissue of rats in various groups (HE, ×100) |
|
|
与对照组[(22.64±3.02)个]比较,模型组大鼠子宫内膜腺体数[(2.30±0.42)个]明显减少(P < 0.01);与模型组比较,戊酸雌二醇组、阿司匹林组和联合组大鼠子宫内膜腺体数[(12.38± 1.41)、(8.92±1.04)和(16.94±2.13)个]明显增加(P < 0.05);与阿司匹林组比较,联合组大鼠子宫内膜腺体数明显增加(P < 0.01)。
2.3 各组大鼠子宫内膜间质纤维化程度对照组大鼠子宫内膜间质有少量胶原纤维,排列整齐。模型组大鼠子宫内膜间质纤维化,胶原纤维素排列紊乱。戊酸雌二醇组和阿司匹林组大鼠子宫内膜间质有少量胶原纤维,纤维化程度较轻。联合组大鼠宫腔无黏连,有少量胶原纤维且排列整齐,无明显纤维化改变。见图 2(插页五)。
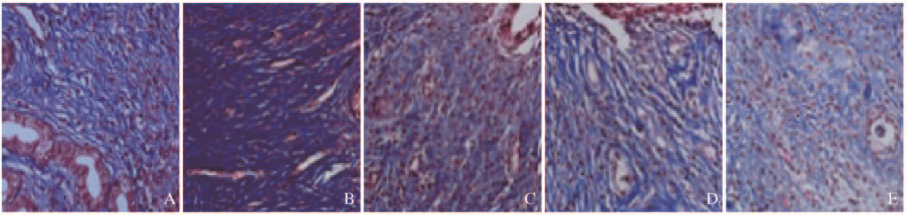
|
| A:Control group; B:Model group; C:Estradiol valerate group; D:Aspirin group; E:Combination group 图 2 各组大鼠子宫内膜Masson染色结果(×200) Fig. 2 Results of Masson staining of uterus endometrium of rats in various groups(×200) |
|
|
与对照组(6.42%±0.54%)比较,模型组大鼠子宫内膜纤维化面积比(60.35%±6.92%)明显升高(P < 0.05);与模型组比较,戊酸雌二醇组、阿司匹林组和联合组大鼠子宫内膜纤维化面积比(28.92%±2.33%、30.20%±3.25%和25.83%±3.06%)均明显降低(P < 0.01);与阿司匹林组比较,联合组大鼠子宫内膜纤维化面积比明显降低(P < 0.05)。
2.4 各组大鼠子宫内膜组织中TGF-β1、PAI-1和MMP-9蛋白表达水平与对照组比较,模型组大鼠子宫内膜组织中TGF-β1和PAI-1蛋白表达水平明显升高(P < 0.01),MMP-9蛋白表达水平明显降低(P < 0.01);与模型组比较,戊酸雌二醇组、阿司匹林组和联合组大鼠子宫内膜组织中TGF-β1和PAI-1表达蛋白水平明显降低(P < 0.05或P < 0.01),MMP-9蛋白表达水平明显升高(P < 0.05或P < 0.01);与阿司匹林组比较,联合组大鼠子宫内膜组织中TGF-β1和PAI-1蛋白表达水平明显降低(P < 0.05),MMP-9蛋白表达水平明显升高(P < 0.05)。见表 1和图 3(插页六)。
| (n=10, x±s) | |||
| Group | TGF-β1 | PAI-1 | MMP-9 |
| Control | 5.41±0.40 | 4.20±0.51 | 19.77±2.03 |
| Model | 32.86±4.57** | 16.37±1.97** | 9.20±1.11** |
| Estradiol valerate | 16.31±2.02**△△ | 10.93±0.95*△ | 13.42±1.93*△ |
| Aspirin | 17.76±2.14**△ | 9.35±1.16*△ | 12.62±1.41△ |
| Combination | 13.32±1.92*△△# | 7.84±1.07△△# | 15.31±2.07△△# |
| *P < 0.05, **P < 0.01 compared with control group; △ P < 0.05, △△P < 0.01 compared with model group; #P < 0.05 compared with aspirin group. | |||

|
| A-E:TGF-β1; F-J:PAI-1; K-O:MMP-9;A, F, K:Control group; Bt,G L:Model group; C,H, M:Estradiol valerate group; D, I, N:Aspirin group; E, J, O:Combination group 图 3 各组大鼠子宫内膜组织免疫组织化学染色结果(×200) Fig. 3 Results of immunohistochemistry staining of uterus endometrium tissue of rats in various groups(×200) |
|
|
IUA是指宫腔手术后,因机械操作创伤、细菌感染和放射线等原因导致子宫内膜基底层损伤,子宫内膜被纤维结缔组织代替,形成纤维化造成子宫壁相互黏连。人工流产、引产和葡萄胎清宫术等是引起IUA的主要原因[8-9]。临床上采用IUA分离术治疗IUA,但术后再次发生IUA的概率较高。细胞外基质沉积(extracellular matrix, ECM)是促进结缔组织形成的原因。研究[10]表明:TGF-β1和PAI-1表达增加、MMP-9表达减少是促进ECM沉积的根本原因。研究[11-12]显示:雌二醇可减轻子宫内膜损伤后IUA的形成,在一定范围内随着雌二醇剂量的增加改善作用会更加明显。重度IUA电切术后应用小剂量阿司匹林可以明显改善其子宫内膜容受性,提高术后试孕患者妊娠率,小剂量阿司匹林改善子宫内膜发育的作用已得到了肯定[13-14]。但雌二醇与阿司匹林联合应用能否引起子宫内膜细胞因子的改变从而改善内膜的结构尚需进一步研究。IUA确切的发病机制尚未阐明,可能与体内促进与抑制组织纤维化的一些细胞因子的变化有关。TGF-β1是一类具有多种生物学活性的细胞因子,包括5种异构体,其中TGF-β1、TGF-β2和TGF-β3在哺乳动物体内表达,三者生物学特性基本相同,主要参与组织的纤维化作用,刺激间质细胞生长,异构体中活性最强,与纤维化关系最为密切,通过与靶细胞上特异性受体结合,增加ECM和纤维蛋白沉积,使宫腔形成黏连[15]。PAI-1是纤溶系统生理性抑制物,能够抑制组织多肽抗原的活性,减少ECM降解,增加ECM沉积,如果PAI-1的作用时间延长,会导致纤维蛋白组织的黏连形成永久性的纤维黏连[16]。MMPs是一种含有锌原子,且其活性依赖于钙离子的蛋白酶,可以降解ECM中的主要生物大分子。MMP-9是MMPs家族中的一员,参与人体炎症等多种病理过程,能与锌结合降解ECM,是调节ECM动态平衡的最重要的酶[17]。雌二醇作为性激素,在机体中起调节作用,可通过降解细胞信号转导分子2/3(Smad2/3)蛋白抑制TGF-β1和MMP-9的表达,在纤维化和纤维性海绵体炎发生发展过程中起治疗作用[18-19]。
本研究探讨了戊酸雌二醇联合阿司匹林对大鼠IUA的防治作用,结果显示:戊酸雌二醇组、阿司匹林组和联合组大鼠血清雌二醇水平明显高于模型组,联合组大鼠血清雌二醇水平明显高于阿司匹林组,说明给予戊酸雌二醇治疗IUA能够通过提高血清雌二醇水平,对抑制子宫内膜纤维化起重要作用,且联用阿司匹林后效果更好。本研究中免疫组织化学染色结果显示:模型组大鼠子宫内膜组织中TGF-β1和PAI-1表达水平明显高于对照组,MMP-9表达水平明显低于对照组,与文献[20-21]报道一致,提示造模成功;联合组大鼠子宫内膜组织中TGF-β1和PAI-1表达水平明显低于阿司匹林组,MMP-9表达水平明显高于阿司匹林组,说明戊酸雌二醇与阿司匹林共同使用可起到降低子宫内膜组织中TGF-β1和PAI-1的表达,增加MMP-9的表达,减少ECM积聚,促进ECM分解,起到防止黏连的作用。本研究中HE染色结果显示:联合组大鼠宫腔无黏连或积液,宫腔壁细胞排列整齐,无明显炎性细胞浸润且子宫内膜腺体数明显多于阿司匹林组,说明戊酸雌二醇合用阿司匹林对大鼠IUA均具有较好的治疗作用,二者联合应用对大鼠子宫结构修复、IUA、宫腔积液和炎性细胞浸润有较好的改善作用。本研究中Masson染色检测结果显示:联合组大鼠无明显纤维化改变,子宫内膜纤维化面积比明显低于阿司匹林组,说明戊酸雌二醇联合阿司匹林对大鼠子宫内膜纤维化有明显的改善作用。HE染色和Masson染色检测结果均说明:大鼠子宫内膜组织中TGF-β1和PAI-1表达水平降低可能与戊酸雌二醇的作用有关,子宫内膜腺体数量增加、雌二醇水平升高、纤维化面积降低及子宫内膜环境整体改善可能与阿司匹林的作用有关,戊酸雌二醇与阿司匹林联合应用通过降低TGF-β1、PAI-1的表达和增强MMP-9的表达,从而对大鼠IUA起治疗作用。
综上所述,戊酸雌二醇联合阿司匹林能够通过降低TGF-β1、PAI-1在子宫内膜组织中的表达,上调MMP-9表达,促进子宫内膜结构修复,对大鼠IUA起治疗作用。
| [1] | EVANS-HOEKER EA, YOUNG SL. Endometrial receptivity and intrauterine adhesive disease[J]. Semin Reprod Med, 2014, 32(5): 392–401. DOI:10.1055/s-0034-1376358 |
| [2] | ZENG XL, YUE Z, GAO Y, et al. NR4A1 is involved in fibrogenesis in ovarian endometriosis[J]. Cell Physiol Biochem, 2018, 46(3): 1078–1090. DOI:10.1159/000488838 |
| [3] | FENG M, DING J, WANG M, et al. Kupffer-derived matrix metalloproteinase-9 contributes to liver fibrosis resolution[J]. Int J Biol Sci, 2018, 14(9): 1033–1040. DOI:10.7150/ijbs.25589 |
| [4] | 李娜, 陈贵芹, 史素娥, 等. 不同方式预防宫腔镜下宫腔粘连分离术后宫腔再粘连的效果分析[J]. 中国实用医刊, 2018, 45(7): 17–20. DOI:10.3760/cma.j.issn.1674-4756.2018.07.006 |
| [5] | 郑雪群, 明芳. 小剂量阿司匹林对宫腔粘连术后子宫动脉血流和子宫内膜的影响[J]. 当代医学, 2018, 24(18): 146–148. DOI:10.3969/j.issn.1009-4393.2018.18.066 |
| [6] | LI JX, DU SH, SHENG XJ, et al. MicroRNA-29b inhibits endometrial fibrosis by regulating the sp1-TGF-β1/smad-CTGF axis in a rat model[J]. Reprod Sci, 2016, 23(3): 386–394. DOI:10.1177/1933719115602768 |
| [7] | 王显, 何援利, 蔡慧华, 等. 不同剂量戊酸雌二醇防治大鼠宫腔粘连的作用研究[J]. 重庆医科大学学报, 2017, 42(4): 378–382. |
| [8] | MO XL, QIN GR, ZHOU ZL, et al. Assessment of risk factors of intrauterine adhesions in patients with induced abortion and the curative effect of hysteroscopic surgery[J]. J Invest Surg, 2019, 32(1): 85–89. |
| [9] | 秦玉静, 于景荣, 龙英丽. 宫腔粘连447例临床分析[J]. 中国基层医药, 2016, 23(13): 2062–2064. DOI:10.3760/cma.j.issn.1008-6706.2016.13.038 |
| [10] | VILLAR V, KOCIC J, SANTIBANEZ JF. Skip regulates TGF-β1-induced extracellular matrix degrading proteases expression in human pc-3 prostate cancer cells[J]. Prostate Cancer, 2013, 2013: 398253. |
| [11] | 许凤. 不同剂量雌激素在宫腔粘连形成中的效果比较[J]. 临床合理用药杂志, 2018, 11(34): 88–89. |
| [12] | 何萍, 池余刚, 周德平, 等. 经皮雌二醇凝胶与口服戊酸雌二醇在宫腔粘连电切术后临床疗效比较[J]. 现代妇产科进展, 2018, 27(11): 817–820. |
| [13] | 明芳, 李文怡, 杨俊. 宫腔镜下宫腔粘连分离术后应用小剂量阿司匹林效果分析[J]. 广西医学, 2018, 40(11): 1221–1223. |
| [14] | 文燕青, 池余刚, 刘禄斌, 等. 小剂量阿司匹林对重度宫腔粘连术后子宫内膜容受性及妊娠结局的影响[J]. 重庆医科大学学报, 2017, 42(4): 449–452. |
| [15] | SALMA U, XU EM, SHEIKH MS, et al. Role of transforming growth factor-β1 and smads signaling pathway in intrauterine adhesion[J]. Mediators Inflamm, 2016, 2016: 4158287. |
| [16] | SUI C, MECHA E, OMWANDHO CO, et al. PAI-1 secretion of endometrial and endometriotic cells is smad2/3-and erk1/2-dependent and influences cell adhesion[J]. Am J Transl Res, 2016, 8(5): 2394–2402. |
| [17] | 高红艳, 刘芳, 谢军, 等. TGF-β-1及MMP-9在宫腔粘连内膜组织中的表达与意义[J]. 中国妇幼保健, 2014, 29(24): 3971–3974. |
| [18] | TIAN Y, YIN HB, DENG YP, et al. Effects of estrogen on the expression of MMP-2, TIMP-2 and TGF-β1 in human corneal stromal cells[J]. Int Eye Sci, 2017, 17(7): 1232–1236. |
| [19] | LONG L, CAO Y, TANG LD. Transmembrane estrogen receptor GPR30 is more frequently expressed in malignant than benign ovarian endometriotic cysts and correlates with MMP-9 expression[J]. Int J Gynecol Cancer, 2012, 22(4): 539–545. DOI:10.1097/IGC.0b013e318247323d |
| [20] | 吴玺玺, 周勤, 胡建国, 等. TGF-β1和MMP-9在宫腔粘连子宫内膜组织中表达上调[J]. 重庆医科大学学报, 2017, 42(4): 394–400. |
| [21] | 胡莎, 李亚, 孟维杰, 等. 妇康口服液对大鼠实验性宫腔粘连预防效果及对宫内膜组织TGF-β1、PAI-1和MMP-9表达影响的实验研究[J]. 四川大学学报:医学版, 2013, 44(4): 540–544. |
 2019, Vol. 45
2019, Vol. 45


