扩展功能
文章信息
- 田娟, 毛建雯
- TIAN Juan, MAO Jianwen
- Ndfip1质粒的构建及其在神经母细胞瘤SH-SY5Y细胞中的表达
- Construction of Ndfip1 plasmid and its expression in neuroblastoma SH-SY5Y cells
- 吉林大学学报(医学版), 2019, 45(04): 825-829
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 825-829
- 10.13481/j.1671-587x.20190414
-
文章历史
- 收稿日期: 2018-09-16
Nedd4家族反应蛋白1(Nedd4 family interacting protein 1, Ndfip1)是2000年发现的一种进化保守的跨膜蛋白,同时也是一种衔接蛋白。Ndfip1通过氨基端的2个PPXY基序与E3泛素连接酶Nedd4家族的WW域连接,并招募靶蛋白,最终导致靶蛋白多聚泛素化并被蛋白酶体识别和降解[1]。研究[2-3]显示:Ndfip1与机体内某些器官的金属离子,特别是铁离子的稳态平衡有关。二价金属离子转运蛋白1(divalent metal transporter 1,DMT1)广泛分布于人体各组织,其主要功能是介导小肠上皮细胞的铁吸收以及参与铁从内吞小体移位到胞浆的过程[4]。DMT1在脑内高表达于基底节,尤其是尾壳核,提示其在该区域铁的代谢过程中起着至关重要的作用[5]。DMT1表达异常会引起脑内铁平衡的紊乱,铁在某些脑区特异性聚积,可造成脑内活性氧(ROS)的产生增多,氧化应激增强,导致神经元死亡,进而诱发某些神经退行性疾病[6]。
研究[7-8]显示:Ndfip1对小肠和肝脏等部位DMT1的表达具有调控作用,两者存在相关性。但Ndfip1与DMT1在神经细胞内是否有关联尚不清楚。本研究在成功构建Ndfip1质粒的基础上,瞬时转染人神经母细胞瘤SH-SY5Y细胞,使其高表达Ndfip1,通过观察神经细胞中DMT1的表达变化,探讨Ndfip1对DMT1的调控作用及其对铁代谢稳态的影响,为脑铁代谢紊乱相关疾病的发病机制及靶基因治疗提供理论依据。
1 材料与方法 1.1 实验材料和主要试剂SH-SY5Y细胞(南京科佰生物技术有限公司)。兔抗Ndfip1抗体、兔抗DMT1抗体、Texas Red荧光二抗和DAPI(美国Sigma公司),GAPDH内参(美国Santa Cruz公司),辣根酶标记抗兔IgG和辣根酶标记抗小鼠IgG(北京中杉金桥生物技术有限公司),ECL发光试剂盒(上海天能科技有限公司),DMEM/F12、胎牛血清和质粒提取试剂盒(南京金斯瑞生物科技有限公司),RT-PCR试剂盒(北京全式金生物技术有限公司),PCR引物和LipofectamineTM2000 (美国Invitrogen公司)。
1.2 细胞培养将冻存管放入40℃水浴1 min融化,离心后吸出细胞悬液注入培养瓶,加含10%胎牛血清的DMEM/F12培养液,置于培养箱中培养,待细胞贴壁后可传代。
1.3 质粒构建和提取Ndfip1质粒由上海吉凯基因化学技术有限公司构建。质粒经PCR扩增、琼脂糖凝胶电泳分离和测序比对检测,构建成功。质粒在感受态细菌中进行转化。提取质粒具体实验操作依据质粒提取试剂盒说明书进行。
1.4 细胞转染和分组细胞转染实验操作步骤依据LipofectamineTM2000转染试剂说明书进行。转染后,应用蛋白印迹法(实验步骤详见1.6)检测细胞中Ndfip1蛋白表达水平,确定转染效率。空质粒转染的SH-SY5Y细胞为对照组,Ndfip1质粒转染的SH-SY5Y细胞为实验组。
1.5 免疫荧光法检测细胞中DMT1表达强度细胞爬片用PBS冲洗3次,室温下置于10%过氧化氢中10 min,以阻断内源性过氧化物酶的活性,PBS冲洗3次;滴加5%驴血清室温1 h,甩去多余液体,不洗;兔抗DMT1抗体(工作液浓度1:100) 4℃孵育过夜,PBS充分漂洗;Texas Red标记荧光二抗室温孵育2 h,PBS充分漂洗;DAPI染液复染,封片,荧光显微镜下观察并采集图像进行分析。阴性对照用正常血清代替一抗孵育切片。结果判定:DMT1阳性表达呈现红色荧光,细胞核呈现蓝色荧光。
1.6 蛋白印迹法检测细胞中Ndfip1和DMT1蛋白表达水平细胞经4℃ PBS冲洗3次,移至离心管,1 000 r·min-1低温离心5 min,弃上清后,加入蛋白裂解液4℃裂解1.5 h,12 000 r·min-1低温离心30 min,考马斯亮蓝法对上清液进行蛋白定量。取50 μg待检测蛋白,加入十二烷基硫酸钠上样缓冲液混合,100℃煮沸5 min,聚丙烯酰胺凝胶电泳,转膜,脱脂奶粉室温封闭1 h,兔抗DMT1抗体或兔抗Ndfip1抗体(1:200)4℃震荡孵育过夜,PBS漂洗3次,辣根过氧化物酶标记二抗(1:2 000)室温震荡孵育2 h,PBS漂洗3次,增强化学发光法(ECL)检测蛋白条带,将条带扫描后用Photoshop 7.0软件进行处理。内参为GAPDH。扫描X射线片,计算机处理,应用公式计算吸光度(A)值,A值=-lgT,T为透光率,A值越大,表示密度越大,表达水平越高。
1.7 统计学分析采用SPSS20.0统计软件进行统计学分析。2组细胞中Ndfip1和DMT1蛋白表达水平以x±s表示,组间样本均数比较采用t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 Ndfip1质粒构建和转染引物设计、目的片段获取、载体双酶切及目的片段与载体连接由吉凯公司完成(图 1~3)。Ndfip1质粒经PCR扩增、琼脂糖凝胶电泳分离检测,条带位于1100 bp,测序比对结果证明质粒构建成功(图 3)。Ndfip1质粒转染SH-SY5Y细胞48 h后,采用蛋白印迹法检测细胞中Ndfip1蛋白表达水平,以确认转染是否成功,结果显示:与转染前(56.8±1.7)比较,转染后SH-SY5Y细胞中Ndfip1蛋白表达水平(82.4±4.3)明显升高(P < 0.01),表明转染成功。见图 4。

|
| M: DL10000marker; Lane 1: Enzyme-digested product; Lane 2: Non-enzyme-digested product. 图 1 载体酶切结果 Fig. 1 Results of enzyme digestion of vector |
|
|
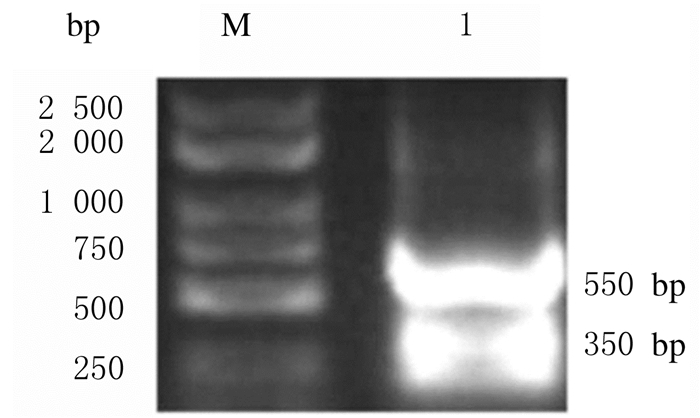
|
| M: DL3 000marker; Lane 1: Ndfip1 gene fragment. 图 2 Ndfip1基因片段的PCR结果 Fig. 2 PCR results of Ndfip1 gene fragment |
|
|
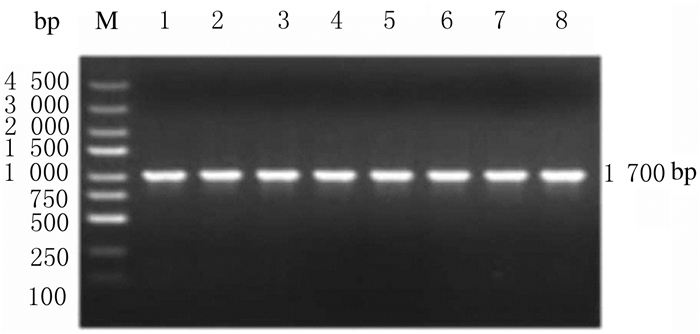
|
| M: DL5 000Marker; Lane 1-8: Ndfip1 recombinant plasmid. 图 3 Ndfip1重组质粒的构建 Fig. 3 Construction of recombinant plasmid of Ndfip1 |
|
|

|
| Lane 1: Non-transfected cells; Lane 2: Transfected cells. 图 4 蛋白印迹法检测Ndfip1质粒转染前后Ndfip1蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of Ndfip1 protein before and after transfection of Ndfip1plasmid detected by Western blotting method |
|
|
实验组和对照组质粒转染48 h后,免疫荧光检测结果显示:与对照组比较,实验组细胞DMT1荧光强度减弱,说明DMT1表达减少。见图 5(插页五)。

|
| A: Control group; B: Model group; C: Estradiol valerate group; D: Aspirin group; E: Combination group 图 5 免疫荧光法检测2组细胞中DMT1表达(×400) Fig. 5 Expressions of dMTI in cells in two groups detected by immunofluorescence(×400) |
|
|
与对照组(100.4±9.5)比较,实验组细胞中DMT1蛋白表达水平(69.3±7.2)明显降低(P < 0.05)。见图 6。
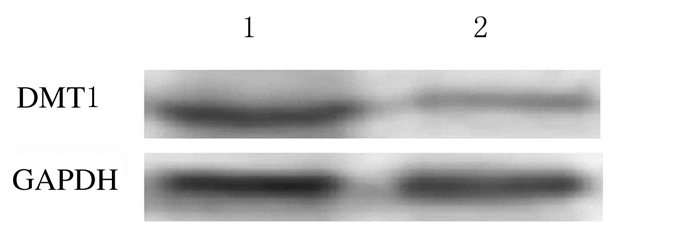
|
| Lane 1: Control group; Lane 2:Experimental group. 图 6 2组细胞中DMT1蛋白表达电泳图 Fig. 6 Electrophoregram of expressions of DMT1 protein in cells in two groups |
|
|
铁离子是机体必需的微量元素,维持机体正常结构、参与体内各种生理活动和新陈代谢过程[9-10]。铁维持稳态平衡有严格的调控机制,该机制一旦失调,稳态平衡就会被打破,进而诱发相应的疾病。研究[11-12]表明:阿尔茨海默病患者脑内铁含量增加且皮质老年斑内部以及斑块周围有大量铁富集;同样,在Tg2576小鼠脑内皮质老年斑块部位也检测到高水平的铁[13]。上述现象均提示:铁离子可能与阿尔茨海默病的主要病理改变,即β-淀粉样蛋白(Aβ)异常聚集有密切关联。另外,在阿尔茨海默病患者脑组织中铁离子含量增高或异常聚集,会导致细胞内某些生物大分子如蛋白质、脂质以及核酸发生氧化应激[14-17],对组织细胞造成损伤。另外,研究[18-20]显示:铁离子在键接Aβ以及老年斑形成过程中发挥重要作用,进而引发神经细胞的凋亡和脑功能损伤。
近年来,人们越来越关注铁离子在阿尔茨海默病发病机制中的作用,并开展了大量的相关研究。越来越多的证据表明:Ndfip1与脑内铁离子的稳态平衡有密切关联。研究[21]显示:Ndfip1可以对抗某些二价金属离子,如钴和铁离子等对神经细胞的毒性作用,具有一定的抗凋亡性。2008年,FOOT等[7]通过免疫共沉淀技术研究发现:Ndfip1与DMT1存在相关性;免疫荧光共聚焦检测结果显示:Ndfip1与DMT1共定位于核周围呈点状分布,且共表达于高尔基复合体。Ndfip1过表达可降低DMT1的转运活性;反之,Ndfip1基因沉默可增强DMT1的转运活性,说明Ndfip1能负性调节DMT1的转运活性。另外,动物实验[7]结果显示:与对照组比较,Ndfip1-/-小鼠肝组织中DMT1表达水平增加。Perl’ s铁染色[7]显示:Ndfip1-/-小鼠肝门静脉周围有明显铁沉积,提示其小鼠肝内DMT1转运活性增加;通过血浆质谱法定量检测肝铁水平显示:Ndfip1-/-小鼠肝内铁含量明显增加;检测原代培养Ndfip1-/-小鼠肝细胞DMT1转运活性显示:小鼠肝细胞DMT1转运活性增加1.8倍。2011年,FOOT等[8]进一步研究发现:饲正常饮食Ndfip1-/-小鼠脾组织中铁含量也增加;Ndfip1-/-小鼠饲低铁饮食后十二指肠上皮细胞DMT1的表达和活性明显增高,同时血清铁和转铁蛋白饱和度增加。
研究[5, 22]显示:Ndfip1和DMT1在脑内均有表达,但两者的相关性还需进一步实验证实。本研究首先构建Ndfip1真核表达质粒,质粒经PCR扩增、琼脂糖凝胶电泳分离,显示条带位于1100 bp,测序比对结果证明质粒构建成功。本研究应用Ndfip1质粒转染SH-SY5Y细胞,确定转染效率,为后续实验奠定基础,结果显示:Ndfip1质粒转染可明显增加SH-SY5Y细胞的Ndfip1表达水平。本研究中免疫荧光检测结果显示:实验组细胞中DMT1荧光强度减弱,表明DMT1蛋白表达减少,由此推测Ndfip1过表达可下调DMT1蛋白的表达。同样,本研究中蛋白印迹检测结果显示:在Ndfip1过表达条件下,神经细胞中DMT1蛋白表达水平降低,即在神经细胞内,Ndfip1可以负性调控DMT1表达。而DMT1表达减少,其介导铁离子进入细胞内减少,进而减少细胞内铁离子的蓄积,减轻氧化应激反应,对神经细胞具有一定保护作用。
由此可见,Ndfip1可调控DMT1的蛋白表达,进而调节机体内铁离子的动态平衡,这一调节途径是否参与某些与铁离子代谢异常相关的神经退行性疾病(阿尔茨海默病、帕金森病和脑缺血再灌注损伤等)的发病机制及病理过程还有待于进一步研究。
| [1] | TRIMPERT C, WESCHE D, de GROOT T, et al. NDFIP allows NEDD4/NEDD4L-induced AQP2 ubiquitination and degradation[J]. PLoS One, 2017, 12(9): e0183774. DOI:10.1371/journal.pone.0183774 |
| [2] | XU H M, CHANG Q, JIA W T, et al. Iron status and lipopolysaccharide regulate Ndfip1 by activation of nuclear factor-kappa B[J]. Biometals, 2013, 26(6): 981–988. DOI:10.1007/s10534-013-9674-7 |
| [3] | JIA W T, XU H M, DU X X, et al. Ndfip1 attenuated 6-OHDA-induced iron accumulation via regulating the degradation of DMT1[J]. Neurobiol Aging, 2015, 36(2): 1183–1193. DOI:10.1016/j.neurobiolaging.2014.10.021 |
| [4] | BALLESTEROS C, GEARY J F, MACKENZIE C D, et al. Characterization of divalent metal transporter 1(DMT1) inBrugia malayisuggests an intestinal-associated pathway foriron absorption[J]. Int J Parasitol Drugs Drug Resist, 2018, 8(2): 341–349. DOI:10.1016/j.ijpddr.2018.06.003 |
| [5] | LU L N, QIAN Z M, WU K C, et al. Expression of iron transporters and pathological hallmarks of Parkinson's and Alzheimer's diseases in the brain of young, adult, and aged rats[J]. Mol Neurobiol, 2017, 54(7): 5213–5224. DOI:10.1007/s12035-016-0067-0 |
| [6] | ZHANG CW, TAI YK, CHAI BH, et al. Transgenic mice overexpressing the divalent metal transporter 1 exhibit iron accumulation and enhanced parkin expression in the brain[J]. Neuromolecular Med, 2017, 19(2/3): 375–386. |
| [7] | FOOT N J, DALTON H E, SHEARWIN-WHYATT L M, et al. Regulation of the divalent metal ion transporter DMT1 and iron homeostasis by a ubiquitin-dependent mechanism involving Ndfips and WWP2[J]. Blood, 2008, 112(10): 4268–4275. DOI:10.1182/blood-2008-04-150953 |
| [8] | FOOT N J, LEONG Y A, DORSTYN L E, et al. Ndfip1-deficient mice have impaired DMT1 regulation and iron homeostasis[J]. Blood, 2011, 117(2): 638–646. DOI:10.1182/blood-2010-07-295287 |
| [9] | GAJEWSKA J, AMBROSZKIEWICZ J, KLEMARCZYK W, et al. Ferroportin-hepcidin axis in prepubertal obese children with sufficient daily iron intake[J]. Int J Environ Res Public Health, 2018, 15(10): E2156. DOI:10.3390/ijerph15102156 |
| [10] | KOBAK K A, RADWANSKA M, DZIEGALA M, et al. Structural and functional abnormalities iniron-depleted heart[J]. Heart Fail Rev, 2019, 24(2): 269–277. DOI:10.1007/s10741-018-9738-4 |
| [11] | VAN BERGEN J M G, LI X, QUEVENCO F C, et al. Simultaneous quantitative susceptibility mapping and Flutemetamol-PET suggests local correlation of iron and β-amyloid as an indicator of cognitive performance at high age[J]. Neuroimage, 2018, 174: 308–316. DOI:10.1016/j.neuroimage.2018.03.021 |
| [12] | MEADOWCROFT M D, PETERS D G, DEWAL R P, et al. The effect of iron in MRI and transverse relaxation of amyloid-beta plaques in Alzheimer's disease[J]. NMR Biomed, 2015, 28(3): 297–305. DOI:10.1002/nbm.3247 |
| [13] | GUO J P, PAN J X, XIONG L, et al. Iron chelation inhibits osteoclastic differentiation in vitro and in Tg2576 mouse model of Alzheimer's disease[J]. PLoS One, 2015, 10(11): e0139395. DOI:10.1371/journal.pone.0139395 |
| [14] | MASALDAN S, BUSH A I, DEVOS D, et al. Striking while the iron is hot:iron metabolism and ferroptosis in neurodegeneration[J]. Free Radic Biol Med, 2019, 133: 221–233. DOI:10.1016/j.freeradbiomed.2018.09.033 |
| [15] | BELAIDI AA, BUSH AI. Iron neurochemistry in Alzheimer's disease and Parkinson's disease:targets for therapeutics[J]. J Neurochem, 2016, 139(Suppl 1): 179–197. |
| [16] | WU J R, TUO Q Z, LEI P. Ferroptosis, a recent defined form of critical cell death in neurological disorders[J]. J Mol Neurosci, 2018, 66(2): 197–206. DOI:10.1007/s12031-018-1155-6 |
| [17] | WAGLE M V, MARCHINGO J M, HOWITT J, et al. The ubiquitin ligase adaptor NDFIP1 selectively enforces a CD8+T cell tolerance checkpoint to high-dose antigen[J]. Cell Rep, 2018, 24(3): 577–584. DOI:10.1016/j.celrep.2018.06.060 |
| [18] | GAN L, WANG Z H, SI J, et al. Protective effect of mitochondrial-targeted antioxidant MitoQ against ironion 56Fe radiation induced brain injury in mice[J]. Toxicol Appl Pharmacol, 2018, 341: 1–7. DOI:10.1016/j.taap.2018.01.003 |
| [19] | ZHANG L Y, LI X F, LIAO X D, et al. Effect of iron source on iron absorption and gene expression of iron transporters in the ligated duodenal loops of broilers[J]. J Anim Sci, 2017, 95(4): 1587–1597. |
| [20] | ZHANG L Y, LIAO X D, ZHANG L Y, et al. Kinetics of iron absorption by in situ ligated small intestinal loops of broilers involved in iron transporters[J]. J Anim Sci, 2016, 94(12): 5219–5229. DOI:10.2527/jas.2016-0713 |
| [21] | HOWITT J, PUTZ U, LACKOVIC J, et al. Divalent metal transporter 1(DMT1) regulation by Ndfip1 prevents metal toxicity in human neurons[J]. Proc Natl Acad Sci U S A, 2009, 106(36): 15489–15494. DOI:10.1073/pnas.0904880106 |
| [22] | LACKOVIC J, HOWITT J, CALLAWAY J K, et al. Differential regulation of Nedd4 ubiquitin ligases and their adaptor protein Ndfip1 in a rat model of ischemic stroke[J]. Exp Neurol, 2012, 235(1): 326–335. |
 2019, Vol. 45
2019, Vol. 45


