扩展功能
文章信息
- 张杰, 周辉, 刘亮, 郭桂喜, 于强, 银鹏飞, 陈文强, 苏兴
- ZHANG Jie, ZHOU Hui, LIU Liang, GUO Guixi, YU Qiang, YIN Pengfei, CHEN Wenqiang, SU Xing
- 敲低EphB1基因对过氧化氢诱导的大鼠心肌细胞氧化损伤的影响
- Effect of knockdown of EphB1 gene on oxidative damage of cardiomyocytes induced by hydrogen peroxide in rats
- 吉林大学学报(医学版), 2019, 45(04): 819-824
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 819-824
- 10.13481/j.1671-587x.20190413
-
文章历史
- 收稿日期: 2018-10-10
2. 北京大学国际医院心内科, 北京 102200;
3. 山东大学齐鲁医院心内科, 山东 济南 250012
2. Department of Cardiology, International Hospital, Peking University, Beijing 102200, China;
3. Department of Cardiology, Qilu Hospital, Shandong University, Ji'nan 250012, China
心肌梗死、心力衰竭、冠心病和动脉粥样硬化等心血管系统疾病具有发病率高、致残率高、复发率高、致死率高和并发症多等特点,是一种常见的严重威胁人类健康的疾病[1]。目前研究[2]显示:心肌细胞氧化应激导致的心肌细胞损伤及凋亡是诱发心血管疾病的主要原因。因此,治疗和预防心血管疾病需从阻断心肌细胞氧化损伤和减少心肌细胞凋亡等方向的研究着手。促红细胞生成素产生肝细胞受体(erythropoietin-producing hepatocellular receptor, Eph)基因是受体酪氨酸激酶家族(receptor tyrosine kinase,RTK)中最大亚族,具有多种生理学功能,参与细胞增殖、分化、生长和胚胎发育等过程[3]。Eph基因家族又可分为EphA和EphB 2个亚群,近年来研究[4-5]显示:肿瘤形成、血管发育与该基因家族有密切相关。近期研究中,通过生物信息学软件分析心肌梗死相关基因芯片数据[6]得出:在心肌梗死患者外周血中EphB1呈高表达,提示EphB1可能参与心肌梗死发病过程。急性髓性白血病的研究[7]显示:EphB1通过结合p53诱导DNA损伤应答级联反应恢复,通过下调Bcl-2导致细胞凋亡发挥肿瘤抑制作用。TYZACK等[8]研究显示:EphB1在受损的运动神经元中表达上调,进而通过其配体ephrin-B1介导信号通路和STAT3的激活诱导星形胶质细胞中的神经保护信号的传导。研究[9]显示:大鼠脑缺血再灌注后EphB1能够发挥对海马神经元的保护作用。目前鲜有关于EphB1对心肌损伤中作用的相关报道,因此本实验通过敲低EphB1基因的表达研究其对H2O2诱导的大鼠心肌H9c2细胞氧化损伤是否具有保护作用,为后续EphB1基因治疗心血管疾病奠定体外实验基础。
1 材料与方法 1.1 细胞和主要试剂大鼠心肌细胞株H9c2(中国科学院上海细胞库)。TRIzol试剂盒和SYBR Green Gene Expression Assay试剂盒(大连宝生物工程有限公司),逆转录试剂盒和转染试剂脂质体LipofectamineTM 2000(美国Invitrogen公司),DMEM培养基、MTT和胰蛋白酶(美国Gibco公司),胎牛血清(杭州四季青生物工程材料有限公司),二甲基亚砜(上海碧云天生物技术有限公司),Annexin Ⅴ-FITC细胞凋亡检测试剂盒(美国BD公司),BCA蛋白定量试剂盒和ELC发光检测试剂盒(日本TaKaRa公司),Reactive Oxygen Species Assay Kit活性氧(ROS)检测试剂盒(上海祤圣生物科技有限公司),超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒(南京建成生物工程研究所),实验所用引物均由上海生工生物工程股份有限公司合成,EphB1 siRNA和siRNA control(美国Stanta Cruz Biotech公司)。
1.2 大鼠心肌H9c2细胞培养大鼠心肌H9c2细胞用含10%胎牛血清的DMEM培养基培养,置于37℃、体积分数为5% CO2和饱和湿度的培养箱中,根据H9c2细胞生长状态更换新的培养基,每隔2~3 d用胰蛋白酶进行消化传代1次,细胞传至第3代后可用于后续实验。
1.3 细胞分组和处理将H9c2细胞随机分为4组:①空白组,正常培养的H9c2细胞不做任何处理;②H2O2组,在H9c2细胞培养液中加入终浓度为0.1 mmol·L-1H2O2,建立H9c2细胞氧化损伤模型;③阴性对照组,H9c2细胞中转染siRNA control;④转染si-EphB1组,H9c2细胞转染si-EphB1后,加入终浓度为0.1 mmol·L-1H2O2建立H9c2细胞氧化损伤模型。细胞转染按照LipofectamineTM 2000转染试剂说明书进行,处理后的各组细胞置于37℃培养箱中继续培养48 h,收集各组细胞进行后续相关检测。
1.4 实时荧光定量聚合酶链反应(qRT-PCR)法检测各组H9c2细胞中EphB1 mRNA表达水平按照上述方法处理H9c2细胞48 h后,分别参考TRIzol试剂盒说明书提取各组细胞中总RNA,经分光光度计检测RNA的浓度和纯度后,以RNA为模板通过逆转录试剂盒合成cDNA,将cDNA浓度调整为50 mg·L-1,采用SYBR Green Gene Expression Assay试剂盒进行荧光定量PCR反应,以GAPDH为参照,采用相对定量2-△△CT计算各组H9c2细胞中EphB1 mRNA表达量,空白组中EphB1 mRNA表达水平设为1,其他组EphB1 mRNA表达水平均为与空白组的比值。GAPDH,上游引物:5′-AGCCACATCGTCCAGACA-3′,下游引物:5′-TCTCCTGGGAGGCATAGACC-3′;EphB1,上游引物:5′-TGGAGAATGGTGCATTGGAGT-3′,下游引物:5′-TCGAGAAAA-AAGGAGAATGGT-3′。
1.5 MTT法检测各组H9c2细胞存活率将处于对数生长期的H9c2细胞接种于96孔板中,置于37℃培养箱中继续培养24 h,按照上述方法分别处理各组H9c2细胞,每组设置3个复孔,继续培养48 h后,在每孔细胞中加入MTT溶液,继续孵育4 h,弃上清,再分别向每孔细胞中加入二甲基亚砜,于震荡仪上孵育2 h,以酶标仪490 nm处检测各组H9c2细胞吸光度(A)值,以空白组细胞存活率为对照,计算各组细胞存活率。细胞存活率=实验组A值/空白组A值×100%。
1.6 流式细胞术检测各组H9c2细胞凋亡率将各组处于对数生长期的H9c2细胞接种于6孔板中,接种密度为每孔1×105个细胞,处理后48 h,将各组细胞分别消化、收集。以Binding Buffer重悬细胞制成单细胞悬液,将细胞密度调整为5×105mL-1。分别加入5 μL碘化丙啶(PI)和5 μLAnnexin Ⅴ-FITC,轻轻混匀后,室温避光静置15 min,以流式细胞仪检测, 使用Cell Quest软件计算各组H9c2细胞凋亡率。
1.7 DCFH-DA探针法检测各组H9c2细胞中ROS水平处理48 h后,分别收集各组H9c2细胞,以磷酸盐缓冲液洗涤3次后加入终浓度为20 μmol·L-1的DCFH-DA(以磷酸盐缓冲液稀释),37℃条件下反应2 h,以荧光显微镜检测荧光强度,以荧光强度的百分比代表各组细胞中ROS水平。
1.8 分光光度计法检测各组H9c2细胞中MDA和SOD水平分别收集按照上述方法处理48 h后的H9c2细胞,采用反复冻融的方式致使细胞内容物流出,收集其上清,按MDA和SOD检测试剂盒说明书测定各组细胞中MDA和SOD水平。
1.9 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组H9c2细胞中EphB1 mRNA表达水平、细胞存活率、细胞凋亡率和ROS、MDA及SOD水平以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组H9c2细胞中EphB1 mRNA表达水平与空白组比较,H2O2组H9c2细胞中EphB1 mRNA表达水平明显升高(P < 0.05),阴性对照组H9c2细胞中EphB1 mRNA表达水平无明显变化(P>0.05);与H2O2组比较,转染si-EphB1组H9c2细胞中EphB1 mRNA表达水平明显降低(P < 0.05)。见表 1。
| (n=3, x±s) | |||
| Group | EphB1 mRNA | Survival rate(η/%) | Apoptotic rate(η/%) |
| Blank | 1.06±0.09 | 100.02±0.57 | 3.19±0.85 |
| H2O2 | 2.48±0.37* | 53.28±2.34* | 16.24±2.57* |
| Negative control | 1.12±0.11 | 97.24±3.01 | 3.49±0.97 |
| si-EphB1 transfection | 1.67±0.24△ | 80.39±2.67△ | 9.87±1.34△ |
| *P < 0.05 compared with blank group; △P < 0.05 compared with H2O2 group. | |||
与空白组比较,H2O2组细胞存活率明显降低(P < 0.05),阴性对照组细胞存活率差异无统计学意义(P>0.05);与H2O2组比较,转染si-EphB1组细胞存活率明显升高(P < 0.05)。见表 1。
2.3 流式细胞术检测各组H9c2细胞凋亡率与空白组比较,H2O2组细胞凋亡率明显升高(P < 0.05),阴性对照组细胞凋亡率差异无统计学意义(P>0.05);与H2O2组比较,转染si-EphB1组细胞凋亡率明显降低(P < 0.05)。见表 1和图 1。
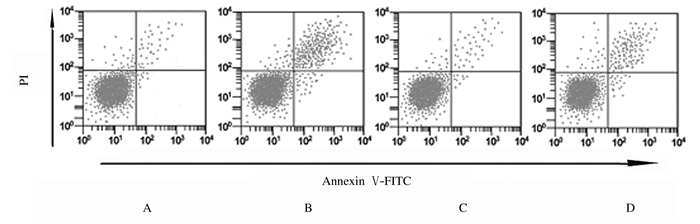
|
| A:Blank group; B:H2O2 group; C:Negative control group; D:si-EphB1 transfection group. 图 1 流式细胞术检测各组H9c2细胞凋亡率 Fig. 1 Apoptotic rates of H9c2 cells in various groups detected by flow cytometry |
|
|
与空白组比较,H2O2组细胞中ROS和MDA水平明显升高(P < 0.05),SOD水平明显降低(P < 0.05),阴性对照组细胞中ROS、MDA和SOD水平无明显变化(P>0.05);与H2O2组比较,转染si-EphB1组细胞中ROS和MDA水平明显降低(P < 0.05),SOD水平明显升高(P < 0.05)。见表 2。
| (n=3, x±s) | |||
| Group | ROS(η/%) | MDA[cB/(mmol·L-1)] | SOD[λB/(U·L-1)] |
| Blank | 19.23±2.35 | 1.87±0.31 | 20.12±3.12 |
| H2O2 | 53.26±8.37* | 4.26±1.21* | 10.25±1.52* |
| Negative control | 20.13±2.46 | 1.96±0.38 | 21.35±3.25 |
| si-EphB1 transfection | 23.28±2.61△ | 2.24±0.52△ | 14.29±2.28△ |
| *P < 0.05 compared with blank group; △P < 0.05 compared with H2O2 group. | |||
在全球范围内心血管疾病是导致死亡的最主要的原因。目前,我国心血管疾病的发病率和死亡率高居所有疾病的首位,严重危害着人们的健康和生命。对心血管发病机制的研究[10-11]显示:心肌氧化损伤引起心肌细胞凋亡是导致该病的重要原因之一。因此,研究如何阻断和减轻心肌细胞氧化损伤造成的危害对预防和治疗心血管疾病具有重要临床意义。EphB1是Eph家族的成员之一,介导胚胎血管系统发育和成人血管生成[12]。ISHII等[13]通过RT-PCR、免疫组织化学和原位杂交法研究了啮齿动物心室中EphB受体的表达及其在原代培养的啮齿动物心肌细胞中的功能,结果显示:EphB受体优先在成年小鼠心室的脉管系统的心肌细胞中表达,Ephrin-B-EphB信号通过对间隙连接的影响可以调节心肌细胞的电偶联。LAURIOL等[14]对肥厚型心肌病研究表明:蛋白酪氨酸磷酸酶2(SHP2)的异常表达引起Notch1/EphB信号转导减少,可导致先天性心脏病和心脏肥大的发生。以上研究表明:EphB1在心血管疾病中发挥作用,结合最近报道的关于心肌梗死患者外周血中EphB1呈高表达的研究,本研究推测EphB1在心肌损伤中发挥作用。因而本研究在此基础上观察EphB1对心肌氧化损伤的影响。
本实验采用H2O2作为诱导氧化应激的诱导剂,参照文献[15-16]用于诱导心肌细胞氧化损伤模型的作用浓度,对大鼠心肌H9c2细胞进行诱导,制备细胞氧化损伤模型。经MTT法和流式细胞术检测,结果显示:经H2O2诱导的H9c2细胞存活率降低,凋亡率升高;敲低EphB1基因后,能够抑制H2O2诱导的H9c2细胞的凋亡,提示敲低EphB1基因可通过抑制细胞凋亡抵抗H2O2诱导的H9c2细胞的损伤。本研究结果与部分研究者[17-19]的观点一致。本研究对细胞中ROS、MDA和SOD水平的检测结果显示:H2O2组细胞中ROS和MDA水平明显提高,SOD水平明显降低。ROS是机体中各种生化反应的代谢中间产物,当氧自由基产生过量时,机体抗氧化能力不足以清除活性氧,导致心肌细胞发生氧化损伤[20]。MDA作为脂质过氧化反应的中间产物中活性最强的物质,可影响膜脂蛋白和核酸的代谢及功能[21]。SOD是机体中重要的抗氧化酶,其通过歧化作用维持抗氧化和氧化的平衡,当机体受氧化刺激后,可抵御机体超氧化毒性反应[22]。本研究结果表明:H2O2诱导的H9c2细胞通过提高活性氧等物质的产生,抑制清除活性氧相关酶的产生,导致细胞的氧化损伤。本实验敲低H9c2细胞EphB1的表达后,H2O2诱导的H9c2细胞中ROS和MDA的水平受到抑制,提高SOD水平,提示EphB1能够通过清除细胞内氧化应激产物抵抗H2O2诱导的H9c2细胞的氧化损伤。
本研究通过细胞转染法敲低大鼠心肌H9c2细胞中EphB1基因的表达,能够明显抑制H2O2诱导的H9c2细胞凋亡及氧化应激损伤,其机制与降低H9c2细胞中ROS和MDA水平、提高SOD水平有关。本研究为心血管疾病的基因治疗提供新的作用靶点。
| [1] | CHEN WW, GAO RL, LIU LS, et al. Outline of the report on cardiovascular diseases in China, 2014[J]. Eur Heart J Suppl, 2016, 18(Suppl F): F2–F11. DOI:10.1093/eurheartj/suw030 |
| [2] | ZHANG PY, XU X, LI XC. Cardiovascular diseases:oxidative damage and antioxidant protection[J]. Eur Rev Med Pharmacol Sci, 2014, 18(20): 3091–3096. |
| [3] | JUREK A, GENANDER M, KUNDU P, et al. Eph receptor interclass cooperation is required for the regulation of cell proliferation[J]. Exp Cell Res, 2016, 348(1): 10–22. |
| [4] | CRAMER K S, MIKO I J. Eph-ephrin signaling in nervous system development[J]. F1000 Res, 2016, 5(7): 413–417. |
| [5] | PASQUALE E B. Eph receptors and ephrins in cancer:bidirectional signalling and beyond[J]. Nat Rev Cancer, 2010, 10(3): 165–180. DOI:10.1038/nrc2806 |
| [6] | 李丹辉, 朱建华, 乐健伟, 等. 急性心肌梗死相关基因的生物信息学分析[J]. 浙江医学, 2017, 39(24): 2232–2235. DOI:10.12056/j.issn.1006-2785.2017.39.24.2016-1582 |
| [7] | KAMPEN K R, SCHERPEN F J, GARCIA-MANERO G, et al. EphB1 suppression in acute myelogenous leukemia:regulating the DNA damage control system[J]. Mol Cancer Res Mcr, 2015, 13(6): 982–992. DOI:10.1158/1541-7786.MCR-14-0660-T |
| [8] | TYZACK G E, HALL C E, SIBLEY C R, et al. A neuroprotective astrocyte state is induced by neuronal signal EphB1 but fails in ALS models[J]. Nat Commun, 2017, 8(1): 1164. |
| [9] | SONG X J, ZHENG J H, CAO J L, et al. EphrinB-EphB receptor signaling contributes to neuropathic pain by regulating neural excitability and spinal synaptic plasticity in rats[J]. Pain, 2008, 139(1): 168–180. DOI:10.1016/j.pain.2008.03.019 |
| [10] | 邱莹, 吕风华, 陈玉磊, 等. miR-499对缺氧/复氧诱导的心肌细胞凋亡的影响[J]. 郑州大学学报:医学版, 2018, 53(4): 503–507. |
| [11] | 黄真锋, 法宪恩, 朱方涛, 等. 二氧化铈纳米颗粒预处理对大鼠缺血再灌注损伤心肌细胞Nrf2信号通路的影响[J]. 郑州大学学报:医学版, 2018, 53(2): 206–209. |
| [12] | TAN W, WANG J, ZHOU F, et al. Coexistence of EphB1 and EphrinB2 in port wine stain endothelial progenitor cells contributes to clinicopathological vasculature dilatation[J]. Br J Dermatol, 2017, 177(6): 1601–1611. DOI:10.1111/bjd.15716 |
| [13] | ISHⅡ M, MUELLER I, NAKAJIMA T, et al. EphB signaling inhibits gap junctional intercellular communication and synchronized contraction in cultured cardiomyocytes[J]. Basic Res Cardiol, 2011, 106(6): 1057–1068. DOI:10.1007/s00395-011-0219-3 |
| [14] | LAURIOL J, CABRERA J R, ROY A, et al. Developmental SHP2 dysfunction underlies cardiac hypertrophy in Noonan syndrome with multiple lentigines[J]. J Clin Invest, 2016, 126(8): 2989–3005. DOI:10.1172/JCI80396 |
| [15] | WANG W D, WANG L, YANG H J, et al. Protective effects of Yindanxinnaotong capsule in a rat model of myocardial ischemia/reperfusion injury[J]. J Tradit Chin Med, 2014, 34(6): 699–709. DOI:10.1016/S0254-6272(15)30085-6 |
| [16] | 符丽珍, 黄茂芹, 劳之勇, 等. miR-221在H2O2诱导的大鼠心肌细胞损伤中的作用及机制研究[J]. 中国比较医学杂志, 2017, 27(5): 83–88. |
| [17] | KAMPEN K R, SCHERPEN F J, GARCIAMANERO G, et al. EphB1 Suppression in acute myelogenous leukemia:regulating the DNA damage control system[J]. Mol Cancer Res, 2015, 13(6): 982–992. DOI:10.1158/1541-7786.MCR-14-0660-T |
| [18] | TAN W, WANG J, ZHOU F, et al. Coexistence of Eph receptor B1 and ephrin B2 in port-wine stain endothelial progenitor cells contributes to clinicopathological vasculature dilatation[J]. Br J Dermatol, 2017, 177(6): 1601–1611. DOI:10.1111/bjd.15716 |
| [19] | CHEN Q, DENG R, ZHAO X, et al. Sumoylation of ephB1 suppresses neuroblastoma tumorigenesis via inhibiting PKCγ activation[J]. Cell Physiol Biochem, 2018, 45(6): 2283–2292. DOI:10.1159/000488174 |
| [20] | SCHIEBER M, CHANDEL N S. ROS function in redox signaling and oxidative stress[J]. Curr Biol, 2014, 24(10): 453–462. DOI:10.1016/j.cub.2014.03.034 |
| [21] | BAHINIPATI J, MOHAPATRA P C. Ischemia modified albumin as a marker of oxidative stress in normal pregnancy[J]. J Clin Diagn Res, 2016, 10(9): BC15–BC17. |
| [22] | DJORDJEVIC A, SPASIC S, JOVANOVIC-GALOVIC A, et al. Oxidative stress in diabetic pregnancy:SOD, CAT and GSH-Px activity and lipid peroxidation products[J]. J Matern Fetal Neonatal Med, 2004, 16(6): 367–372. DOI:10.1080/jmf.16.6.367.372 |
 2019, Vol. 45
2019, Vol. 45


