扩展功能
文章信息
- 王途, 孙晓旭, 陈龙, 崔海鹏, 刘凯, 谢亚芹, 李颖, 赵娟
- WANG Tu, SUN Xiaoxu, CHEN Long, CUI Haipeng, LIU Kai, XIE Yaqin, LI Ying, ZHAO Juan
- Urantide对动脉粥样硬化大鼠胸主动脉组织中c-Jun氨基末端激酶表达的影响及其意义
- Effect of Urantide on expression of c-Jun N-terminal kinase in thoracic aorta tissue of rats with atherosclerosis and its significance
- 吉林大学学报(医学版), 2019, 45(04): 813-818
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 813-818
- 10.13481/j.1671-587x.20190412
-
文章历史
- 收稿日期: 2018-11-01
2. 承德医学院基础医学院基础医学研究所, 河北 承德 067000
2. Institute of Basic Medicine, School of Basic Medical Sciences, Chengde Medical University, Chengde 067000, China
动脉粥样硬化(atherosclerosis,AS)是一种血管性的慢性炎症,病理表现为脂质代谢紊乱且积聚于动脉内膜,伴出血和血栓形成,甚至出现纤维化及钙化,血管腔狭窄[1]。Urantide是在人尾加压素Ⅱ(human urotensinⅡ, hUⅡ)基础上衍生而来的多肽类化合物,是迄今为止最有效的尿素通道蛋白(urea transporter, UT)受体拮抗剂,其效果较其他化合物高50~100倍[2]。研究[3]表明:Urantide可通过抑制UⅡ/UT系统在多条信号通路中发挥生物学作用。AS在发生发展过程中表达大量的炎症相关因子,如白细胞介素6(interleukin-6, IL-6)和白细胞介素1(interleukin-1, IL-1)家族等[4-5]。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)在转导细胞外信号、炎症反应以及参与心血管疾病的调控方面扮演着重要的角色[6-7]。本课题组前期研究[8-9]显示:Urantide可抑制UⅡ/UT系统, 有效保护由AS造成的胸主动脉炎症损伤,但其具体机制尚未阐明,并且有关AS大鼠JNK信号通路变化以及Urantide对JNK信号通路影响的具体机制尚未明确。本课题组以AS模型大鼠作为研究对象,初步探讨了Urantide在防治AS过程中对JNK信号通路的影响,并初步阐明其作用机制。
1 材料与方法 1.1 实验动物和主要试剂SPF级Wistar雄性大鼠180只,体质量(190±10)g,北京维通利华实验动物技术有限公司提供,实验动物使用许可证:SCXK(京)-2016-0011,生产合格证:11400700127208。辛伐他汀购于北京诺华制药有限公司,Urantide由苏州强耀生物公司合成,免疫组织化学染色试剂盒(PV-6000)购于北京中杉金桥生物技术有限公司,TRIzol(DP405-02)、Fast Quant cDNA第一链合成试剂盒(KR106)和SYBR Green(FP205)购于天根生化科技(北京)有限公司,RIPA裂解液和超敏ECL化学发光试剂盒购于上海碧云天生物技术有限公司,BCA蛋白浓度测定试剂盒购于北京索莱科技有限公司,兔抗大鼠JNK和鼠抗大鼠磷酸化JNK(p-JNK)购于美国Cell Signaling Technology公司,β-actin一抗、HRP标记山羊抗兔和HRP标记山羊抗鼠二抗购于美国Bioworlde公司。
1.2 大鼠AS模型制备、实验分组和给药本课题组以参文[10-11]中的大鼠AS模型的制备方法为基础进行部分改进而成功复制大鼠AS模型(专利号:ZL 200310108363.9)。健康Wistar雄性大鼠180只适应性饲养1周后,按照随机原则分为2组:①对照组(n=30), 饲以普通饲料;② AS模型组(n=150), 实验开始时连续3 d每只大鼠腹腔注射维生素D3(Vit D3)150 U·kg-1,饲以高脂特制饲料。实验周期为4周。高脂特制饲料由北京科奥协力饲料有限公司合成,主要成分包括80%基础饲料、10%猪油、3.5%胆固醇、0.5%胆酸钠、5%白糖和0.2%丙基硫氧嘧啶。
大鼠AS模型制备成功后,将AS模型大鼠再次按照随机原则分为模型组、辛伐他汀组、Urantide 3 d组、Urantide 7 d组和Urantide 14 d组,每组30只。对照组和模型组大鼠每天经尾静脉注射生理盐水30 μg·kg-1,连续14 d; 辛伐他汀组大鼠每天经灌胃给予辛伐他汀5 μg·kg-1,连续14 d; 各Urantide组大鼠每天经尾静脉注射Urantide 30 μg·kg-1,分别连续3、7和14 d。
1.3 大鼠血清生化指标检测AS模型制备成功后,对照组和AS模型组大鼠腹主动脉取血,静置1h,3 000 r·min-1离心10min,取血清经全自动生化分析仪检测对照组和AS模型组大鼠血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(highdensity lipoprotein, HDL)和低密度脂蛋白(lowdensity lipoprotein, LDL)水平。
1.4 HE染色观察大鼠胸主动脉组织病理形态表现将离体固定的大鼠胸主动脉标本经梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋后制备成组织蜡块。将组织蜡块制备成0.5 μm厚蜡片,经二甲苯脱蜡、梯度酒精水化,常规HE染色后光镜下观察大鼠胸主动脉组织病理形态表现。
1.5 免疫组织化学法检测大鼠胸主动脉组织中JNK阳性表达和定位将大鼠胸主动脉组织蜡块制备成蜡片后,按照试剂盒说明进行免疫组织化学染色。应用病理图形分析软件ImageJ-Pro Plus 6.0对图像中阳性表达进行统计学分析,计算各组大鼠胸主动脉组织中JNK阳性表达强度的平均积分吸光度(IA)值。
1.6 实时荧光定量PCR(qRT-PCR)法检测大鼠胸主动脉组织中JNK mRNA表达水平TRIzol法提取大鼠胸主动脉样本总RNA,应用紫外分光光度计进行定量、Fast Quant cDNA第一链合成试剂盒逆转录成cDNA,SYBR Green试剂盒检测JNK和β-actin条带的Ct值。扩增条件:95℃、15min;95℃、10s,60℃、32s,40个循环,并绘制熔解曲线进行分析。以JNK与β-actin条带的Ct值的差值为ΔCt,采用2-ΔΔCt法计算JNK mRNA相对表达水平。引物序列见表 1。
| Gene | Primer sequence(5′-3′) | |
| JNK | Forward | TGATCGCCAGATCTCAGAAG |
| Reverse | CTGAGGGACACAGGTGACAG | |
| β-actin | Forward | CAGGCATTGCTGACAGGATG |
| Reverse | TGCTGATCCACATCTGCTGG |
RIPA裂解液提取大鼠胸主动脉样本总蛋白,应用BCA蛋白浓度测定试剂盒测定组织蛋白含量。45μg蛋白经SDS-PAGE分离、转膜和封闭,β-actin(1:5000)、JNK(1:1000)、p-JNK(1:2000)一抗4℃摇床孵育过夜;加入HRP标记抗兔二抗或HRP标记的抗鼠二抗(1:5000),摇床孵育1.5 h,TBST洗膜后用超敏ECL化学发光试剂盒显影。利用ImageJ光密度分析软件对目的蛋白条带进行灰度值分析。以目的蛋白与内参β-actin蛋白条带灰度值的比值作为目的蛋白相对表达水平。
1.8 统计学分析采用SPSS 20.0软件进行统计学分析。各组大鼠血清中血脂水平和大鼠胸主动脉组织中JNK阳性表达强度、JNK mRNA及蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 对照组和AS模型组大鼠血清学指标与对照组比较,AS模型组大鼠血清中TC、TG和LDL水平均明显升高(P < 0.05),HDL水平明显降低(P < 0.05)。见表 2。
| [x±s, cB/(mmol·L-1)] | |||||
| Group | n | TC | TG | HDL | LDL |
| Control | 30 | 2.26±0.71 | 0.28±0.08 | 3.20±0.79 | 0.30±0.08 |
| AS model | 150 | 12.25±1.92* | 0.77±0.12* | 0.93±0.23* | 1.70±0.32* |
| *P<0.05 vs control group. | |||||
对照组大鼠胸主动脉组织中血管弹力纤维层结构完整、内皮边缘整齐,中膜平滑肌细胞排列规则且无脂质沉积;模型组大鼠胸主动脉内膜破裂,中膜平滑肌细胞排列紊乱、弹力纤维层断裂,出现泡沫细胞以及钙化形成等典型的AS病理变化特征。与模型组比较,辛伐他汀组大鼠胸主动脉病理改变明显改善;随着治疗时间的延长,不同时间Urantide组大鼠胸主动脉脂质沉积、平滑肌排列、弹力纤维断裂及钙化等病理改变的缓解程度更加明显,与辛伐他汀组相近。见图 1(插页四)。

|
| A: Control group: B: Model group; C: Simvastatin group; D-F: Urantide 3 d, 7 d, and 14 d groups. 图 1 各组大鼠胸主动脉组织形态表现(HE, Bar=50 μm) Fig. 1 Morphology of thoracic aorta tissue of rats in various groups(HE, Bar=50 μm) |
|
|
对照组大鼠胸主动脉组织中JNK阳性颗粒微量表达。与对照组比较,模型组大鼠胸主动脉组织中斑块等病变部位JNK阳性表达强度增加(P<0.05)。与模型组比较,辛伐他汀组大鼠胸主动脉组织中JNK阳性表达强度降低(P < 0.05);随着治疗时间的延长,不同时间Urantide组大鼠胸主动脉组织中JNK阳性表达强度呈逐渐下调趋势(P < 0.05),尤以Urantide 14 d组作用最为明显,与辛伐他汀组比较明显降低(P < 0.05)。见图 2(插页五)和表 3。
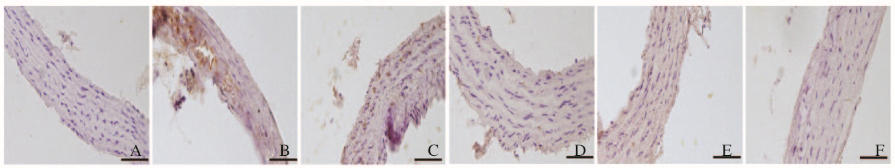
|
| 图 2 免疫组织化学染色检测各组大鼠胸主动脉组织中JNK阳性表达(Bar=50 μm) Fig. 2 Positive expressions of JNK in thoracic aorta tissue of rats in various groups detected by immunohistochemistry staining (Bar-50 μm) |
|
|
| (n=30, x±s) | |
| Group | Positive expression intensity of JNK |
| Control | 0.94±0.07 |
| Model | 3.43±0.31* |
| Simvastatin | 1.57±0.22△ |
| Urantide 3 d | 2.21±0.28△ |
| Urantide 7 d | 1.33±0.13△ |
| Urantide 14 d | 1.12±0.11△# |
| *P < 0.05 vs control group; △P<0.05 vs model group; #P < 0.05 vs simvastatin group. | |
与对照组比较,模型组大鼠胸主动脉组织中JNK mRNA表达水平明显升高(P<0.05)。与模型组比较,辛伐他汀组大鼠胸主动脉组织中JNK mRNA表达水平明显降低(P<0.05);随着治疗时间的延长,不同时间Urantide组大鼠胸主动脉组织中JNK mRNA表达水平呈明显下调趋势(P < 0.05)。与辛伐他汀组比较,不同时间Urantide组大鼠胸主动脉组织中JNK mRNA表达水平进一步降低(P < 0.05)。见表 4。
| (n=30, x±s) | |
| Group | Expression level of JNK mRNA |
| Control | 1.00±0.02 |
| Model | 1.24±0.01* |
| Simvastatin | 0.88±0.03△ |
| Urantide 3 d | 0.39±0.01△# |
| Urantide 7 d | 0.26±0.02△# |
| Urantide 14 d | 0.35±0.01△# |
| *P < 0.05 vs control group; △P<0.05 vs model group; #P < 0.05 vs simvastatin group. | |
与对照组比较,模型组大鼠胸主动脉组织中JNK和p-JNK蛋白表达水平明显升高(P < 0.05)。与模型组比较,辛伐他汀组大鼠胸主动脉组织中p-JNK蛋白表达水平明显降低(P < 0.05),不同时间Urantide组大鼠胸主动脉组织中JNK和p-JNK蛋白表达水平呈逐渐下调趋势(P < 0.05)。与辛伐他汀组比较,不同时间Urantide组大鼠胸主动脉组织中JNK和p-JNK蛋白表达水平(除Urantide 7 d组JNK和Urantide 3 d组p-JNK外)进一步降低(P < 0.05)。见图 3和表 5。

|
| Lane 1: Control group; Lane 2: Model group; Lane 3: Simvastatin group; Lane 4-6: Urantide 3 d, 7 d, and 14 d groups. 图 3 各组大鼠胸主动脉组织中JNK和p-JNK蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of JNK and p-JNK proteins in thoracic aorta tissue of rats in various groups |
|
|
| (n=30, x±s) | ||
| Group | JNK | p-JNK |
| Control | 0.74±0.05 | 0.10±0.02 |
| Model | 1.47±0.08* | 1.45±0.17* |
| Simvastatin | 1.35±0.08 | 0.38±0.08△ |
| Urantide 3 d | 1.04±0.04△# | 0.80±0.04△ |
| Urantide 7 d | 1.25±0.10△ | 0.21±0.03△# |
| Urantide 14 d | 0.89±0.03△# | 0.15±0.02△# |
| *P < 0.05 vs control group; △ P<0.05 vs model group; #P < 0.05 vs simvastatin group. | ||
AS是多种心血管疾病最常见的诱因,严重威胁人类的健康,因其发病机制复杂,预后效果差成为世界性的医学难题。美国病理学家Ross于1999年提出AS的炎症学说,该学说阐述心血管疾病患者具有高胆固醇血症的主要临床特征,但仍需考虑其他因素的影响,如炎症等。近年来大量研究[12-13]表明:在AS进展阶段存在多种炎症相关因子,提示炎症反应在AS各阶段均起重要作用。因而抑制炎症成为治疗AS的关键环节。
本研究结果显示:模型组大鼠胸主动脉组织中有粥样斑块和泡沫细胞形成,存在中膜的弹力纤维层断裂以及钙化形成等病理现象,并发生了明显的高脂血症;JNK阳性颗粒大量表达于病变部位,JNK mRNA和p-JNK蛋白表达水平升高,表明血管炎症反应可能是通过JNK炎症信号通路的激活诱导的, 与相关文献[14-15]报道一致,在AS发生时动脉粥样斑块和血管平滑肌细胞中JNK炎症信号高度活化,因此推测降低JNK基因的表达或抑制其活性对预防脂质沉积和缓解AS具有明显的作用。本课题组采用多肽类化合物Urantide治疗AS大鼠,探讨JNK信号通路的变化趋势及其临床意义。
UⅡ是广泛存在于哺乳类动物血管组织中的血管活性肽物质,其特异性与G蛋白偶联受体14(GPR14)受体结合构成UⅡ/UT受体系统,在心血管疾病、炎症、肝肾功能衰竭和内分泌等多种疾病中发挥重要作用[16-17]。而Urantide是UⅡ/UT受体系统的特异性的受体拮抗剂,抑制其发挥生物学作用,可达到防治AS的目的。
目前,治疗AS常以他汀等降脂类药物为主,但不良反应明显,无法达到预期效果[18],因此采用特异性靶向治疗药物抑制UⅡ/UT受体系统进而抑制其所引发的炎症反应成为疾病治疗的关键。本研究结果表明:与模型组比较,随治疗时间的延长,不同时间Urantide组大鼠胸主动脉组织中泡沫细胞、弹性纤维断裂以及钙化等病理现象得到有效缓解;胸主动脉组织中JNK阳性颗粒表达减少,JNK mRNA和p-JNK蛋白表达水平呈逐步下调趋势。由此证明,Urantide可通过拮抗UⅡ/UT受体系统而抑制JNK信号通路的活化,减轻AS大鼠的血管炎症反应,与CHEN等[19]研究结论相似,Urantide可抑制UⅡ促进JNK活化。同样,上述结果与其他研究[20-21]结果相似,抑制JNK信号通路的活性可有效缓解AS症状。本研究得出初步结论:多肽类化合物Urantide可有效缓解大鼠的AS病症,其机制可能与JNK信号通路被抑制有关。
综上所述,血管炎症反应和JNK信号通路的活化在AS发生过程中发挥关键作用。本研究结果进一步证明,Urantide可通过抑制JNK介导的炎症反应,改善AS时胸主动脉的功能达到防治AS的目的。然而有关Urantide通过拮抗UⅡ/UT受体系统进而抑制JNK信号通路的分子调控机制仍需进一步研究。
| [1] | 吴惠惠, 彭春霞, 卫群, 等. 白细胞介素37与动脉粥样硬化关系的研究进展[J]. 中国动脉硬化杂志, 2018, 26(2): 213–216. DOI:10.3969/j.issn.1007-3949.2018.02.019 |
| [2] | ZHAO J, ZHANG S F, SHI Y, et al. Effects of urotensin Ⅱ and its specific receptor antagonist urantide on rat vascular smooth muscle cells[J]. Bosn J Basic Med Sci, 2013, 13(2): 78–83. DOI:10.17305/bjbms.2013.2369 |
| [3] | DIEGO B, ANTONIO L, PIETRO C, et al. Urantide conformation and interaction with the Urotensin-Ⅱreceptor[J]. Archiv Der Pharmazie, 2014, 347(3): 185–192. DOI:10.1002/ardp.201300269 |
| [4] | HOSEINI Z, SEPAHVAND F, RASHIDI B, et al. NLRP3 inflammasome:Its regulation andinvolvement in atherosclerosis[J]. J Cell Physiol, 2018, 233(3): 2116–2132. DOI:10.1002/jcp.25930 |
| [5] | ZHANG SS, ZOU J, LI PY, et al. Curcumin Protects against atherosclerosis in apolipoprotein E-knockout mice by inhibiting toll-like receptor 4 expression[J]. J Agric Food Chem, 2018, 66(2): 449–456. DOI:10.1021/acs.jafc.7b04260 |
| [6] | YANG L, LIU JL, QI GY. Mechanism of the effect of saikosaponin on atherosclerosis in vitro is based on the MAPK signaling pathway[J]. Mol Med Rep, 2017, 16(6): 8868–8874. DOI:10.3892/mmr.2017.7691 |
| [7] | OH J, RIEK A E, ZHANG R M, et al. Deletion of JNK2 prevents vitamin-D-deficiency-induced hypertension and atherosclerosis in mice[J]. J Steroid Biochem Mol Biol, 2018, 177: 179–186. DOI:10.1016/j.jsbmb.2017.09.014 |
| [8] | ZHAO J, YU Q X, KONG W, et al. The urotensin Ⅱ receptor antagonist, urantide, protects against atherosclerosis in rats[J]. Exp Ther Med, 2013, 5(6): 1765–1769. DOI:10.3892/etm.2013.1052 |
| [9] | ZHAO J, XIE L D, SONG C J, et al. Urantide improves atherosclerosis by controlling C-reactive protein, monocyte chemotactic protein-1 and transforming growth factor-β expression in rats[J]. Exp Ther Med, 2014, 7(6): 1647–1652. DOI:10.3892/etm.2014.1654 |
| [10] | HUANG Z Y, YANG P Y, AIMOFTI MR, et al. Comparative analysis of the proteome of leftventricular heart of arteriosclerosis in rat[J]. Life Sci, 2004, 75(26): 3103–3115. DOI:10.1016/j.lfs.2004.04.054 |
| [11] | JIAO Y B, RUI Y C, LI T J, et al. Expression of pro-inflammatory and anti-inflammatory cytokines in brain of atherosclerotic rats and effects of Ginkgo biloba extract[J]. Acta Pharmacol Sin, 2005, 26(7): 835–839. DOI:10.1111/j.1745-7254.2005.00106.x |
| [12] | 牛镜磊, 张钲. 新型炎症标志物在动脉粥样硬化中的研究进展[J]. 中国循环杂志, 2017, 32(5): 516–517. |
| [13] | MARANHAO R C, LEITE JR A C. Development of anti-atherosclerosis therapy based on the inflammatory and proliferative aspects of the disease[J]. Curr Pharm Des, 2015, 21(9): 1196–1204. DOI:10.2174/1381612820666141013150714 |
| [14] | ZHAO D, TONG L, ZHANG L, et al. Tanshinone Ⅱ A stabilizes vulnerable plaques bysuppressing RAGE signaling and NF-kappaB activation in apolipoprotein-E-deficient mice[J]. Mol Med Rep, 2016, 14(6): 4983–4990. DOI:10.3892/mmr.2016.5916 |
| [15] | UMEBASHI K, TOKITO A, YAMAMOTO M, et al. Interleukin-33 induces interleukin-8 expression via JNK/c-Jun/AP-1 pathway in human umbilical vein endothelial cells[J]. PLoS One, 2018, 13(1): e0191659. DOI:10.1371/journal.pone.0191659 |
| [16] | NISHI M, YONESU K, TAGAWA H, et al. A Novel and highly potent urotensin Ⅱ Receptor antagonist inhibits urotensin Ⅱ-induced pressure response in mice[J]. J Cardiovasc Pharmacol, 2019, 73(1): 15–21. DOI:10.1097/FJC.0000000000000618 |
| [17] | SVISTUNOV A A, TARASOV V V, SHAKHMARDANOVA S A, et al. Urotensin Ⅱ:molecular mechanisms of biological activity[J]. Curr Protein Pept Sci, 2018, 19(9): 924–934. DOI:10.2174/1389203718666170829162335 |
| [18] | 汤伟. 辛伐他汀治疗冠心病合并高脂血症34例副作用分析[J]. 中国实用医药, 2013, 8(2): 51–52. DOI:10.3969/j.issn.1673-7555.2013.02.035 |
| [19] | CHEN ZD, XU JH, YE Y, et al. Urotensin Ⅱ inhibited the proliferation of cardiac side population cells in mice during pressure overload by JNK-LRP6 signalling[J]. J Cell Mol Med, 2014, 18(5): 852–862. DOI:10.1111/jcmm.12230 |
| [20] | GENG J, YANG C C, WANG B J, et al. Trimethylamine N-oxide promotes atherosclerosis via CD36-dependent MAPK/JNK pathway[J]. Biomed Pharmacother, 2018, 97: 941–947. DOI:10.1016/j.biopha.2017.11.016 |
| [21] | KWOK K H M, CHENG K K Y, HOO R L C, et al. Adipose-specific inactivation of JNK alleviates atherosclerosis in apoE-deficient mice[J]. Clin Sci (Lond), 2016, 130(22): 2087–2100. DOI:10.1042/CS20160465 |
 2019, Vol. 45
2019, Vol. 45


