扩展功能
文章信息
- 代娟娟, 杨丽娟, 杜静, 苗双, 席思川, 李晨, 武艳
- DAI Juanjuan, YANG Lijuan, DU Jing, MIAO Shuang, XI Sichuan, LI Chen, WU Yan
- 人LncRNA MIR31HG基因稳定转染PC9细胞系的构建及其对细胞增殖和迁移的影响
- Construction of PC9 cell lines stably transfectedwith human LncRNAMIR31HG gene and its effects on cell proliferation and migration
- 吉林大学学报(医学版), 2019, 45(04): 801-806
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 801-806
- 10.13481/j.1671-587x.20190410
-
文章历史
- 收稿日期: 2018-09-26
2. 滨州医学院附属医院代谢与神经精神疾病研究所, 山东 滨州 256603
2. Institute for Metabolic and Neuropsychiatric Disorders, Affiliated Hospital, Binzhou Medical University, Binzhou 256603, China
肺癌的发生发展是遗传因素与环境因素共同作用的结果,在细胞水平表现为细胞生长和增殖的不可控性,基因水平表现为大量促癌基因的过度表达和抑癌基因的失活。长链非编码RNA(long non-coding, LncRNA)是一类长度大于200个核苷酸的RNA的总称,不具有编码蛋白质的能力,而是以RNA的形式发挥多种重要生物学功能[1]。LncRNA特异性分布在不同组织或癌细胞中[2]。近年来,越来越多的研究[3-4]证实:LncRNA在多种人类肿瘤中异常表达,其作为促癌或抑癌基因在细胞转化中发挥重要作用。MIR31HG基因是定位于人9号染色体p21.3、长度为2 166 bp的LncRNA。MIR31HG基因在肿瘤中的表达和作用较复杂。有文献[5-11]报道:MIR31HG在口腔癌、头颈肿瘤、鳞状细胞癌及乳腺癌组织中表达水平明显升高,而在胃癌、前列腺癌及膀胱癌组织中的表达水平则明显降低。在不同肿瘤中,MIR31HG基因既可以作为抑癌基因也可以作为促癌基因发挥作用。SHI等[8]研究显示:利用RNA干扰方法敲低MIR31HG表达水平能抑制乳腺癌细胞的增殖和迁移。NIE等[12]报道:敲低MIR31HG的表达水平则能促进胃癌细胞的增殖。而过表达MIR31HG能抑制胃癌和肝癌细胞的增殖[9, 13]。同时也有研究[14-15]表明:过表达MIR31HG能促进结肠癌和头颈肿瘤细胞的生长,促进肿瘤形成。文献[16-17]报道:MIR31HG在小鼠和人肺癌组织中的表达水平明显升高,敲低MIR31HG表达水平能抑制小鼠和人肺癌A549细胞生长。本课题组前期研究[18]显示:焦油浓缩物能导致MIR31HG在肺癌细胞中表达水平明显增加,然而MIR31HG的过表达对肺癌细胞的调控机制尚无报道。本研究利用基因工程克隆技术,构建了MIR31HG基因的真核表达载体pcDNA3.1-MIR31HG,并将其转染入肺癌PC9细胞,建立了稳定表达MIR31HG的PC9细胞系,并通过细胞增殖和细胞划痕愈合实验评价MIR31HG对细胞增殖和迁移能力的调节作用,以期为研究MIR31HG在肺癌发展中的作用机制奠定基础,同时为以MIR31HG为靶点的抗癌药物设计提供理论依据。
1 材料与方法 1.1 细胞和主要试剂人肺癌PC9细胞购自美国模式培养物集存库(American Type Culture Collection, ATCC)。大肠埃希菌DH5α、限制性内切酶KpnⅠ和EcoRⅠ、T4 DNA连接酶、TRIzoⅠ、SYBR Premix Ex Taq试剂盒和反转录酶试剂盒均购自大连宝生物工程有限公司,凝胶回收试剂盒和小量质粒提取试剂盒购自上海碧云天生物技术有限公司,去内毒素质粒抽提试剂盒购自美国Omega公司,表达载体pcDNA3.1(-)质粒购自美国Invitrogen Life Technologies公司,脂质体Lipo2000购自上海Invitrogen生命技术公司,胎牛血清和DMEM培养基购自美国Hyclone公司,CCK-8试剂盒购自日本同仁化学研究所。引物DNA合成和载体DNA测序均由上海生工生物工程股份有限公司完成。
1.2 RNA提取和逆转录收取细胞用TRIzol室温裂解5 min,加入氯仿萃取,静置10 min, 12 000 r· min-1离心10 min, 吸取水相加入异丙醇,静止30 min沉淀RNA,12 000 r· min-1离心10 min,弃掉上层废液,沉淀用70%乙醇洗涤2次,12 000 r· min-1离心1 min。弃掉上层废液,风干,加入50 μL无RNA酶的DEPC水,―80℃保存备用。按照反转录试剂盒PrimeScriptTM RT reagent Kit说明书进行cDNA的合成,―20℃保存备用。
1.3 引物设计根据GenBank已发表的MIR31HG基因保守序列,利用Premier 6.0引物设计软件进行引物设计,酶切位点分别为KpnⅠ和EcoRⅠ(由下划线标出),引物序列如下,上游引物:5′-GGGGTACCCCAATATATATAGGTTCCACGTCCGGCGCCT-3′,下游引物5′- CGGAATTCCGTTAGACAAGGTCACAAAG-3′。
1.4 pcDNA3.1-MIR31HG真核表达载体构建以制备的cDNA为模板,通过RT-PCR方法扩增MIR31HG基因,在微量离心管中加入下列试剂(50 μL体系):5×PCR Buffer 10.0 μL,dNTP(2.5 mmol·L-1)4.0 μL,cDNA (200 ng)2.0 μL, Taq酶(0.5 U·μL-1)1.0 μL,dd H2O 39.0 μL。PCR反应程序:94℃、5 min;94℃、30 s,56℃、30 s, 72℃、30 s,35个循环;72℃、10 min;4℃保存。通过电泳验证片段大小,琼脂糖凝胶回收试剂盒将扩增产物回收后,空质粒pcDNA3.1(-)及扩增出来的MIR31HG基因片段同时用KpnⅠ和EcoRⅠ进行双酶切,然后将酶切产物用T4连接酶进行连接。将连接后的反应产物转化DH5α感受态细胞,转化菌液均匀涂布于LB固体培养基上(含50 mg·L-1Ampicillin),37℃倒置过夜培养。次日挑取生长的单个菌落放入LB培养液(含50 mg·L-1Ampicillin)中进行培养,PCR法进行阳性克隆鉴定,并提取质粒进行双酶切鉴定和DNA序列测定。
1.5 细胞培养和转染肺癌PC9细胞用含有10%胎牛血清的DMEM培养基,于37℃、5% CO2的环境中培养。收集处于对数生长期的细胞,使细胞密度达到1.0×105 mL-1,按2 mL/孔将细胞铺于6孔板中,待次日细胞密度达到80%~90%时进行转染。细胞分为未转染组、转染pcDNA3.1空载体组和转染重组质粒pcDNA3.1-MIR31HG组,并按照脂质体转染试剂盒说明书进行转染。
1.6 MIR31HG过表达稳定株筛选① G418最佳作用浓度筛选:将PC9细胞传代接种到24孔板,使每孔细胞的覆盖率达60%左右,分为未转染组、转染pcDNA3.1空载体组和转染pcDNA3.1-MIR31HG组,48h后每组分别加入G418,使其终浓度分别为0、200、400、600、800和1000 mg·L-1,连续观察4~7d后,选取能导致未转染组细胞完全死亡的G418浓度作为后续筛选重组质粒细胞克隆的最佳工作浓度。②稳定株的筛选:根据筛选出的最佳G418作用浓度维持培养转染pcDNA3.1和pcDNA3.1-MIR31HG的PC9细胞直至获得稳定存活的细胞株,并将细胞分别命名为PC9-pcDNA3.1(空载体组)和PC9-pcDNA3.1-MIR31HG(稳定转染组)。
1.7 PC9细胞中MIR31HG mRNA表达水平检测分别收集1.6中空载体组和稳定转染组细胞,按照1.2中步骤提取细胞总RNA,然后按照逆转录试剂盒说明书将总RNA逆转录成cDNA,采用RT-PCR法检测MIR31HGmRNA表达水平,以GAPDH作为内参基因。PCR反应条件:95℃、10 s;95℃、5 s,56℃、34 s,40个循环。引物序列:MIR31HG,上游引物5′-TGCCAGTAGAGGGAAGAGGA-3′,下游引物5′-TCCTGTCAGATCAGCAGTGG-3′;GAPDH,上游引物5′-CTCCTCCTGTTCGACAGTCAGC-3′,下游引物5′-CCCAATACGACCAAATCCGTT-3′。荧光定量熔解曲线确定PCR反应的特异性,根据标准曲线以及荧光曲线的Ct值,按照2-ΔΔCT法计算MIR31HG mRNA相对表达水平。
1.8 CCK-8法检测细胞增殖活性将空载体组和稳定转染组细胞用胰酶消化后进行细胞计数,将细胞密度调整为1×105 mL-1,然后接种于96孔板中,每孔接种100 μL,每组设6个平行复孔。然后分别于培养12、24、36和48 h时在避光条件下每孔加入10 μL CCK-8反应液,在细胞培养箱内37℃温度下继续避光反应2 h。最后用酶标仪在450 nm处测定各孔的吸光度(A)值,以仅加培养液的空白孔为对照孔调零。以A值表示各组细胞的增殖活性。
1.9 细胞划痕愈合实验将空载体组和稳定转染组细胞悬液R接种于6孔板,待细胞生长融合成单层状时,用移液器枪头在细胞板的底面上进行直线划痕,PBS冲洗3次,然后加入无血清的DMEM培养液继续培养,分别于培养0、24和48 h时用倒置显微镜观察细胞划痕愈合状况,拍照,采用Image J软件测量划痕宽度,用细胞划痕愈合率表示细胞迁移能力。细胞划痕愈合率=(0 h划痕宽度-24 h或48 h划痕宽度)/0 h划痕宽度。
1.10 统计学分析采用Graphpad Prism 6.0统计软件进行统计学分析并制图。采用Shapiro-Wilk检验验证各组或各时间点细胞中基因表达、细胞增殖和迁移能力的正态分布情况。各组细胞中MIR31HG mRNA表达水平、细胞增殖活性和细胞划痕愈合率以x±s表示,两组间比较采用t检验,2种细胞系上述指标不同时间点间比较采用双因素方差分析,各时间点间两两比较采用Turkey检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 MIR31HG基因扩增和真核表达载体酶切鉴定琼脂糖凝胶电泳结果显示:扩增得到2150 bp的MIR31HG特异基因片段(图 1A)。真核表达载体pcDNA3.1-MIR31HG经双酶切后分别产生约2150和5400 bp的2个片段,而空载体对照则只有5400 bp1个片段(图 1B)。通过测序并与GenBank中序列进行比对,确定重组质粒pcDNA3.1中插入了MIR31HG完整开放阅读框(ORF)基因片段。
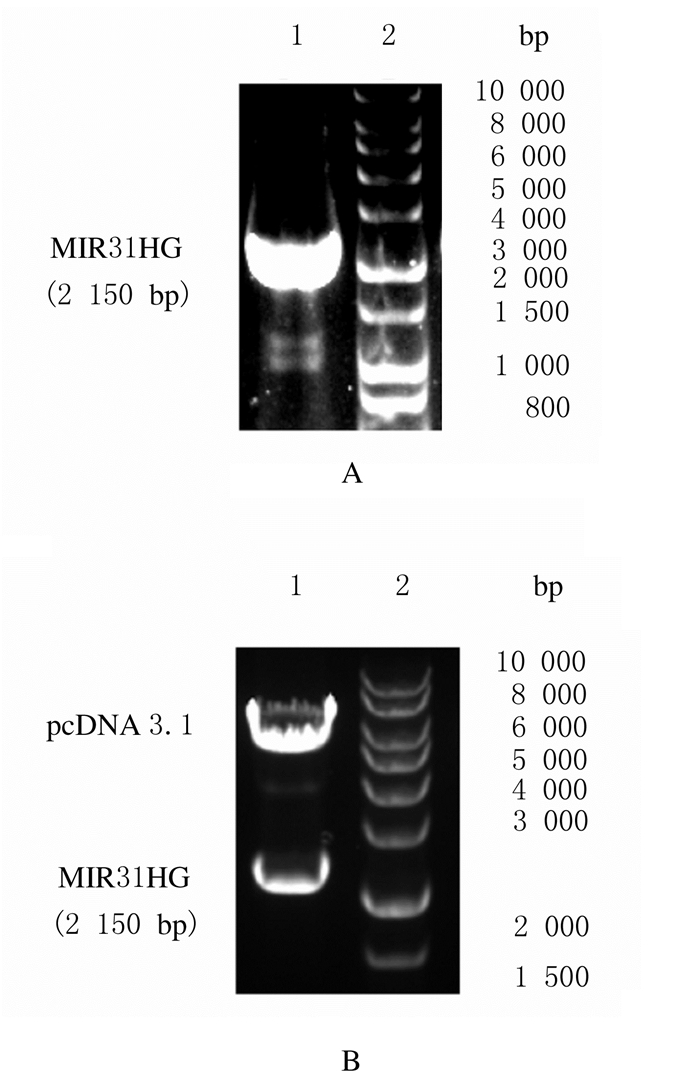
|
| A:Amplification product of MIR31HG PCR (Lane 1: PCR product; Lane 2: DNA marker); B: Identification of MIR31HG eukaryotic expression vector (Lane 1: Product of enzyme digestion; Lane 2: DNA marker). 图 1 MIR31HG基因PCR产物和MIR31HG真核表达载体酶切鉴定凝胶电泳图 Fig. 1 Electrophoregram of enzyme digestion identification of MIR31HG gene PCR product and MIR31HG eukaryotic expression vector |
|
|
稳定转染组PC9-pcDNA3.1-MIR31HG细胞中MIR31HG mRNA明显表达,空载体组PC9-pcDNA3.1细胞中则表达非常少(图 2)。稳定转染组细胞中MIR31HG mRNA表达水平(6.48±0.14)明显高于空载体组(1.00±0.08)(t=34.03, P < 0.05)。
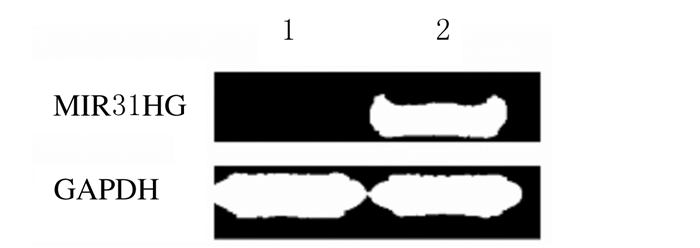
|
| Lane1: Empty vector group; Lane 2: Stable transfection group. 图 2 2组细胞中MIR31HG mRNA表达电泳图 Fig. 2 Electrophoregram of expressions of MIR31HG mRNA in cells in two groups |
|
|
稳定转染组不同时间点细胞增殖活性比较差异有统计学意义(F=103.2,P < 0.05)。与空载体组比较,0和12 h时稳定转染组细胞增殖活性差异无统计学意义(P>0.05),24、36和48 h时细胞增殖活性明显增加(P < 0.01)。见表 1。
| (n=6, x±s) | |||||
| Group | Proliferation activity of PC9 cells | ||||
| (t/h) 0 | 12 | 24 | 36 | 48 | |
| Empty vector | 0.51±0.04 | 1.03±0.03 | 1.19±0.08 | 1.22±0.03 | 1.29±0.06 |
| Stable transfection | 0.52±0.02 | 1.10±0.07 | 1.69±0.03* | 1.64±0.10* | 1.72±0.06* |
| * P < 0.01 vs empty vector group. | |||||
稳定转染组不同时间点细胞划痕愈合率比较差异有统计学意义(F= 95.86,P < 0.05)。与空载体组(29.58 %± 1.86%)比较,24 h时稳定转染组细胞划痕愈合率(24.57% ± 0.29%)差异无统计学意义(P>0.05),但48 h时细胞划痕愈合率(52.33% ± 2.57%)明显高于空载体组(38.36% ± 1.94%)(P < 0.05)。见图 3。

|
| A-C:Empty vector group; D-F:Stable transfection group; A, D:0 h; B, E:24 h; C, F:48 h. 图 3 细胞划痕愈合实验检测各组PC9细胞迁移能力 Fig. 3 Migration abilities of PC9 cells in various groups detected by cell scratch healing assay |
|
|
哺乳动物全基因组和转录组研究数据[19-20]显示:蛋白编码基因仅有约2万个,在基因组中只占非常小的比例(1%~2%),而基因组中的大部分基因(超过90%)编码了远远超过预期的大量非编码RNA(non-coding,ncRNA)。已知的ncRNA主要包括微小RNA(miRNA)、LncRNA、piwi互作RNA(piRNA)和核仁小分子RNA(snoRNA)等。恶性肿瘤是由体细胞突变并逃避机体的监控系统而导致的癌基因激活和(或)抑癌基因失活从而使细胞异常增殖和分化而产生的。研究[18]表明:大量的ncRNA异常变化参与人体恶性肿瘤的形成过程。MIR31HG基因在不同肿瘤中的异常表达情况非常不同,在有些肿瘤中表达水平明显升高[6, 8, 21],而在另一些肿瘤中表达水平则明显降低[9-10],说明MIR31HG在不同肿瘤发生发展过程中的作用不同。文献[8, 12, 14]报道:MIR31HG基因既可以为抑癌基因也可以作为促癌基因发挥作用。
本课题组前期研究[18]显示:焦油浓缩物能导致MIR31HG在肺癌细胞中表达水平明显增加。文献[22]报道:MIR31HG在小鼠和人肺癌组织中的表达水平明显升高,表明MIR31HG在肺癌组织中异常表达。本研究结果表明:过表达MIR31HG后PC9细胞的增殖和迁移能力明显增加,与文献[16]报道的敲低MIR31HG表达水平能抑制小鼠和人肺癌A549细胞生长的结果一致。最近研究[23]显示:MIR31HG在吉非替尼敏感的PC9细胞系中表达水平明显低于吉非替尼抵抗的PC9细胞系,MIR31HG通过EGFR/PI3K/AKT信号通路介导了PC9细胞对吉非替尼敏的抵抗性。上述结果说明:MIR31HG作为一种促癌基因在肺癌中发挥重要作用,也可能参与了肿瘤的耐药性。
研究[24]显示:LncRNA通过与染色体、功能蛋白和RNA的相互作用在细胞周期分布、细胞分化、细胞增殖和凋亡等生物学过程中发挥重要的调控作用。此外,LncRNA还可以为染色质调节复合物提供平台支架,发挥调节基因转录的作用[25-26]。文献[5, 15]报道:MIR31HG可以通过与低氧诱导因子1α(HIF-1α)形成复合物调控其他基因的表达,在口腔癌和头颈癌形成过程中发挥重要作用。MIR31HG也可以通过抑制LATS2和PPP2R2A基因的表达或激活Wnt/β-catenin信号通路发挥促进肺癌细胞增殖和迁移的作用[16-17]。本课题组前期研究[18]显示:MIR31HG可能与PEA15(重要的抑癌基因)、Dickkopf相关蛋白1(DKK1,可抑制Wnt信号通路)、细胞质FMR1相关蛋白(CYFIP1,肿瘤转移抑制因子)和Let-7(抑癌miRNA)等共同参与了肺癌的发生发展过程,但MIR31HG对肺癌细胞的具体作用机制还需进一步深入研究。
综上所述,本研究首先构建了MIR31HG的真核过表达载体,建立了MIR31HG稳定过表达的肺癌细胞系,并进一步证明过表达MIR31HG能促进肺癌PC9细胞的增殖和迁移。本研究结果为探讨肺癌的致病机制和靶向治疗提供了依据。
| [1] | RINN J L, CHANG H Y. Genome regulation by long noncoding RNAs[J]. Annu Rev Biochem, 2012, 81: 145–166. DOI:10.1146/annurev-biochem-051410-092902 |
| [2] | YER M K, NIKNAFS Y S, MALIK R, et al. The landscape of long noncoding RNAs in the human transcriptome[J]. Nat Genet, 2015, 47(3): 199–208. DOI:10.1038/ng.3192 |
| [3] | WANG K C, YANG Y W, LIU B, et al. A long noncoding RNA maintains active chromatin to coordinate homeotic gene expression[J]. Nature, 2011, 472(7341): 120–124. DOI:10.1038/nature09819 |
| [4] | HARRIES L W. Long non-coding RNAs and human disease[J]. Biochem Soc Trans, 2012, 40(4): 902–906. DOI:10.1042/BST20120020 |
| [5] | SHIH J W, CHIANG W F, WU A T, et al. Long noncoding RNA LncHIFCAR/MIR31HG is a HIF-1α co-activator driving oral cancer progression[J]. Nat Commun, 2017, 8: 15874. DOI:10.1038/ncomms15874 |
| [6] | LIU C J, TSAI M M, HUNG P S, et al. miR-31 ablates expression of the HIF regulatory factor FIH to activate the HIF pathway in head and neck carcinoma[J]. Cancer Res, 2010, 70(4): 1635–1644. DOI:10.1158/0008-5472.CAN-09-2291 |
| [7] | SUN K, ZHAO X, WAN J, et al. The diagnostic value of long non-coding RNA MIR31HG and its role in esophageal squamous cell carcinoma[J]. Life Sci, 2018, 202: 124–130. DOI:10.1016/j.lfs.2018.03.050 |
| [8] | SHI Y, LU J, ZHOU J, et al. Long non-coding RNA Loc554202 regulates proliferation and migration in breast cancer cells[J]. Biochem Biophys Res Commun, 2014, 446(2): 448–453. DOI:10.1016/j.bbrc.2014.02.144 |
| [9] | GUO J, MIAO Y, XIAO B, et al. Differential expression of microRNA species in human gastric cancer versus non-tumorous tissues[J]. J Gastroen Hepatol, 2009, 24(4): 652–657. DOI:10.1111/jgh.2009.24.issue-4 |
| [10] | SCHAEFER A, JUNG M, MOLLENKOPF H J, et al. Diagnostic and prognostic implications of microRNA profiling in prostate carcinoma[J]. Int J Cancer, 2010, 126(5): 1166–1176. |
| [11] | AHERI M, OMRANI M D, GHAFOURI-FARD S. Long non-coding RNA expression in bladder cancer[J]. Biophys Rev, 2018, 10(4): 1205–1213. DOI:10.1007/s12551-017-0379-y |
| [12] | NIE F Q, MA S, XIE M, et al. Decreased long noncoding RNA MIR31HG is correlated with poor prognosis and contributes to cell proliferation in gastric cancer[J]. Tumor Biol, 2016, 37(6): 7693–7701. DOI:10.1007/s13277-015-4644-z |
| [13] | YAN S, TANG Z, CHEN K, et al. Long noncoding RNA MIR31HG inhibits hepatocellular carcinoma proliferation and metastasis by sponging microRNA-575 to modulate ST7L expression[J]. J Exp Clin Canc Res, 2018, 37(1): 214. DOI:10.1186/s13046-018-0853-9 |
| [14] | SUN D, YU F, MA Y, et al. MicroRNA-31 activates the RAS pathway and functions as an oncogenic MicroRNA in human colorectal cancer by repressing RAS p21 GTPase activating protein 1(RASA1)[J]. J Biol Chem, 2013, 288(13): 9508–9518. DOI:10.1074/jbc.M112.367763 |
| [15] | WANG R, MA Z, FENG L, et al. LncRNA MIR31HG targets HIF1A and P21 to facilitate head and neck cancer cell proliferation and tumorigenesis by promoting cell-cycle progression[J]. Mol Cancer, 2018, 17(1): 162. DOI:10.1186/s12943-018-0916-8 |
| [16] | LIU X, SEMPERE L F, OUYANG H, et al. MicroRNA-31 functions as an oncogenic microRNA in mouse and human lung cancer cells by repressing specific tumor suppressors[J]. J Clin Invest, 2010, 120(4): 1298–1309. DOI:10.1172/JCI39566 |
| [17] | ZHENG S, ZHANG X, WANG X, et al. MIR31HG promotes cell proliferation and invasion by activating the Wnt/β-catenin signaling pathway in non-small cell lung cancer[J]. Oncol Lett, 2019, 17(1): 221–229. |
| [18] | XI S, YANG M, TAO Y, et al. Cigarette smoke induces C/EBP-β-mediated activation of miR-31 in normal human respiratory epithelia and lung cancer cells[J]. PLoS One, 2010, 5(10): e13764. DOI:10.1371/journal.pone.0013764 |
| [19] | BEMSTEIN B, BIMEY E, DUNHAM I. An integrated encyclopedia of DNA elements in the human genomc[J]. Nature, 2012, 489(7414): 57–74. DOI:10.1038/nature11247 |
| [20] | MUERS M. RNA:Genome-wide views of long non-coding RNAs[J]. Nat Rev Genetics, 2011, 12(11): 742–743. |
| [21] | WONG Q W L, LUNG R W M, LAW P T Y, et al. MicroRNA-223 is commonly repressed in hepatocellular carcinoma and potentiates expression of Stathmin1[J]. Gastroenterology, 2008, 135(1): 257–269. DOI:10.1053/j.gastro.2008.04.003 |
| [22] | LIU B, CHEN Y, YANG J. LncRNAs are altered in lung squamous cell carcinoma and lung adenocarcinoma[J]. Oncotarget, 2017, 8(15): 24275. |
| [23] | WANG B, JIANG H, WANG L, et al. Increased MIR31HG lncRNA expression increases gefitinib resistance in non-small cell lung cancer cell lines through the EGFR/PI3K/AKT signaling pathway[J]. Oncol Lett, 2017, 13(5): 3494–3500. DOI:10.3892/ol.2017.5878 |
| [24] | LIU X, LI D, ZHANG W, et al. Long non-coding RNA gadd7 interacts with TDP-43 and regulates Cdk6 mRNA decay[J]. EMBO J, 2012, 31(23): 4415–4427. DOI:10.1038/emboj.2012.292 |
| [25] | WANG K C, CHANG H Y. Molecular mechanisms of long noncoding RNAs[J]. Mol Cell, 2011, 43(6): 904–914. DOI:10.1016/j.molcel.2011.08.018 |
| [26] | 段艺菲, 赵清喜, 荆雪. 长链非编码RNA对原发性肝癌中糖酵解途径的影响机制[J]. 临床肝胆病杂志, 2019, 35(6): 1374–1376. DOI:10.3969/j.issn.1001-5256.2019.06.043 |
 2019, Vol. 45
2019, Vol. 45


