扩展功能
文章信息
- 庞宇轩, 杨柳, 张志鹰, 李江
- PANG Yuxuan, YANG Liu, ZHANG Zhiying, LI Jiang
- 三七总皂苷通过上调VEGF表达对大鼠拔牙创愈合的促进作用
- Promotion effect of panax notoginseng saponins on healing of rat tooth extraction wounds by up-regulation of VEGFexpression
- 吉林大学学报(医学版), 2019, 45(04): 796-800
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 796-800
- 10.13481/j.1671-587x.20190409
-
文章历史
- 收稿日期: 2018-09-12
2. 吉林大学口腔医院(牙合)学与颞下颌关节病科, 吉林 长春 130021;
3. 吉林大学口腔医院预防保健科, 吉林 长春 130021
2. Department of Occlusion and Temporomandibular Arthrosis, Stomatology Hospital, Jilin University, Changchun 130021, China;
3. Department of Prevention, Stomatology Hospital, Jilin University, Changchun 130021, China
拔牙创愈合实质上是牙槽骨的修复和改建, 牙槽骨血管化程度高,因此建立良好的血液循环是促进拔牙创愈合的前提[1]。研究[2]表明:骨形成过程中,血管内皮生长因子(vascular endothelial growth factor,VEGF)通过旁分泌或自分泌的方式形成了调控局部血管生成的介质,与血管内皮细胞表面的特异性受体结合,激活信号转导通路,诱导其分化、增殖和迁徙,以芽生或非芽生的方式与骨缺损处原有的毛细血管交织而成血管网,有利于代谢产物的输送。临床研究[3]表明:骨折患者外周血中VEGF表达水平升高,提示此过程中有VEGF参与。三七总皂苷(panax notoginseng saponins,PNS)是中药三七的有效活性成分,主要包括人参皂苷RG1(ginsenoside RG1)和RB1(ginsenoside RB1),临床上配合常规疗法治疗急性脑缺血[4]。在骨形成方面,PNS可能通过上调成骨过程中骨形成蛋白2(bone morphogenetic protein-2, BMP-2)及胰岛素样生长因子(insulin-like growth factor, IGF)表达,使骨髓基质样干细胞向成骨细胞分化[5]。然而,对于PNS是否以上调VEGF表达的方式促进成骨国内外研究尚少。为进一步研究PNS在拔牙创愈合中的作用,本文作者分析3种不同浓度PNS以壳聚糖温敏凝胶(chitosan thermosensitive gels, CTG; 简称壳聚糖凝胶)为载体作用于大鼠拔牙创,观察拔牙创愈合情况和VEGF表达情况,探讨PNS在拔牙创愈合过程中的作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器45雄性SD大鼠由吉林大学基础医学院提供(动物许可证号:2000-042),20月龄,体质量200~240g,按照实验动物饲养标准条件饲养。壳聚糖凝胶由中国科学院长春应用化学研究所合成,PNS粉末为上海圻明生物科技有限公司产品,兔抗人抗大鼠VEGF多克隆抗体为北京中杉金桥生物技术有限公司产品,免疫组织化学SP和DAB试剂盒为福州迈新生物技术开发有限公司产品。Olympus光学显微镜和手术及消毒设备由吉林大学基础医学院和吉林大学口腔医院提供。
1.2 含PNS壳聚糖凝胶的制备参照预实验及前期对拔牙创体积的预估,计算药物浓度。0.4g壳聚糖粉加入0.1mol·L-1乙酸18 mL,搅拌2h,获得2.22%壳聚糖溶液,120℃、0.2 MPa条件下消毒10 min。1.12 g β-甘油磷酸钠加2mL双蒸水搅拌至溶解,过滤除菌。壳聚糖溶液与β-甘油磷酸钠溶液水浴15 min。β-甘油磷酸钠溶液与壳聚糖溶液以1:9(体积比)配比后搅拌10 min。调pH值至7.0后,加入不同质量PNS粉末,使最终浓度分别为0.5、1.0和1.5 g·L-1,留取不含PNS的壳聚糖凝胶,4℃保存。
1.3 动物分组和给药45只雄性SD大鼠随机分为对照组、壳聚糖凝胶组、0.5 g·L-1 PNS组、1.0 g·L-1 PNS组和1.5 g·L-1 PNS组,每组9只。7%水合氯醛腹腔注射麻醉,右下颌中切牙牙冠齐龈缘磨除,分3次完成,间隔3 d。待中切牙有一定松动度后拔除右下颌中切牙。有效止血后,对照组大鼠拔牙创直接以牙周敷料封闭,壳聚糖凝胶组大鼠注入不含PNS的壳聚糖凝胶,其余各组大鼠分别注入含不同浓度(0.5、1.0和1.5 g·L-1)PNS的壳聚糖凝胶,每个拔牙创约注入20 μL,牙周敷料封闭。
1.4 标本收集和处理术后1、2和4周后,各组大鼠经40 g·L-1多聚甲醛磷酸缓冲液心脏灌注后,分离右侧下颌骨,10 g·L-1多聚甲醛中加强固定24 h。10%EDTA常规脱钙12周后,乙醇溶液梯度脱水,二甲苯透明,石蜡纵向包埋骨组织,厚度为3μm连续切片,加防脱剂。
1.5 HE染色观察拔牙创愈合情况经二甲苯、酒精脱蜡,苏木精染色,以中性树胶封片。Olympus光学显微镜400倍视野下观察拔牙创骨形成情况及血管化情况。
1.6 免疫组织化学染色检测大鼠拔牙创组织中VEGF表达情况石蜡切片脱蜡和水化后,磷酸盐缓冲液(PBS)冲洗,加热法抗原修复1 min,过氧化酶阻断液灭活内源性过氧化物,血清封闭10 min。兔抗鼠VEGF多克隆抗体4 ℃过夜,抗体的工作浓度1:100。滴加生物二抗37℃、30 min,链霉菌抗生素-过氧化物酶37℃、20 min,二氨基联苯胺显色,胞质或胞膜呈棕黄色沉淀为VEGF阳性表达,光镜下观察,以便适时终止反应。冲洗复染后返蓝,酒精梯度脱水,二甲苯透明,中性树胶封固。光学显微镜400倍视野下观察,以血管内皮细胞及成骨细胞胞膜或胞浆黄染为VEGF阳性表达,相同VEGF免疫组织化学染色切片随机选取6个不重叠视野,计算成骨细胞和血管内皮细胞VEGF阳性细胞数。上述切片再以ImageProPlus6.0软件分析VEGF的平均光密度(average optical density, AOD)值,相同样本随机采集3张不同视野,叠加后计算平均值,代表VEGF蛋白表达水平。
1.7 统计学分析采用SPSS 22.0统计软件进行统计学分析。VEGF阳性细胞计数和蛋白表达水平以x±s表示,组间比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠拔牙创愈合情况HE染色结果显示:给药1周时,对照组和壳聚糖凝胶组大鼠拔牙创组织中可见血管内皮细胞和成骨细胞大量迁移聚集,血管腔开始形成;与对照组和壳聚糖凝胶组比较,0.5、1.0和1.5 g·L-1 PNS组大鼠拔牙创组织中成骨细胞、血管内皮细胞和血管腔数目明显增多。2周时,对照组和壳聚糖凝胶组大鼠拔牙创组织中血管内皮细胞和成骨细胞形态趋于成熟,血管腔交汇成血管网,新生骨小梁数目增多;与对照组和壳聚糖凝胶组比较,0.5、1.0和1.5 g·L-1 PNS组大鼠拔牙创组织中血管网面积和新生骨小梁数目增多。4周时,对照组和壳聚糖凝胶组大鼠拔牙创开始愈合,组织中血管化活跃;与对照组和壳聚糖凝胶组比较,0.5、1.0和1.5 g·L-1PNS组大鼠拔牙创愈合相对完全,组织中血管化程度较高。见图 1(插页四)。
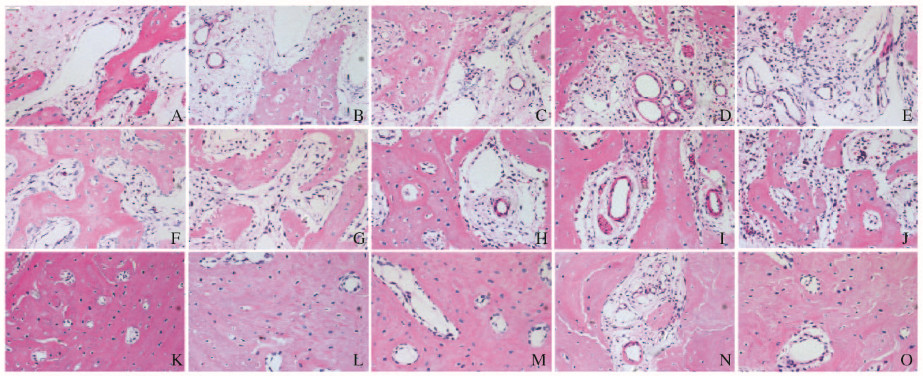
|
| A-E:1 week; F-J:2 weeks; K-O:4 weeks; A, F, K:Control group; B, G, L:Chitosan themosensitive gels group; C, H, M:0.5 g·L-1 PNS group; D, I, N:1.0 g·L-1 PNS group; E, J, O:1.5 g·L-1 PNS group. 图 1 给药1、2和4周后各组大鼠拔牙创组织HE染色结果(×400) Fig. 1 Results of HE staining of rat tooth extraction tissue in various groups at 1, 2, and 4 weeks after administration(×400) |
|
|
VEGF免疫组织化学结果显示:各组大鼠拔牙创组织中VEGF主要在功能活跃的血管内皮细胞及成骨细胞中表达,在给药第2周时达到高峰。在不同的时间点,与对照组和壳聚糖凝胶组比较,0.5、1.0和1.5 g·L-1 PNS组大鼠拔牙创组织中VEGF阳性表达均增强。见图 2(插页四)。

|
| A-E:1 week; F-J:2 weeks; K-O:4 weeks; A, F, K:Control group; B, G, L:Chitosan themosensitive gels group; C, H, M:0.5 g·L-1 PNS group; D, I, N:1.0 g·L-1 PNS group; E, J, O:1.5 g·L-1 PNS group. 图 2 给药1、2和4周后各组大鼠拔牙创组织中VEGF蛋白表达(IHC,×400) Fig. 2 Expressions of VEGF protein in rat tooth extraction tissue in various groups at 1, 2, and 4 weeks after administration(IHC, ×400) |
|
|
给药1、2和4周后,与对照组比较,壳聚糖凝胶组大鼠拔牙创组织中VEGF阳性细胞数和蛋白表达水平差异无统计学意义(P>0.05),0.5、1.0和1.5 g·L-1 PNS组大鼠拔牙创组织中VEGF阳性细胞数和蛋白表达水平明显升高(P < 0.05)。见表 1和2。
| (n=9, x±s) | |||
| Group | Number of VEGF positive cells | ||
| (week) 1 | 2 | 4 | |
| Control | 32.44±1.66 | 38.78±1.24 | 34.33±2.18 |
| CTG | 32.89±2.00 | 40.29±1.42 | 35.23±1.93 |
| PNS(g·L-1) | |||
| 0.5 | 40.78±1.39* | 49.33±1.58* | 39.56±1.55* |
| 1.0 | 48.78±1.68* | 53.85±1.54* | 45.25±3.78* |
| 1.5 | 41.25±1.44* | 48.11±1.47* | 41.44±2.54* |
| * P < 0.05 vs control group. | |||
| (n=9, x±s) | |||
| Group | Expression level of VEGF protein | ||
| (week) 1 | 2 | 4 | |
| Control | 0.015±0.007 | 0.026±0.015 | 0.022±0.009 |
| CTG | 0.016±0.005 | 0.028±0.016 | 0.026±0.009 |
| PNS(g·L-1) | |||
| 0.5 | 0.026 ±0.007* | 0.035 ±0.013* | 0.027±0.005* |
| 1.0 | 0.042 ±0.012* | 0.061 ±0.005* | 0.035±0.012* |
| 1.5 | 0.028 ±0.008* | 0.044 ±0.015* | 0.028±0.012* |
| * P < 0.05 vs control group. | |||
性激素水平可影响成骨过程中VEGF表达,研究[6]表明:在卵巢切除术后大鼠的骨痂愈合过程中,成骨细胞的VEGF表达较对照组明显下降,愈合质量差。李鹏彪等[7]用雌激素干预去卵巢大鼠骨折愈合过程发现:成骨细胞VEGF表达水平明显升高,骨折治疗效果良好,说明雌激素对于VEGF表达会产生影响,使实验过程中产生的误差增加。因此本实验选择雄性SD大鼠可以最大程度减少因激素因素所产的实验误差,提高了实验结果的准确性。
壳聚糖凝胶具有温敏特性,当温度从室温(约25℃)升高至体温(约37℃)时,表现为溶胶状态转换为凝胶状态[8]。利用此特性,以壳聚糖凝胶为载体将药物注射到局部,在体温的条件下以固态形式存在,不仅使药物于局部长期稳定存在以发挥疗效,还可降低药物浓度过大而产生组织及细胞不良反应的风险[9]。壳聚糖凝胶可用于拔牙创这类形态不规则的骨缺损的修复, 因此用于本实验。
以往对PNS促进成骨的研究[10-11]表明:PNS可通过促进成骨早期骨形成蛋白2(BMP-2)和骨钙素等生长因子的表达,使骨髓基质干细胞向成骨细胞分化而达到了成骨的作用。在建立良好血运的前提下,上述促进因素可以直接干预成骨质量,达到良好的愈合效果,但国内外在此方面研究尚少。骨形成早期的血管化与成骨活动是同时进行的[12]。一方面,成骨早期蛋白激酶C(protein kinase C,PKC)通路和磷脂酰肌醇-3激酶(phophoinositide-3 kinase,PI3K)介导血管内皮细胞分化增殖,此过程是通过VEGF与细胞VEGF受体(VEGFR-1和VEGFR-2)结合而激活[13],促进血管化;另一方面,成骨细胞在早期即可形成VEGF,特别是在软骨发生阶段软骨钙化和软骨吸收时, 与此同时,VEGF与成骨细胞表面的VEGFR-1结合使之呈现剂量依赖性聚集,诱导成骨细胞的增殖与分化,促进成骨[14]。本研究结果表明:不同PNS组大鼠拔牙创组织中VEGF阳性细胞数和蛋白表达水平均高于对照组,拔牙创成骨效果较对照组好,血管化较为活跃,表现为PNS呈浓度依赖性上调血管内皮细胞及成骨细胞VEGF表达,提示在PNS的作用下,VEGF在早期即可使血管化进入活跃阶段,使血管化成熟并维持一定数量的新生血管,以促进拔牙创局部骨愈合。韩杰等[15]发现:PNS通过上调VEGF mRNA表达,不仅可有效改善兔激素性股骨头缺血性坏死模型局部循环状况,使局部血管化活跃,血管内皮迁移,毛细血管数量增加,而且使坏死局部成骨细胞迁徙数量增多,骨小梁形成更为成熟,该结果与本实验结果相似。DECKERS等[16]研究表明:VEGF表达随成骨细胞的分化而增高,骨基质矿化时达到高峰。林天骥等[17]研究显示:PNS通过促进成骨细胞增殖分化以促进矿化,起到成骨的作用,该结果与本实验结果相似,提示VEGF可能作为骨形成过程中的枢纽,作用于血管内皮细胞和成骨细胞,以2种不同的方式促进愈合[18]。因此,PNS可能通过上调VEGF的表达,提高了拔牙创局部的成骨活性和血管化活性,进一步促进拔牙创的愈合。
综上所述,PNS上调成骨细胞和血管内皮细胞中VEGF表达,进而诱导血管内皮细胞和成骨细胞分化,一方面促进血管内皮细胞增殖,使拔牙创局部毛细血管数量增加,形态成熟,为良好成骨奠定基础;另一方面也提高了局部成骨活性。该作用可能是PNS促进拔牙创愈合的机制之一。
| [1] | MAES C. Role and regulation of vascularization processes in endochondral bones[J]. Calcif Tissue Int, 2013, 92(4): 307–323. DOI:10.1007/s00223-012-9689-z |
| [2] | HU K, OLSEN B R. The roles of vascular endothelial growth factor in bone repair and regeneration[J]. Bone, 2016, 91(10): 30–38. |
| [3] | 岳春彦. 长骨骨折患者合并脊髓损伤对骨折愈合和血清血小板衍生因子、血管内皮生长因子含量的影响[J]. 中国医学工程, 2018, 26(3): 23–26. |
| [4] | 余昭胜, 徐冬英, 杨意兰, 等. 三七总皂苷注射液治疗急性期脑出血的系统评价[J]. 右江民族医学院学报, 2011, 33(1): 19–23. DOI:10.3969/j.issn.1001-5817.2011.01.008 |
| [5] | 柳毅, 陈建治. 三七总皂苷及其诱导成骨的试验和机制[J]. 国际口腔医学杂志, 2015, 42(1): 75–78. |
| [6] | 刘志奎, 张柳, 穆树林, 等. 血管内皮生长因子在卵巢切除大鼠骨折愈合骨痂中的表达[J]. 中国组织工程研究与临床康复, 2010, 41(14): 7605–7608. |
| [7] | 李鹏彪, 尹芸生, 潘晋平, 等. 雌激素对骨质疏松大鼠骨折愈合过程成骨细胞血管内皮生长因子表达的影响[J]. 中国药物与临床, 2010, 10(8): 884–887. DOI:10.3969/j.issn.1671-2560.2010.08.012 |
| [8] | RUEL-GARIEPY E, SHIVE M, BICHARA A, et al. A thermosensitive chitosan-based hydrogel for the local delivery of paclitaxel[J]. Eur J Pharm Biopharm, 2004, 57(1): 53–63. DOI:10.1016/S0939-6411(03)00095-X |
| [9] | 张洪, 黄徐英. 三七总皂苷壳聚糖缓释微球的制备及体外释放特性研究[J]. 广东药学院学报, 2006, 22(5): 479–482. |
| [10] | 刘东宁, 王云国, 刘志礼, 等. 三七总皂甙对大鼠骨髓基质细胞骨形成蛋白-2表达及碱性磷酸酶活性的影响[J]. 南昌大学学报:医学版, 2012, 52(9): 9–13. |
| [11] | 蒋星宇, 张玉峰, 杨璐, 等. 三七总皂苷在兔牙齿移动过程中对牙周组织中破骨细胞及BMP-2表达的影响[J]. 口腔医学研究, 2018, 34(4): 442–447. |
| [12] | NⅡKURA T, HAK D J, REDDI A H. Global gene profiling reveals a downregulation of BMP gene expression in experimental atrophic nonunions compared tostandard healing fractures[J]. J Orthop Res, 2006, 24(7): 1463–1471. DOI:10.1002/(ISSN)1554-527X |
| [13] | SHIBUYA M. Vascular endothelial growth factor and its receptor system:Physiological functions in angiogenesis and Pathological roles in various diseases[J]. J Biochem, 2013, 153(1): 13–19. |
| [14] | HU K, OLSEN B R. Osteoblast-derived VEGF regulates osteoblast differentiation and bone formation during bone repair[J]. J Clin Invest, 2016, 126(2): 509–526. DOI:10.1172/JCI82585 |
| [15] | 韩杰, 王世鑫, 莫坚, 等. 三七总皂苷对激素性股骨头缺血性坏死模型兔骨组织VEGF和骨形态形成蛋白-2 mRNA表达的影响[J]. 广西医学, 2016, 38(5): 611–614. |
| [16] | DECKERS M M, KARPERINE M, VAN DER BENT C, et al. Expression of vascular endothelial growth factors and their receptors during osteoblast differentiation[J]. Endocrinology, 2000, 141(5): 1667. DOI:10.1210/endo.141.5.7458 |
| [17] | 林天骥, 邵莉, 柳毅, 等. 三七皂苷单体对成骨细胞增殖和矿化功能的影响[J]. 口腔医学, 2018, 38(2): 127–131. DOI:10.3760/cma.j.issn.1002-0098.2018.02.013 |
| [18] | ZHANG Y G, YANG Z, ZHANG H, et al. Negative pressure technology enhances bone regeneration in rabbit skull defects[J]. BMC Musculoskelet Disord, 2013, 14: 76. DOI:10.1186/1471-2474-14-76 |
 2019, Vol. 45
2019, Vol. 45


