扩展功能
文章信息
- 刘宇妍, 于文雯, 申玉芹, 秦甜甜, 周雪纯, 黄蕾, 孙新华
- LIU Yuyan, YU Wenwen, SHEN Yuqin, QIN Tiantian, ZHOU Xuechun, HUANG Lei, SUN Xinhua
- 聚乙烯亚胺衍生物PEN介导寡核苷酸MT01递送对实验性大鼠牙移动的抑制作用
- Inhibitory effect of polyethylenimine derivative PEN mediated oligodeoxynucleotide MT01 delivery on experimental rat tooth movement
- 吉林大学学报(医学版), 2019, 45(04): 790-795
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 790-795
- 10.13481/j.1671-587x.20190408
-
文章历史
- 收稿日期: 2018-12-03
2. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021;
3. 吉林大学口腔医院牙周科, 吉林 长春 130021
2. Jilin Provincial Key Laboratory of Tooth Development and Jaw Remodeling and Regeneration, Changchun 130021, China;
3. Department of Periodontology, Stomatology Hospital, Jilin University, Changchun 130021, China
正畸治疗过程中的牙齿移动,是在机械力作用下,通过牙周韧带和牙槽骨的不断改建而实现的[1-2]。在此过程中,牙根张力侧的成骨细胞活化,引发新骨的沉积;而压力侧的多核破骨细胞形成,吸收骨组织[3-4],二者在骨架完整性中维持着动态平衡[5],这就是正畸治疗的生物学基础。在正畸临床上,支抗的控制是决定矫治成功与否的重要因素[6],目前临床上常用种植支抗来弥补支抗丧失的不足,然而这是一种有创操作,存在着一定的风险[7-8]。寻找安全、稳定和高效的药物来调控局部牙槽骨改建进而实现控制牙齿移动,已成为正畸学领域的研究热点。MT01是模拟人线粒体DNA设计并命名的特定序列寡脱氧核苷酸,MT01可通过影响成骨细胞和骨髓间充质细胞成骨向分化参与牙槽骨重塑[9-10],还可减轻大鼠牙周炎模型中牙槽骨的吸收[9]。FENG等[10]研究表明:MT01可以抑制牙齿移动,具有加强支抗的作用。但是单纯MT01存在易被降解、半衰期较短及表面带有负电荷等不足,难以被细胞大量摄取和利用[11]。基于此,有些学者对MT01进行硫代修饰,经硫代修饰的MT01(MT01s)可以克服上述不足,但有研究[12]表明:硫代修饰可影响其细胞内免疫作用,更多的学者提倡应用载体进行寡核苷酸的递送。本课题组[13-14]在前期实验中采用聚乙烯亚胺(polyethylenimine,PEI)衍生物PEN搭载MT01实现细胞内递送,结果显示:PEN不仅可以明显提高MT01的细胞摄入率,而且能保证MT01在细胞中稳定表达,且PEN/MT01复合物可促进人成骨细胞MG63成骨向分化,促进大鼠颅骨缺损模型骨缺损的修复。根据本课题组前期研究结果,本实验拟通过局部给药的方式观察实验性牙移动模型大鼠牙移动过程中PEI衍生物PEN介导MT01的体内局部递送能力,初步阐明其对实验性牙移动模型大鼠牙槽骨改建的影响及生物学安全性,为实现正畸治疗中牙齿移动的调控奠定实验基础。
1 材料与方法 1.1 主要试剂和仪器MT01(序列为5′-ACCCCCTCTACCCCCTCTACCCCCTCT-3′)和MT01s,均由吉林大学基础医学院分子生物学教研室设计,由大连TaKaRa公司合成。PEN(吉林大学生命科学学院提供),PBS溶液和苏木精-伊红(HE)溶液(吉林大学口腔生物学实验室保存),组织细胞总RNA抽提试剂盒(广州Magen公司),逆转录试剂盒、实时定量荧光PCR(RT-PCR)试剂盒(大连TaKaRa公司)。镍钛拉簧(深圳速航科技发展有限公司),弹簧测力计(浙江新亚医疗科技股份有限公司),NanoDrop 2000分光光度计(美国Thermo Scientific公司),Mx3000P实时荧光定量PCR仪(美国Angilent公司)
1.2 实验动物分组48只7周龄Wistar雄性大鼠由吉林大学实验动物中心提供,动物合格证号:SCXK(辽)2015-0001,体质量(180±10)g,自由充足饮食,每12h昼夜交替,适应性饲养1周,随机分为PEN组(阴性对照组)、MT01组(对照组)、MT01s组(阳性对照组)和PEN/MT01组(实验组),每组12只。
1.3 大鼠实验性牙移动模型的建立各组大鼠经10%水合氯醛腹腔麻醉(3 mL·100 g-1)后,仰卧位固定,高速涡轮机在大鼠上颌切牙及上颌第一磨牙近龈缘处作浅固位沟,采再用结扎丝将镍钛拉簧固定于上颌切牙与第一磨牙之间,以上颌切牙为支抗,采用0.49 N的力将上颌第一磨牙向近中拉动,支抗的丧失忽略不计(图 1,见插页二),苏醒后常规饲养,每天检查口内装置,如有脱落及时复原。
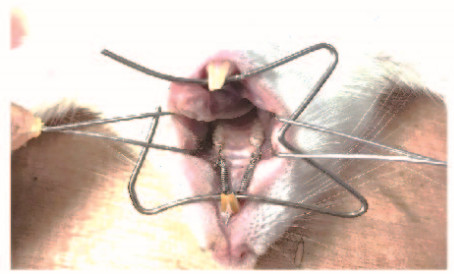
|
| 图 1 大鼠双侧上颌牙齿移动模型的建立 Fig. 1 Establishment of bilateral maxillary tooth movement models of rats |
|
|
将粉末状PEN和MT01溶于PBS,浓度分别为50 mg·L-1和25 mg·L-1,再将两者按照质量比6:1进行混合[14],充分混匀后,室温静置30 min,即可得到PEN/MT01复合物。
1.5 给药途径和给药方法大鼠实验性牙移动模型建立后, 即刻于各组大鼠左侧上颌第一磨牙颊侧牙龈黏膜下分别注射PEN、MT01、MT01s和PEN/MT01溶液,MT01局部注射量为1μg,并于右侧相同部位注射等量的PBS溶液。以后每3d给药1次,饲养至14d实验结束。
1.6 生物安全性检测采用多聚甲醛心脏灌流法,每组随机处死6只大鼠,摘取其心、肝、脾、肺和肾进行固定。将标本取材后脱水透明包埋得到蜡块,连续切片后行HE染色,封片后在光镜下观察各组大鼠脏器的组织结构和细胞形态,以检测各组药物对大鼠脏器组织的毒性作用。
1.7 各组大鼠牙齿移动距离的测量分离含上颌第一磨牙的上颌骨组织并固定,在同一距离条件下垂直拍摄大体照片(以钢尺作为标尺,0.42 mm/格)及X线片,采用Image J 1.7.0图像分析软件测定照片中第一磨牙远中面最凸点与第二磨牙近中面最凸点间距离。测量由同一研究者重复进行3次,取平均值,分别计算每组大鼠药物干预侧与PBS对照侧第一磨牙近中移动的距离及二者差值(PBS对照侧牙齿移动距离-药物干预侧牙齿移动距离,单位为mm)。
1.8 各组大鼠成骨标志性基因mRNA表达水平的检测每组剩余6只大鼠采用颈椎脱臼法处死,分离出含上颌第一磨牙的牙槽骨,Trizol法即刻提取RNA并测量浓度,逆转录试剂盒合成相应cDNA,扩增后测定成骨标志性基因Runt相关转录因子2 (Runt-related transcription factor 2,Runx2)、成骨细胞特异性转录因子(special protein 7,SP7)和骨钙素(osteocalcin,OCN)mRNA表达水平。以β-actin为内参基因,计算2-ΔΔCt值,代表目的基因mRNA表达水平。所用引物均由大连TaKaRa公司设计并合成,引物序列见表 1。
| Primer | Sequence |
| β-actin | 5′-CATCCGTAAAGACCTCTATGCCAAC-3′ 5′-ATGGAGCCACCGATCCACA-3′ |
| Runx2 | 5′- GCACAAACATGGCCAGATTCA-3′ 5′- AAGCCATGGTGCCCGTTAG -3′ |
| SP7 | 5′-AAGTTATGATGACGGGTCAGGTACA-3′ 5′-AGAAATCTACGAGCAAGGTCTCCAC-3′ |
| OCN | 5′-ACCATCTTTCTGCTCACTCTGCT-3′ 5′-CCTTATTGCCCTCCTGCTTG-3′ |
采用SPSS 19.0统计软件进行统计学分析。各组大鼠牙齿移动距离及差值均符合正态分布,以x±s表示,药物干预侧与PBS对照侧比较采用配对t检验,各组牙齿移动距离差值比较采用单因素方差分析。检验水准为双侧α=0.05,以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠重要脏器组织生物安全性检测HE染色结果显示:心脏组织中可见心肌细胞横切面,细胞核居中呈卵圆形,其长轴与肌原纤维的方向一致;肝组织中可见静脉以及其周围大致呈放射状排列的肝索和肝血窦,肝细胞核大而圆,胞质呈嗜酸性;脾组织中可见红髓和白髓,红髓内可见脾索和脾血窦,白髓内可见由大量B细胞构成的淋巴小结和中央动脉;肺组织中可见呼吸性细支气管、终末细支气管、肺泡管、肺泡囊及肺泡;肾组织中血管球和肾小囊体积形态正常,近、远曲小管及集合管的管腔也未见扩张。各组大鼠心、肝、脾、肺和肾均可见正常的组织结构,未见明显的炎细胞浸润及结构差异,未见细胞溶解、萎缩、变性及坏死等病理性变化。见图 2(插页三)。
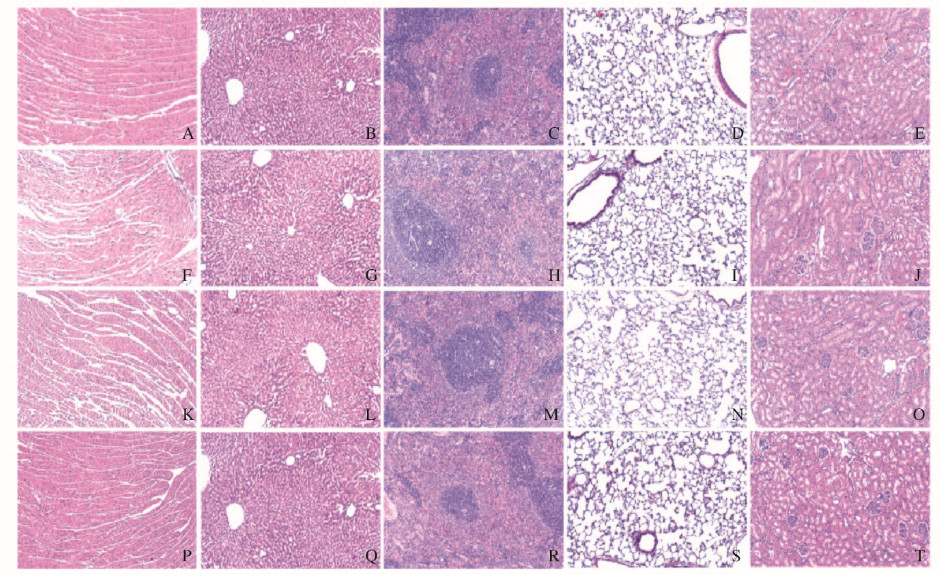
|
| A-E:PEN group; F-J:MT01 group; K-O:MT01s group; P-T:PEN/MT01 group; A, F, K, P:Heart tissue; B, G, L, Q:Liver tissue; C, H, M, R:Spleen tissue; D, I, N, S:Lung tissue; E, J, O, T:Kidney tissue. 图 2 光镜下各组大鼠心、肝、脾、肺和肾组织形态表现(HE, ×40) Fig. 2 Morphology of heart, liver, spleen, lung, and kidney tissues of rats in various groups under light microscope(HE, ×40) |
|
|
加力14 d后各组大鼠牙齿移动距离的变化见图 3(插页三)。PEN组大鼠药物干预侧与PBS对照侧牙齿移动距离肉眼观察无明显不同,而MT01、MT01s和PEN/MT01组大鼠药物干预侧牙齿移动距离明显小于PBS对照侧,其中PEN/MT01组最为明显。测量结果显示:除PEN组外,其余3组大鼠药物干预侧牙齿移动距离均明显小于PBS对照侧(P < 0.05或P < 0.01)。4组大鼠双侧牙移动距离差值排列顺序:PEN/MT01组>MT01s组>MT01组>PEN组,PEN/MT01组双侧牙移动距离的差值最大,明显大于MT01s组(P < 0.05)。在PEN/MT01组大鼠药物干预侧可见清晰而连续的牙槽嵴,与PBS对照侧比较骨密度更高。见图 3(插页三)和表 2。
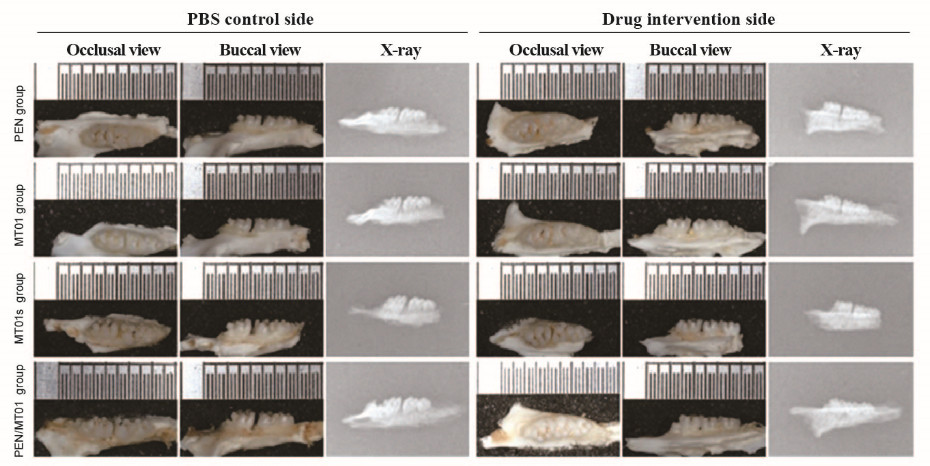
|
| 图 3 各组大鼠牙齿移动距离的大体和X线表现 Fig. 3 Gross and X-ray performances of tooth movement distances of rats in various groups |
|
|
| (n=6, x±s, l/mm) | |||
| Group | PBS control side | Drug intervention side | Difference |
| PEN | 0.319 0±0.015 2 | 0.322 0±0.010 3 | -0.002 8±0.029 4 |
| MT01 | 0.329 0±0.015 3 | 0.243 0±0.013 5* | 0.086 0±0.012 8 |
| MT01s | 0.400 0±0.030 3 | 0.142 0±0.020 6** | 0.258 0±0.023 8 |
| PEN/MT01 | 0.401 0±0.026 6 | 0.026 2±0.016 0** | 0.375 0±0.017 1△ |
| F | - | - | 558.885 |
| P | - | - | 0.000 |
| “-”:No data. * P < 0.05,* * P < 0.01 compared with PBS control side; △ P < 0.05 compared with MT01s group. | |||
与PBS对照侧比较,MT01s和PEN/MT01组大鼠药物干预侧牙周组织中Runx2、SP7和OCN mRNA表达水平均明显升高(P < 0.01),且PEN/MT01组升高最为明显;MT01组大鼠药物干预侧牙周组织中Runx2mRNA表达水平降低(P < 0.05),而SP7和OCNmRNA表达水平升高(P < 0.01);PEN组大鼠药物干预侧牙周组织中Runx2mRNA表达水平降低(P < 0.05),而SP7和OCN mRNA表达水平差异无统计学意义(P>0.05)。见表 3。
| (n=6, x±s) | |||
| Group | Runx2 mRNA | SP7 mRNA | OCN mRNA |
| PEN | |||
| PBS control side | 1.000±0.086 | 1.000±0.051 | 1.000±0.053 |
| Drug intervention side | 0.783±0.008* | 1.052±0.224 | 1.023±0.030 |
| MT01 | |||
| PBS control side | 1.000±0.124 | 1.000±0.033 | 1.000±0.014 |
| Drug intervention side | 0.611±0.038* | 2.033±0.105** | 2.085±0.059** |
| MT01s | |||
| PBS control side | 1.000±0.025 | 1.000±0.023 | 1.000±0.121 |
| Drug intervention side | 2.158±0.109** | 2.815±0.100** | 3.038±0.181** |
| PEN/MT01 | |||
| PBS control side | 1.000±0.052 | 1.000±0.050 | 1.000±0.051 |
| Drug intervention side | 2.651±0.037** | 4.925±0.140** | 7.193±1.081** |
| * P < 0.05,* * P < 0.01 compared with PBS control side. | |||
MT01是一段人工设计合成的由27个碱基构成的单链寡脱氧核苷酸。PEN是PEI的衍生物,因此也具有独特的“质子海绵效应”,含有质子化胺基残基,可以通过静电作用自发地与基因药物进行结合,所形成的复合物易于从溶酶体中逃逸[14-15],是近年来非病毒类载体中的研究热点[16]。前期研究[13-14]表明:当PEN和MT01以质量比为6:1进行装载时所构建的PEN/MT01复合物,可以改善MT01表面电性,抵抗体内核酸酶的降解,增强细胞内转染效率,实现高效递送。PEN/MT01复合物对大鼠颅骨缺损模型骨新生影响的研究[14]结果显示:PEN/MT01复合物体内调控骨重塑的作用较为明显。本实验将PEN/MT01应用于大鼠实验性牙移动模型中,评价在PEN作为递送载体条件下,MT01对正畸牙移动过程中骨改建的影响。
本研究证实:PEN/MT01复合物对实验性牙移动模型大鼠具有较好的生物安全性,PEN/MT01组大鼠重要脏器均可见正常的组织结构,未见明显的炎细胞浸润及结构异常,细胞未出现溶解、萎缩、变性及坏死等病理性变化。本研究结果与PEN/MT01复合物对大鼠颅骨缺损模型的生物学安全性[14]研究结果相一致,提示PEN/MT01复合物可以用于大鼠正畸牙移动的动物实验。
本研究结果表明:PEN/MT01复合物可以缩小实验性牙移动模型大鼠牙齿移动距离,其可能的机制是PEN/MT01复合物参与并调控牙齿移动过程中牙周组织内成骨标志性基因的表达。本研究中牙移动大体测量显示:与PBS对照侧比较,MT01、MT01s和PEN/MT01组大鼠药物干预侧牙齿移动距离均减小,其中PEN/MT01组的牙齿移动距离差值最大,说明PEN介导MT01递送抑制了实验性牙移动模型大鼠第一磨牙的近中移动。本研究中X线片显示:与PBS对照侧比较,MT01、MT01s和PEN/MT01组大鼠药物干预侧第一磨牙周围骨密度增加,PEN/MT01组可见清晰而连续的牙槽嵴。
为探讨其可能的作用机制,本实验检测了各组大鼠第一磨牙周围牙周组织内成骨标志性基因Runx2、SP7和OCN mRNA表达水平。Runx2是成骨细胞分化和软骨细胞成熟所必需的转录因子,其通过转化生长因子β(TGF-β)/骨形态发生蛋白(BMP)、Notch及Wnt信号通路在成骨分化的早期对成骨细胞特异性基因及细胞外基质蛋白进行调控[17-18],MT01能够通过引起细胞外信号调节激酶1/2(ERK1/2)及p38的磷酸化反应而促进Runx2的磷酸化[19]。SP7仅在成骨性质细胞中表达,为成骨细胞分化和骨形成过程中所必需[20]。OCN是一种能够参与成骨细胞分化和基质矿化的基质蛋白,是公认的骨转化特定生物标志物。本研究结果显示:与PBS对照侧比较,MT01、MT01s和PEN/MT01组大鼠药物干预侧牙周组织中Runx2、SP7和OCNmRNA表达水平明显升高,且PEN/MT01组升高最明显,说明MT01具有一定的促成骨作用,与SHIEN[5]等和HOU等[19]的研究结果一致。但由于MT01自身特性的限制,不易于被细胞摄取和利用,通过PEN的递送,MT01可更多地被细胞摄取和利用,大大减少了由于静电排斥而被阻隔在细胞外或被酶降解的可能, 使以上3种基因mRNA表达水平明显提高,促成骨作用更强,骨密度增高,牙齿近中移动的距离明显减小。本研究中PEN组大鼠上颌牙槽骨组织中Runx2、SP7和OCN mRNA表达水平无明显改变,说明PEN仅起到了载体的作用,对成骨过程无影响。此外,PEN组和MT01组中Runx2的表达被轻度抑制,可能是由于MT01富含非甲基化基序, 在一定程度上影响了炎症因子的表达[21],经过硫代修饰与载体递送MT01更多的被细胞所摄取,不仅调控成骨分化,也影响周围炎症因子的抑制成骨作用; 而PEN与MT01(即使有少量被细胞摄取)本身所具有的化学基团与化学键可作为外源性刺激因子,一过性刺激局部炎症因子的表达,进一步影响成骨早期分化因子Runx2的表达。
综上所述,本研究证实PEN介导MT01局部递送作用于实验性牙移动模型大鼠,不仅具有较好的生物安全性,而且可有效减小模型大鼠牙齿移动距离,初步阐明了其对实验性牙移动模型大鼠牙槽骨改建的影响及生物学安全性。本研究结果为实现正畸治疗中牙齿移动的调控奠定实验基础,但其具体作用机制尚待进一步探讨。
| [1] | HADJIDAKIS D J, ANDROULAKIS I I. Bone remodeling[J]. Ann N Y Acad Sci, 2006, 1092(1): 385–396. DOI:10.1196/annals.1365.035 |
| [2] | CHEN N, SUI BD, HU C H, et al. MicroRNA-21 contributes to orthodontic tooth movement[J]. J Dent Res, 2016, 95(12): 1425–1433. DOI:10.1177/0022034516657043 |
| [3] | URIBE F, KALAJZIC Z, BIBKO J, et al. Early effects of orthodontic forces on osteoblast differentiation in a novel mouse organ culture model[J]. Angle Orthod, 2011, 81(2): 284–291. DOI:10.2319/052410-279.1 |
| [4] | HAKAMI Z, KITAURA H, KIMURA K, et al. Effect of interleukin-4 on orthodontic tooth movement and associated root resorption[J]. Eur J Orthod, 2015, 37(1): 87–94. DOI:10.1093/ejo/cju016 |
| [5] | SHIEH A, HAN W J, ISHⅡ S, et al. Quantifying the balance between total bone formation and total bone resorption:an index of net bone formation[J]. J Clin Endocrinol Metab, 2016, 101(7): 2802–2809. DOI:10.1210/jc.2015-4262 |
| [6] | LI X L, LAI W L. Indirectly loaded miniscrews for anchorage control[J]. Am J Orthod Dentofacial Orthop, 2017, 151(2): 233. DOI:10.1016/j.ajodo.2016.10.016 |
| [7] | MOHAMMED H, WAFAIE K, RIZK M Z, et al. Role of anatomical sites and correlated risk factors on the survival of orthodontic miniscrew implants:a systematic review and meta-analysis[J]. Prog Orthod, 2018, 19(1): 36. DOI:10.1186/s40510-018-0225-1 |
| [8] | 曾晨光, 周彦恒, 林久祥, 等. 不同加载条件下国产微螺钉种植体的支抗稳定性及组织学表现[J]. 吉林大学学报:医学版, 2013, 39(2): 300–303. |
| [9] | SHEN Y Q, FENG Z Y, LIN C T, et al. An oligodeoxynucleotide that induces differentiation of bone marrow mesenchymal stem cells to osteoblasts in vitro and reduces alveolar bone loss in rats with periodontitis[J]. Int J Mol Sci, 2012, 13(3): 2877–2892. DOI:10.3390/ijms13032877 |
| [10] | FENG Z Y, SHEN Y Q, WANG L Y, et al. An oligodeoxynucleotide with promising modulation activity for the proliferation and activation of osteoblast[J]. Int J Mol Sci, 2011, 12(4): 2543–2555. DOI:10.3390/ijms12042543 |
| [11] | ZHU Y F, MENG W J, HANAGATA N. Cytosine-phosphodiester-guanine oligodeoxynucleotide (CpG ODN)-capped hollow mesoporous silica particles for enzyme-triggered drug delivery[J]. Dalton Trans, 2011, 40(39): 10203–10208. DOI:10.1039/c1dt11114k |
| [12] | HANAGATA N. Structure-dependent immunostimulatory effect of CpG oligodeoxynucleotides and their delivery system[J]. Int J Nanomedicine, 2012, 7: 2181–2195. |
| [13] | 崔野, 郑义, 申玉芹, 等. MT01/PEN复合物对人成骨样细胞MG63表达骨保护蛋白和核因子κB受体活化因子配体的影响[J]. 华西口腔医学杂志, 2016, 34(1): 32–36. |
| [14] | ZHENG Y, LIN C, HOU X, et al. Enhancing the osteogenic capacity of MG63 cells through N-isopropylacrylamide-modified polyethylenimine-mediated oligodeoxynucleotide MT01 delivery[J]. Rsc Adv, 2017, 7(43): 27121–27127. DOI:10.1039/C6RA27182K |
| [15] | ZHANG H, CHEN Z Y, DU M, et al. Enhanced gene transfection efficiency by low-dose 25 kDa polyethylenimine by the assistance of 1.8 kDa polyethylenimine[J]. Drug Deliv, 2018, 25(1): 1740–1745. DOI:10.1080/10717544.2018.1510065 |
| [16] | FARCAS A, BEU T. Complexation of DNA with cationic polymers[J]. Stud U Babes-Bol Che, 2018, 63(2): 165–172. |
| [17] | KOMORI T. Runx2, an inducer of osteoblast and chondrocyte differentiation[J]. Histochem Cell Biol, 2018, 149(4): 313–323. DOI:10.1007/s00418-018-1640-6 |
| [18] | CHEN Y, HU Y, YANG L, et al. Runx2 alleviates high glucose-suppressed osteogenic differentiation via PI3K/AKT/GSK3β/β-catenin pathway[J]. Cell Biol Int, 2017, 41(8): 822–832. DOI:10.1002/cbin.v41.8 |
| [19] | HOU X, SHEN Y Q, ZHANG C, et al. A specific oligodeoxynucleotide promotes the differentiation of osteoblasts via ERK and p38 MAPK pathways[J]. Int J Mol Sci, 2012, 13(7): 7902–7914. DOI:10.3390/ijms13077902 |
| [20] | ZHANG C. Transcriptional regulation of bone formation by the osteoblast-specific transcription factor Osx[J]. J Orthop Surg Res, 2010, 5: 37. DOI:10.1186/1749-799X-5-37 |
| [21] | 杨竹君, 侯旭, 于文雯, 等. MT01对实验性牙移动大鼠牙周组织中TLR9、TRAF6和IL-6表达水平的影响[J]. 吉林大学学报:医学版, 2017, 43(4): 752–756. |
 2019, Vol. 45
2019, Vol. 45


