扩展功能
文章信息
- 袁虎勤, 李强
- YUAN Huqin, LI Qiang
- 奥沙利铂联合卡培他滨对实验性胃癌大鼠胃癌组织中肿瘤相关因子表达的影响及其协同抗肿瘤作用
- Effects of oxaliplatin combined with capecitabine on expressions oftumor-related factors in gastric cancer tissue of rats with experimental gastric cancer and their synergistic anti-tumor effects
- 吉林大学学报(医学版), 2019, 45(04): 784-789
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 784-789
- 10.13481/j.1671-587x.20190407
-
文章历史
- 收稿日期: 2018-09-29
2. 兰州大学第一医院胃肠外科, 甘肃 兰州 730000
2. Department of Gastrointestinal Surgery, First Hospital, Lanzhou University, Lanzhou 730000, China
胃癌是我国多发性恶性肿瘤之一,由于癌症的病因复杂,常由多种因素导致,目前临床上胃癌的病因及发病机制尚未完全明确。P53、信号传导与激活因子3(signal transduction and activation factor 3, STAT3)和血管内皮生长因子(vascular endothelial growth factor, VEGF)等肿瘤相关因子,白细胞介素6(interleukin-6, IL-6)、IL-10和肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)等细胞因子与胃癌的发生发展有密切关联[1-2]。临床上常用5-氟尿嘧啶(5-Fu)作为胃癌治疗的基本化疗药物,卡培他滨是一种新型的口服5-Fu前体药物,能够在肿瘤组织里转变为5-Fu而发挥细胞毒作用[3]。另有研究[4-6]表明:奥沙利铂与5-Fu具有较强的协同作用。但目前关于奥沙利铂与卡培他滨联合应用的研究尚少见。本研究通过制备动物模型,观察奥沙利铂与卡培他滨联合用药对胃癌大鼠肿瘤质量,胃癌组织中细胞凋亡情况,胃癌组织中P53、STAT3、VEGF蛋白表达水平及血清IL-6、IL-10和TNF-α水平的影响,以期为胃癌的防治和临床合理用药提供理论依据。
1 材料与方法 1.1 动物、主要试剂和仪器SPF级健康雄性Wistar大鼠60只,体质量(220 ± 20) g,由甘肃省疾病预防控制中心提供,动物合格证号:SYXK(甘)2016-0002。实验室温度(23 ± 3)℃,相对湿度(65 ± 5)%,适应性饲养1周,自由摄食、饮水。人BGC823胃癌细胞株(中国科学院上海生科院细胞资源中心),卡培他滨(上海罗氏公司),奥沙利铂(南京制药厂有限公司),TUNEL凋亡检测试剂盒(美国罗氏公司),P53、STAT3和VEGF抗体(圣克鲁斯生物技术有限公司),IL-6、IL-10和TNF-α ELISA试剂盒(武汉博士德生物工程有限公司)。光学显微镜(日本尼康公司),电泳仪(美国Bio-Rad公司),酶标仪(北京普天新桥技术有限公司)。
1.2 动物模型的建立将人胃癌BGC823细胞从液氮中取出,复苏至37℃,3000 r·min-1离心3 min,弃上清液,加入10 mL培养液,制成5×105mL-1悬液。将细胞悬液置于培养瓶中,放入37℃、5% CO2培养箱内培养2 ~ 4 h后换培养液继续培养,待确定细胞处于对数生长期时,取对数生长期的胃癌细胞备用。
大鼠腹腔注射阿糖胞苷(200 mg·kg-1),48 h后按照10 Gy剂量以60Co γ射线全身一次性照射15 ~ 20 min,照射24 h后于大鼠近腹股沟处皮下接种胃癌细胞悬液1.0 mL,接种细胞数5×106 mL-1,建立实验性大鼠胃癌模型[7]。观察记录大鼠每天的生理和精神情况,若皮下出现米粒大小质硬结节则为模型建立成功。
1.3 动物分组和给药60只Wistar大鼠随机分为对照组、模型组、奥沙利铂组、卡培他滨组和奥沙利铂联合卡培他滨组(联合组),每组12只。除对照组外,其余各组均进行造模处理。造模成功后(30 d后),奥沙利铂组大鼠腹腔注射奥沙利铂溶液(20 mg·kg-1),每周2次;卡培他滨组大鼠灌胃给予卡培他滨溶液(400 mg·kg-1),每天1次;联合组大鼠同时给予奥沙利铂溶液(20 mg·kg-1)和卡培他滨溶液(400 mg·kg-1)。对照组和模型组大鼠分别灌胃给予等剂量生理盐水,连续给药8周。
1.4 大鼠移植瘤质量测定各组大鼠末次给药24 h后给予10%水合氯醛麻醉,腹主动脉取血后处死,于无菌条件下取大鼠肿瘤组织,称移植瘤质量,取平均值。
1.5 TUNEL染色检测胃癌组织中细胞凋亡指数(apoptotis index, AI)取大鼠部分移植瘤,采用TUNEL凋亡检测试剂盒检测移植瘤组织中细胞的凋亡情况。阳性细胞呈棕黄色,光学显微镜下随机观察5个视野,通过图像数字分析系统计算阳性细胞数,计算AI。AI =(阳性细胞数/总细胞数)×100%。
1.6 Westernblotting法检测大鼠胃癌组织中P53、STAT3和VEGF蛋白表达水平取大鼠移植瘤组织,磷酸缓冲盐溶液(PBS)冲洗3次,加入蛋白裂解液,匀浆后4 ℃、2500 r·min-1离心10 min,弃上清液,用BCA试剂盒法进行蛋白定量。总蛋白经SDS-聚丙烯酰胺凝胶电泳分离目的蛋白,恒定电流转移至PVDF膜,5%脱脂牛奶于室温封闭2 h,加入相应浓度的一抗,4 ℃孵育过夜,TBST漂洗3次。加入二抗,室温孵育,TBST漂洗3次。用碱性磷酸酶化学发光显色,以目的蛋白条带平均吸光度(A)值与内参β-actin条带A值的比值作为目的蛋白表达水平。
1.7 酶联免疫吸附(ELISA)法测定大鼠血清中IL-6、IL-10和TNF-α水平取大鼠腹主动脉血,室温下放置15 min后,2500 r·min-1离心10 min,分离血清,采用ELISA法测定血清中IL-6、IL-10和TNF-α水平,按照试剂盒说明书操作。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。大鼠移植瘤平均质量,AI,胃癌组织中P53、STAT3和VEGF蛋白表达水平,血清中IL-6、IL-10和TNF-α水平,均符合正态分布,以x±s表示,多组间数据比较采用单因素方差分析,组间两两比较采用t检验。以P < 0.05表示差异有统计学意义。
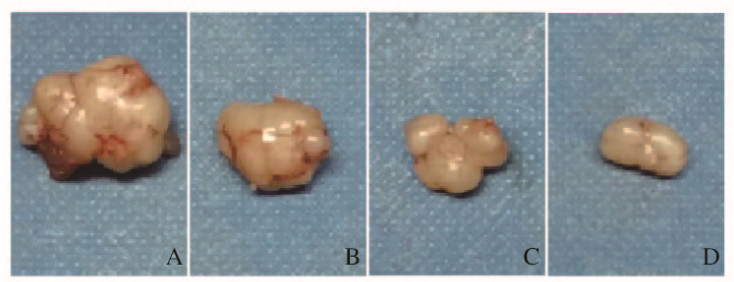
2 结果 2.1 各组大鼠移植瘤平均质量对照组大鼠未发现肿瘤。与模型组比较,奥沙利铂组、卡培他滨组和联合组大鼠移植瘤平均质量明显降低(P < 0.05);联合组大鼠移植瘤平均质量明显低于奥沙利铂组和卡培他滨组(P < 0.05)。见表 1和图 1(插页二)。
| (n=12, x±s) | ||
| Group | Average tumor weight (m/g) | AI (η/%) |
| Control | - | - |
| Model | 2.11±0.57 | 6.84±4.37 |
| Capecitabine | 1.14±0.38* | 17.80±2.67* |
| Oxaliplatin | 0.83±0.30* | 15.64±1.05* |
| Combination | 0.41±0.08*△# | 20.62±2.87*△# |
| F | 543.33 | 307.46 |
| P | < 0.001 | < 0.001 |
| “-”: No data. * P < 0.05 compared with model group; △ P < 0.05 compared with capecitabine group; # P < 0.05 compared with oxaliplatin group. | ||
|
| A: Model group; B: Capecitabine group; C: Oxaliplatin group; D: Combination group. 图 1 各组大鼠胃移植瘤大体表现 Fig. 1 Gross performance of gastric transplantation tumor of rats in various groups |
|
|
细胞核染成棕黄色为凋亡细胞。TUNEL染色结果:模型组大鼠胃癌组织中基本未发现凋亡细胞,卡培他滨组和奥沙利铂组大鼠胃癌组织中发现部分凋亡细胞,联合组大鼠胃癌组织中凋亡细胞数高于模型组、卡培他滨组和奥沙利铂组。与模型组比较,卡培他滨组、奥沙利铂组和联合组大鼠胃癌组织中细胞的AI明显升高(P < 0.05);联合组大鼠胃癌组织AI明显高于卡培他滨组和奥沙利铂组(P < 0.05)。见表 1和图 2(插页二)。

|
| A: Model group; B: Capecitabine group; C: Oxaliplatin group; D: Combination group. 图 2 各组大鼠移植瘤组织TUNEL染色结果(×400) Fig. 2 Results of TUNEL staining of transplantation tumor tissue of rats in various groups (×400) |
|
|
与对照组比较,模型组大鼠胃癌组织中P53、STAT3和VEGF蛋白表达水平明显升高(P < 0.05);与模型组比较,奥沙利铂组、卡培他滨组和联合组大鼠胃癌组织中P53、STAT3和VEGF蛋白表达水平明显降低(P < 0.05);与卡培他滨组和奥沙利铂组比较,联合组大鼠胃癌组织中P53、STAT3和VEGF蛋白表达水平进一步降低(P < 0.05)。见表 2和图 3。
| (n=12, x±s) | |||
| Group | P53 protein | STAT3 protein | VEGF protein |
| Control | 0.69±0.14 | 0.65±0.09 | 0.71±0.13 |
| Model | 2.61±0.43* | 2.54±0.33* | 2.30±0.31* |
| Capecitabine | 1.54±0.15△ | 1.74±0.20△ | 1.41±0.22△ |
| Oxaliplatin | 1.76±0.18△ | 1.24±0.18△ | 1.82±0.12△ |
| Combination | 1.01±0.16△#○ | 0.85±0.11△#○ | 1.05±0.09△#○ |
| F | 239.01 | 303.31 | 201.599 |
| P | < 0.001 | < 0.001 | < 0.001 |
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with capecitabine group; ○ P < 0.05 compared with oxaliplatin group. | |||

|
| Lane 1: Control group; Lane 2: Model group; Lane 3: Capecitabine group; Lane 4: Oxaliplatin group; Lane 5: Combination group. 图 3 各组大鼠胃癌组织中P53、STAT3和VEGF蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of P53, STAT3, and VEGF proteins in gastric cancer tissue of rats in various groups |
|
|
与对照组比较,模型组大鼠血清中IL-6、IL-10和TNF-α水平明显升高(P < 0.05);与模型组比较,奥沙利铂组、卡培他滨组和联合组大鼠血清中IL-6、IL-10和TNF-α水平明显降低(P < 0.05);与卡培他滨组和奥沙利铂组比较,联合组大鼠血清中IL-6、IL-10和TNF-α水平进一步降低(P < 0.05)。见表 3。
| (n=12, x±s) | |||
| Group | IL-6[ρB/(ng·L-1)] | IL-10[ρB/(ng·L-1)] | TNF-α[ρB/(μg·L-1)] |
| Control | 163.85±12.37 | 104.52±6.83 | 36.93±4.75 |
| Model | 242.85±20.80* | 226.80±25.67* | 64.23±5.21* |
| Capecitabine | 202.53±15.33△ | 179.83±13.32△ | 52.83±3.20△ |
| Oxaliplatin | 175.62±14.26△ | 144.23±16.93△ | 44.80±2.26△ |
| Combination | 167.26±12.06△#○ | 117.32±9.55△#○ | 39.38±3.08△#○ |
| F | 50.79 | 112.98 | 24.60 |
| P | < 0.001 | < 0.001 | < 0.001 |
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with capecitabine group; ○ P < 0.05 compared with oxaliplatin group. | |||
卡培他滨是新一代的氟尿嘧啶类口服药物,无细胞毒性,经肠道吸收后在肝内被羧酸酯酶转化为脱氧氟胞苷,脱氧氟胞苷进一步被胞苷脱氨酶转化为脱氧氟尿苷,该2种产物在肿瘤组织中被胸苷磷酸化酶转化为5-Fu[8],因此临床上使用卡培他滨治疗胃癌,既可以提高药物的抗肿瘤作用,又可降低药物对机体的不良反应。奥沙利铂作为第3代铂类衍生物,对晚期胃癌有明显疗效,其作用机制主要通过铂原子与肿瘤细胞DNA快速结合形成链内交联,阻断其复制和转录,达到抗肿瘤作用[9]。奥沙利铂可诱导肿瘤组织表达胸苷磷酸化酶,增加卡培他滨在肿瘤组织中的转化率,二者联合使用,起到协同作用。肿瘤质量和癌细胞凋亡情况反映胃肿瘤在实验性胃癌大鼠模型中的生长情况,本研究结果表明:联合组大鼠肿瘤平均质量明显低于卡培他滨组和奥沙利铂组,与此同时细胞AI明显升高,说明奥沙利铂联合卡培他滨使用具有协同增效作用,能有效控制胃癌病灶组织,防止其扩散,改善病情。
p53是一种抑癌基因,其表达在肿瘤的启动和进展期起重要作用,与胃癌的发生有密切关系[10]。VEGF是肿瘤血管形成的调控因子,可诱导血管内皮细胞有丝分裂进而刺激血管生成,VEGF的表达水平受p53调控[11]。STAT3是一种信号转导与转录激活因子,在细胞生长、凋亡和分化过程中发挥重要作用,能够介导炎症因子过度表达并抑制肿瘤特异性免疫应答,诱导肿瘤生长[12-13]。STAT3蛋白在胃癌组织中高表达,因此临床上将其作为胃癌诊断的分子标志物[14]。本研究结果表明:卡培他滨和奥沙利铂均能抑制胃癌模型大鼠胃癌组织中P53、VEGF和STAT3蛋白的表达,说明卡培他滨和奥沙利铂可通过抑制P53、VEGF和STAT3蛋白表达发挥抗肿瘤作用,与有关文献[15-16]报道结果一致。
IL-6、IL-10和TNF-α等细胞炎症因子参与STAT3蛋白的激活过程,与肿瘤细胞的生存与凋亡的调节有着密切的联系。该类细胞炎症因子通过与JAKs/STAT3信号通路表面的受体结合,诱导受体二聚化,发生酪氨酸磷酸化作用,激活JAKs,促进STAT3蛋白磷酸化[17-18]。此外,IL-6、IL-10和TNF-α可促进抗体产生,主要介导体液免疫反应,对机体产生抗肿瘤作用[19]。通过改善患者机体免疫功能,调节机体免疫平衡,可激活机体抗肿瘤免疫应答,有利于提高抗癌效果。本研究结果表明:卡培他滨和奥沙利铂均可明显降低胃癌大鼠血清中IL-6、IL-10和TNF-α水平,联合组大鼠血清中IL-6、IL-10和TNF-α水平明显低于卡培他滨组和奥沙利铂组,说明奥沙利铂联合卡培他滨可抑制实验性胃癌大鼠炎症反应,调节免疫功能。
综上所述,卡培他滨和奥沙利铂均可有效抑制胃癌组织P53、VEGF和STAT3蛋白表达,降低血清中炎性因子IL-6、IL-10和TNF-α水平,调节免疫功能。卡培他滨和奥沙利铂具有协同效应,可提高抗肿瘤效果,达到有效治疗胃癌的目的。
| [1] | DU XY, LIU X, WANG ZJ, et al. SLPI promotes the gastric cancer growth and metastasis by regulating the expression of P53, Bcl-2 and Caspase-8[J]. Eur Rev Med Pharmacol Sci, 2017, 21(7): 1495–1501. |
| [2] | SÁNCHEZ-ZAUCO N, TORRES J, GÖMEZ A, et al. Circulating blood levels of IL-6, IFN-γ, and IL-10 as potential diagnostic biomarkers in gastric cancer:a controlled study[J]. BMC Cancer, 2017, 17(1): 384. DOI:10.1186/s12885-017-3310-9 |
| [3] | WANG C, XI W Q, JIANG J L, et al. Metronomic chemotherapy remodel cancer-associated fibroblasts to decrease chemoresistance of gastric cancer in nude mice[J]. Oncol Lett, 2017, 14(6): 7903–7909. |
| [4] | 杨兰, 邓颖, 胡洪林, 等. 奥沙利铂分别联合卡培他滨及5-氟尿嘧啶/亚叶酸钙治疗晚期胃癌的疗效观察[J]. 实用医院临床杂志, 2015, 12(2): 79–81. DOI:10.3969/j.issn.1672-6170.2015.02.028 |
| [5] | 王方. 奥沙利铂联合5-氟尿嘧啶治疗胃肠道肿瘤的临床护理分析[J]. 中国实用医药, 2015, 10(30): 207–208. |
| [6] | 江波, 周伟, 龙翔宇, 等. 奥沙利铂联合5-氟尿嘧啶对食管癌患者血清IGF-1及TGF-β1水平的影响[J]. 现代生物医学进展, 2017, 17(20): 3940–3943. |
| [7] | 张焜和, 祝金泉. 改良Steel法建立人胃癌动物模型[J]. 实用肿瘤杂志, 1998, 13(5): 291–292. |
| [8] | SINGH K, GUPTA MK, SEAM RK, et al. A prospective randomized trial comparing capecitabine-based chemoradiotherapy with 5-FU-based chemoradiotherapy in neoadjuvant setting in locally advanced carcinoma rectum[J]. Indian J Cancer, 2017, 54(1): 347–351. DOI:10.4103/ijc.IJC_174_17 |
| [9] | 郭曼, 赵园园, 何信佳, 等. 异甘草酸镁对奥沙利铂在人胃癌裸鼠模型中抗肿瘤作用的影响研究[J]. 川北医学院学报, 2015, 30(4): 429–434. DOI:10.3969/j.issn.1005-3697.2015.04.02 |
| [10] | YU J Y, LI L, HUANG C S. Downregulation of inhibition of apoptosis-stimulating protein of p53(iASPP) suppresses cisplatin-resistant gastric carcinoma in vitro[J]. Med Sci Monit, 2017, 23: 5542–5549. DOI:10.12659/MSM.905403 |
| [11] | YU YF, ZHANG Y, SHEN N, et al. Effect of VEGF, P53 and telomerase on angiogenesis of gastric carcinoma tissue[J]. Asian Pac J Trop Med, 2014, 7(4): 293–296. DOI:10.1016/S1995-7645(14)60041-9 |
| [12] | 从静, 邢燕, 张苏云, 等. 信号传导与转录激活因子3与认知功能[J]. 中国妇幼健康研究, 2014, 25(6): 1112–1115. DOI:10.3969/j.issn.1673-5293.2014.06.072 |
| [13] | 龚代鹏, 张竹青, 张妍, 等. p-STAT3、Survivin和Mcl-1蛋白在胃癌组织中的表达及意义[J]. 中华临床医师杂志:电子版, 2015, 9(6): 915–920. |
| [14] | LI H, LU H, LV M, et al. Parthenolide facilitates apoptosis and reverses drug-resistance of human gastric carcinoma cells by inhibiting the STAT3 signaling pathway[J]. Oncol Lett, 2018, 15(3): 3572–3579. |
| [15] | 罗忠民, 路太英, 路彦娟, 等. 卡培他滨对晚期胃癌患者血清TNF-α、IL-6、VEGF及肿瘤标志物水平的影响及其疗效[J]. 中国生化药物杂志, 2015, 35(9): 149–151, 154. |
| [16] | 林昌荣, 杨建荣, 李碧锦, 等. 奥沙利铂对人结肠癌细胞NF-κB、STAT3表达影响[J]. 中国公共卫生, 2015, 31(8): 1053–1055. |
| [17] | RUI X, PAN HF, SHAO SL, et al. Anti-tumor and anti-angiogenic effects of Fucoidan on prostate cancer:possible JAK-STAT3 pathway[J]. BMC Complement Altern Med, 2017, 17(1): 378. DOI:10.1186/s12906-017-1885-y |
| [18] | ROZOVSKI U, WU JY, HARRIS DM, et al. Stimulation of the B-cell receptor activates the JAK2/STAT3 signaling pathway in chronic lymphocytic leukemia cells[J]. Blood, 2014, 123(24): 3797–3802. DOI:10.1182/blood-2013-10-534073 |
| [19] | 郭兴彩. 舒芬太尼复合地佐辛PCIA对胃癌患者术后血清TNF-α、IL-2和IL-6及疼痛的影响[J]. 当代医学, 2018, 24(2): 123–124. DOI:10.3969/j.issn.1009-4393.2018.02.057 |
 2019, Vol. 45
2019, Vol. 45


