扩展功能
文章信息
- 张淑霞, 霍文博, 苏莹, 李禛, 田静, 王彩霞, 孙成博, 邹颖刚, 于晓艳
- ZHANG Shuxia, HUO Wenbo, SU Ying, LI Zhen, TIAN Jing, WANG Caixia, SUN Chengbo, ZOU Yinggang, YU Xiaoyan
- 茵陈提取物对糖尿病大鼠肾组织中PTEN蛋白表达的影响及其肾脏保护作用
- Effect of herba artemisiae capillaris extracts on PTEN protein expression in kidney tissue of diabetic rats and its protective effect on kidney
- 吉林大学学报(医学版), 2019, 45(04): 779-783
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 779-783
- 10.13481/j.1671-587x.20190406
-
文章历史
- 收稿日期: 2018-10-12
2. 吉林大学第二医院妇产科, 吉林 长春 130041
2. Department of Obstetrics and Gynecology, Second Hospital, Jilin University, Changchun 130041, China
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最严重的慢性并发症之一,以肾小球细胞外基质(extracellular matrix,ECM)集聚最终发展成纤维化为病理特点。中医药防治糖尿病在我国历史悠久,寻找有效的中药成分并探索其药理机制一直是广大研究者关注的热点。茵陈是常用传统中药,早期研究[1-2]显示:茵陈有降低糖尿病动物空腹血糖水平和提高糖耐量的作用,还有研究者将茵陈为君药的传统中药复方用于改善早期糖尿病症状[3],而关于茵陈与DN的研究较少且缺乏机制研究。本课题组针对茵陈提取物(herba artemisiae capillaris extracts,HACE)对DN的防治作用进行了系列研究,本课题前期实验[4-5]已证实:HACE对DN大鼠肾脏具有保护作用。第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted chromatosome10, PTEN)是1997年首次在人类第10号染色体上发现的一个新的肿瘤抑制基因,后陆续发现其作为蛋白激酶调节因子参与多种生理病理过程。该基因编码的PTEN蛋白能特异性地使磷脂酰肌醇(3, 4, 5)-三磷酸[phosphati-dylinositol(3, 4, 5)-triphosphate, PIP3]去磷酸化,拮抗磷脂酰肌醇3-激酶(phosphoinositide-3 kinase, PI3K)/蛋白激酶B(protein kinase B, PKB/Akt)信号传导通路[6-8],而PI3K-PI3K/Akt通路激活在DN的发生发展中具有致纤维化作用[9-11]。研究[12]表明:高表达的PTEN可改善肾脏足细胞的表型变化,减轻肾足细胞损伤。近年来研究[13-14]显示:高血糖或糖尿病状态下PTEN可能是一种肾脏保护基因。本研究以PTEN为切入点,在前期实验的基础上观察HACE对DN大鼠肾组织PTEN表达的影响,进一步探讨HACE的药理作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器雄性Wistar大鼠30只,体质量190~220 g,购于吉林大学实验动物中心,动物合格证号:SCXK(辽)2015-0006。HACE购于湖南远成共创科技有限公司(批号131122),绿原酸浓度为1.32%(>1.0%),对羟基苯乙酮浓度为0.18%(>0.10%),符合《中国药典》(2015年)标准;链脲佐菌素(STZ,美国Sigma公司,批号15215),小鼠抗大鼠PTEN单克隆抗体(美国Abclonal公司),HRP标记的山羊抗小鼠IgG抗体、PV-6000免疫组织化学试剂盒、DAB显色试剂盒和GAPDH抗体(北京中杉金桥生物技术有限公司),ECL底物发光显色试剂盒(美国Thermo Scientific Pierce公司),其他试剂均为国产分析纯。病理显微照相系统(日本Nikon公司),电泳转移装置(美国Bio-bad公司),日立7150全自动生化分析仪(日本日立公司)。
1.2 大鼠糖尿病模型的制备和分组雄性Wistar大鼠经适应性饲养1周后禁食12 h,腹腔注射2%STZ(55 mg·kg-1)制备糖尿病模型,正常大鼠腹腔注射等量0.1 mmol·L-1枸橼酸盐缓冲液作为对照组(n=6)。1周后选择血糖水平≥16.67 mmol·L-1,尿糖≥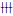
代谢笼收集大鼠24 h尿量,采用日立7150全自动生化分析仪检测尿白蛋白和尿总蛋白浓度。尿白蛋白排泄率(mg·24h-1)=尿白蛋白浓度(mg·mL-1)×24h尿量(mL);尿总蛋白排泄率(mg·24h-1)=尿总蛋白浓度(mg·mL-1)×24h尿量(mL)。
1.4 HE、PAS和Masson染色观察大鼠肾组织形态表现及ECM集聚大鼠肾组织石蜡标本切片后进行常规HE、PAS及Masson染色,HE染色观察大鼠肾脏组织结构,PAS和Masson染色重点观察肾小球ECM集聚情况。
1.5 免疫组织化学法检测大鼠肾组织中PTEN蛋白表达PV-6000免疫组织化学试剂盒常规步骤进行操作。PTEN一抗稀释浓度分别为1:200。封片后镜下观察PTEN蛋白分布及表达情况。
1.6 Western blotting法检测各组大鼠肾皮质组织中PTEN蛋白表达水平切取冻存大鼠肾皮质组织20mg,放入预冷的800μL蛋白裂解液中,电动匀浆至完全裂解,离心取上清,蛋白定量计算样本蛋白浓度。10%SDS-PAGE凝胶电泳分离总蛋白后置入电泳转移装置中转膜1 h,电转移后的PVDF膜依次经室温封闭1 h、一抗(PTEN抗体1:1000稀释;GAPDH抗体1:5000稀释)4℃孵育过夜、二抗37 ℃孵育1 h、曝光和显影。最后采用Image J软件分析各组蛋白的条带灰度值。以GAPDH为内参,PTEN蛋白相对表达水平=PTEN条带灰度值/ GAPDH条带灰度值。
1.7 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠尿白蛋白和尿总蛋白排泄率及各组大鼠肾组织中PTEN蛋白表达水平以x±s表示,所有计量资料经检验均呈正态分布,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠一般状态、尿白蛋白和尿总蛋白排泄率与对照组比较,模型组大鼠体质量明显减轻,出现明显的“三多一少”症状即多饮、多尿、多食和体质量减轻;HACE组大鼠上述症状明显改善。与对照组[(8.53±0.79) mmol·L-1]比较,模型组和HACE组大鼠血糖水平[(27.94±6.47)和(22.19±9.46) mmol·L-1]明显升高(P < 0.01);与模型组比较,HACE组大鼠血糖水平变化略有降低,但差异无统计学意义(P>0.05)。与对照组[(0.36±0.22)mg·24h-1]比较,模型组大鼠尿白蛋白排泄率[(0.79±0.45)mg·24h-1]明显升高(P < 0.05);与模型组比较,HACE组大鼠尿白蛋白排泄率[(0.46±0.22)mg·24h-1]明显降低(P < 0.05)。各组大鼠尿总蛋白排泄率比较差异无统计学意义(P>0.05),但与对照组和HACE组比较,模型组大鼠尿总蛋白排泄率有升高趋势。
2.2 各组大鼠肾组织形态表现HE染色显示:与对照组比较,模型组大鼠出现肾小球体积肿大和系膜区扩大等病变,而HACE组大鼠较模型组大鼠肾组织病变明显减轻。PAS染色显示:与对照组比较,模型组大鼠肾组织中大部分肾小球出现轻重程度不同的PAS阳性物质沉积,表现为系膜区PAS阳性染色物质积聚、毛细血管壁PAS阳性染色物质局灶性增厚;与模型组比较,HACE组大鼠肾组织中出现PAS阳性染色物质沉积的肾小球数目减少且程度减轻(图 1A~C,见插页二)。Masson染色显示:与对照组比较,模型组大鼠肾组织中大部分肾小球出现轻重程度不同的蓝染物质沉积;与模型组比较,HACE组大鼠肾组织中出现蓝染物质沉积的肾小球数目及程度均减轻(图 1D~F,见插页二)。
|
| A, D: Control group; B, E: Model group; C, F: HACE group. 图 1 PAS染色(A~C)和Masson染色(D~F)观察各组大鼠肾小球ECM积聚(×400) Fig. 1 ECM accumulation in glomeruli of rats in various groups observed by PAS staining(A-C) and Masson staining (D-F)(×400) |
|
|
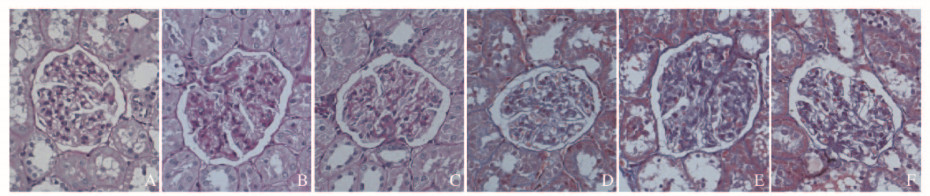
免疫组织化学染色结果显示:对照组大鼠肾组织中有较高水平PTEN蛋白表达,其中肾小管中PTEN蛋白表达量高于肾小球;与对照组比较,模型组大鼠肾组织中肾小管和肾小球PTEN蛋白表达量均明显降低;与模型组比较,HACE组大鼠肾组织中肾小管和肾小球PTEN蛋白表达量均明显升高。见图 2(插页二)。
|
| A: Control group; B: Model group; C: HACE group. 图 2 免疫组织化学染色观察各组大鼠肾皮质中PTEN表达(×400) Fig. 2 Expressions of PTEN in renal cortex of rats in various groups observed by immunohistochemistry staining(×400) |
|
|
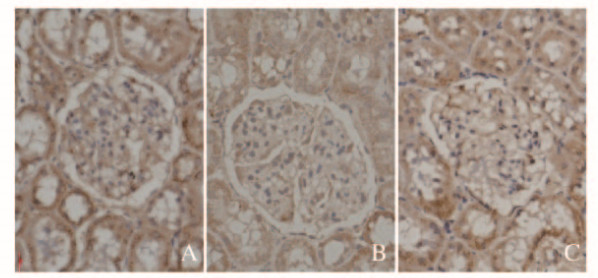
与对照组(1.26±0.18)比较,模型组大鼠肾皮质组织中PTEN蛋白表达水平(0.63±0.09)明显降低(P < 0.05);与模型组比较,HACE组大鼠肾皮质组织中PTEN蛋白表达水平(0.88±0.15)明显升高(P < 0.05)。见图 3。
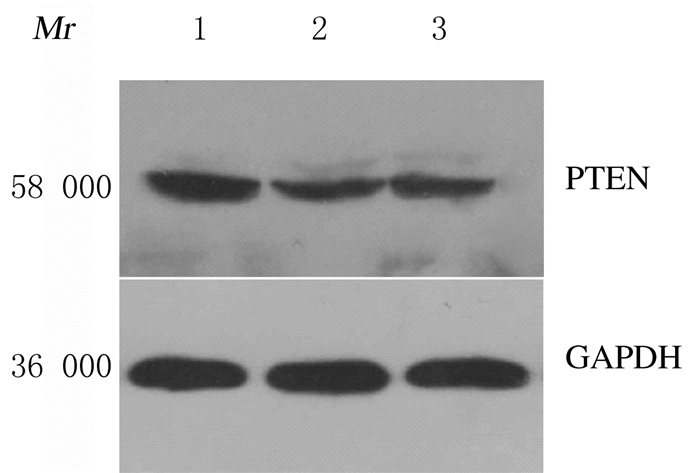
|
| Lane 1: Control group; Lane 2: Model group; Lane 3: HACE group. 图 3 Western blotting法检测各组大鼠肾皮质组织中PTEN蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of PTEN protein in renal cortex tissue of rats in various groups observed by Western blotting method |
|
|
DN是糖尿病严重并发症之一,主要表现为ECM集聚(系膜增生和基膜增厚)并伴随着蛋白尿的发生。近年来其发病率持续升高,近1/3的糖尿病患者发展为DN,因此探讨DN发病的机制以及寻找针对DN的有效预防治疗方法近年来一直是糖尿病研究领域的热点课题。
研究[15]显示:PTEN在DN患者肾小球中的表达随着肾小球病变的加重逐渐减弱。糖尿病大鼠肾小球系膜细胞PTEN表达下调,暴露于高糖的肾小球系膜细胞PTEN表达也下调[16]。还有研究[17]显示:DN患者肾小球PTEN表达水平与尿液中足细胞的标志蛋白之一即足盂蛋白(PCX)表达水平呈正相关关系,在DN患者肾组织中随着PTEN表达的下调,足细胞损伤脱落逐渐加重、蛋白尿加重,表明PTEN可能是一种肾脏保护基因。
本研究采用STZ复制糖尿病模型,造模动物出现明显的“三多一少”症状即多饮、多尿、多食及体质量减轻,血糖水平明显升高,表明糖尿病模型成功建立。进一步分析结果显示:模型组大鼠尿白蛋白排泄率明显升高、肾组织中肾小球出现不同程度的病理变化,说明糖尿病大鼠已出现早期DN的改变,同时伴有肾组织中PTEN蛋白表达水平降低,而给予HACE治疗后,上述现象均有不同程度的改善,提示HACE可缓解DN大鼠肾脏的功能及组织形态改变,可能与其上调肾组织特异性蛋白PTEN表达有关。PTEN的作用机制主要与PI3K /Akt信号通路有密切关联。PTEN主要是使PIP3去磷酸化,从而起到拮抗PI3K的作用,实现对PI3K /Akt通路的负调控。已知PI3K /Akt信号通路在DN发生发展过程中发挥重要作用。足细胞位于肾小球毛细血管袢的外侧,是构成滤过屏障的主要成分,研究[15]显示:高糖可通过激活PI3K /Akt信号通路介导足细胞损伤,从而导致蛋白尿产生。目前已知致纤维化作用最强的转化生长因子β1(transforming growth factor-beta 1,TGF-β1),可以激活PI3K/Akt通路,从而增加纤维连接蛋白(FN)、Ⅳ型胶原的分泌和沉积,促进DN的发生发展[18]。程悦等[19]采用重组PTEN腺病毒转染大鼠肾成纤维细胞,再给予TGF-β1刺激,TGF-β1刺激所致大鼠肾成纤维细胞增殖及胶原和FN的分泌受到抑制。体外抑制TGF-β信号可阻断高糖对肾小球系膜细胞PTEN下调的影响[16]。此外,PTEN的作用还可通过其活性来调节。PTEN蛋白C端尾部磷酸化位点的磷酸化修饰与其稳定性和活性有关[20]。磷酸化的PTEN结构稳定性增高,而酶活性明显降低,去磷酸化的PTEN酶活性增强。
本研究在证实了HACE肾脏保护作用的同时检测了PTEN表达情况:HACE可上调糖尿病大鼠肾组织PTEN表达,考虑到PTEN与PI3K/Akt通路的密切关系,及后者在DN纤维化进程中的作用,推测HACE对PTEN表达的影响可能是HACE肾脏保护作用的药理机制之一,但其具体机制如TGF-β1在其中的作用以及PTEN酶活性变化等还有待于进一步探讨。本课题组下一步将针对此通路进行深入研究。
| [1] | 潘竞锵, 刘广南, 刘惠纯, 等. 茵陈蒿对小鼠血糖、血脂的影响[J]. 中药材, 1998, 21(8): 408–411. |
| [2] | 潘竞锵, 韩超, 刘惠纯, 等. 茵陈蒿汤对正常和多种糖尿病模型动物血糖的影响[J]. 中药材, 2001, 24(2): 128–131. DOI:10.3321/j.issn:1001-4454.2001.02.024 |
| [3] | 袁效涵, 石鹤峰, 韩伟峰. 加味茵陈蒿汤治疗2型糖尿病40例[J]. 中医研究, 2007, 20(2): 43–44. DOI:10.3969/j.issn.1001-6910.2007.02.020 |
| [4] | GENG JN, YU XY, LIU CY, et al. Herba artemisiae capillaris extract prevents the development of streptozotocin-induced diabetic nephropathy of rat[J]. Evid Based Complement Alternat Med, 2018, 2018: 5180165. |
| [5] | 孙成博, 孙波, 刘春禹, 等. 茵陈提取物对糖尿病大鼠肾组织miRNAs表达谱的影响及其肾脏保护作用[J]. 吉林大学学报:医学版, 2018, 44(3): 493–498. |
| [6] | MAEHAMA T, DIXON J E. The tumor suppressor, PTEN/MMAC1, dephosphorylates the lipid second messenger, phosphatidylinositol 3, 4, 5-trisphosphate[J]. J Biol Chem, 1998, 273(22): 13375–13378. DOI:10.1074/jbc.273.22.13375 |
| [7] | 刘伦华, 楼丽广. PTEN功能调节的研究进展[J]. 中国药理学通报, 2005, 21(7): 778–781. DOI:10.3321/j.issn:1001-1978.2005.07.003 |
| [8] | HADDADI N, LIN Y, TRAVIS G, et al. PTEN/PTENP1:Regulating the regulator of RTK-dependent PI3K/Akt signalling, new targets for cancer therapy[J]. Mol Cancer, 2018, 17(1): 37. DOI:10.1186/s12943-018-0803-3 |
| [9] | LEE YJ, HAN HJ. Troglitazone ameliorates high glucose-induced EMT and dysfunction of SGLTs through PI3K/Akt, GSK-3β, Snail1, and β-catenin in renal proximal tubule cells[J]. Am J Physiol Renal Physiol, 2010, 298(5): F1263–F1275. DOI:10.1152/ajprenal.00475.2009 |
| [10] | HAO J, LIU S, ZHAO S, et al. PI3K/Akt pathway mediates high glucose-induced lipogenesis and extracellular matrix accumulation in HKC cells through regulation of SREBP-1 and TGF-β1[J]. Histochem Cell Biol, 2011, 135(2): 173–181. DOI:10.1007/s00418-011-0777-3 |
| [11] | WANG XM, YAO M, LIU SX, et al. Interplay between the Notch and PI3K/Akt pathways in high glucose-induced podocyte apoptosis[J]. Am J Physiol Renal Physiol, 2014, 306(2): F205–F213. DOI:10.1152/ajprenal.90005.2013 |
| [12] | LI X Y, WANG SS, HAN Z, et al. Triptolide restores autophagy to alleviate diabetic renal fibrosis through the miR-141-3p/PTEN/Akt/mTOR pathway[J]. Mol Ther Nucleic Acids, 2017, 9: 48–56. DOI:10.1016/j.omtn.2017.08.011 |
| [13] | WANG H, FENG Z, XIE J, et al. Podocyte-specific knockin of PTEN protects kidney from hyperglycemia[J]. Am J Physiol Renal Physiol, 2018, 314(6): F1096–F1107. DOI:10.1152/ajprenal.00575.2017 |
| [14] | SUN J, LI ZP, ZHANG RQ, et al. Repression of miR-217 protects against high glucose-induced podocyte injury and insulin resistance by restoring PTEN-mediated autophagy pathway[J]. Biochem Biophys Res Commun, 2017, 483(1): 318–324. DOI:10.1016/j.bbrc.2016.12.145 |
| [15] | 邢玲玲, 傅淑霞, 杨林, 等. PTEN在糖尿病肾病患者足细胞损伤中的作用[J]. 临床与实验病理学杂志, 2014, 30(12): 1375–1378. |
| [16] | MAHIMAINATHAN L, DAS F, VENKATESAN B, et al. Mesangial cell hypertrophy by high glucose is mediated by downregulation of the tumor suppressor PTEN[J]. Diabetes, 2006, 55(7): 2115–2125. DOI:10.2337/db05-1326 |
| [17] | CAMPION CG, SANCHEZ-FERRAS O, BATCHU SN. Potential role of serum and urinary biomarkers in diagnosis and prognosis of diabetic nephropathy[J]. Can J Kidney Health Dis, 2017, 4: 2054358117705371. |
| [18] | 王圆圆, 刘瑞霞, 郭兵, 等. 大鼠肾组织PETN表达下调在糖尿病肾病发展中的作用[J]. 生理学报, 2011, 63(4): 325–332. |
| [19] | 程悦, 王代红, 张耀全, 等. PTEN编码蛋白对TGF-β1刺激大鼠肾成纤维细胞分泌Col Ⅳ、FN的抑制作用[J]. 解放军医学杂志, 2007, 32(7): 719–721. DOI:10.3321/j.issn:0577-7402.2007.07.021 |
| [20] | HLOBILKOVÁ A, KNILLOVÁ J, BÁRTEK J, et al. The mechanism of action of the tumour suppressor gene PTEN[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2003, 147(1): 19–25. DOI:10.5507/bp.2003.003 |
 2019, Vol. 45
2019, Vol. 45


