扩展功能
文章信息
- 信瑞, 李冬, 徐慧英, 王春宇, 曲丹华, 孙海峰
- XIN Rui, LI Dong, XU Huiying, WANG Chunyu, QU Danhua, SUN Haifeng
- miRNA-21对乳腺癌细胞放射敏感性的影响及其机制
- Influence of miRNA-21 in radiosensitivity of breast cancer cells and its mechanism
- 吉林大学学报(医学版), 2019, 45(04): 772-778
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 772-778
- 10.13481/j.1671-587x.20190405
-
文章历史
- 收稿日期: 2018-12-04
2. 吉林大学第二医院妇产科, 吉林 长春 130041;
3. 吉林大学第一医院联合超声科, 吉林 长春 130021;
4. 吉林大学第二医院放疗科, 吉林 长春 130041;
5. 吉林大学第二医院呼吸与危重症医学科, 吉林 长春 130041
2. Department of Obstetrics and Gynecology, Second Hospital, Jilin University, Changchun 130041, China;
3. Department of Ultrasonography, First Hospital, Jilin University, Changchun 130021, China;
4. Department of Radiotherapy, Second Hospital, Jilin University, Changchun 130041, China;
5. Department of Respiration and Critical Disease, Second Hospital, Jilin University, Changchun 130041, China
放射治疗是乳腺癌标准治疗方式之一,据统计,70%~80%乳腺癌患者需要术后放疗[1]。治疗早期,乳腺癌细胞对放射治疗比较敏感,但随着疗程的增加,其放射抵抗逐渐明显[2]。乳腺癌放射抗性产生是影响放疗疗效和肿瘤复发的重要因素,目前其产生的机制尚未阐明。近年来研究[3]表明:miRNA与肿瘤的形成、肿瘤细胞的增殖和治疗均有着密切的联系。乳腺癌miRNA表达也存在异常,已有研究[3]显示:miRNA-21、miRNA-16和miRNA-141等在乳腺癌组织中呈异常高表达。miRNA-21是一种具有致癌作用的miRNA,在乳腺癌[4]、胶质瘤、胆管癌[5]和鼻咽癌[6]等多种肿瘤中均存在高表达。研究[4-6]显示:miRNA-21与鼻咽癌等恶性肿瘤的放疗耐药有关。另有研究[7]表明:miRNA-21表达与乳腺癌的分化、转移、分期和患者生存率有密切关联。多种miRNA在肿瘤细胞中存在差异表达,能参与调节细胞周期和凋亡,以此改变肿瘤细胞的放射敏感性[8],但miRNA-21与乳腺癌细胞的生长和放射治疗的关联性目前尚无相关报道。鉴于miRNA-21在乳腺癌中高表达,本研究旨在分析miRNA-21与乳腺癌辐射敏感性的关系,并初步探讨其分子机制,以期为乳腺癌的放射增敏提供实验依据。
1 材料与方法 1.1 细胞株、组织标本和主要试剂人乳腺癌T47D和MDA-MB-361细胞株购自美国模式培养物集存库。正常乳腺组织取自吉林大学第二医院病理室保存的手术标本。DMEM培养基和胎牛血清购自美国Gibco公司,青霉素和链霉素购自美国Hyclone公司,anti-miRNA-21反义寡核苷酸和阴性对照反义寡核苷酸由上海生工公司合成,lipofectamine TM 2000试剂盒购自天根生化科技(北京)有限公司,CCK8试剂盒和PI染液购自上海碧云天生物技术研究所,焦碳酸二乙酯(DEPC水)、RNA分离试剂和实时定量PCR试剂盒购自宝生物工程(大连)有限公司。
1.2 细胞培养和转染T47D和MDA-MB-361细胞培养于37℃、5% CO2和100%饱和湿度的CO2培养箱中,培养基为含10%胎牛血清、100 U·mL-1青霉素和100 U·mL-1链霉素的DMEM培养基。每隔2 ~ 3 d换液1次,毎天均使用倒置显微镜观察细胞, 记录细胞数量和状态等指标。
anti-miRNA-21反义寡核苷酸和阴性对照反义寡核苷酸由上海生工公司合成,anti-miRNA-21序列为5′-UCAACAUCAGUCUGAUAAGCUA-3′, 阴性对照序列为5′-CAGUACUUUUGUGU AGUACAA-3′。取对数生长期T47D和MDA-MB-361细胞,分为空白对照组(不转染细胞)、阴性对照组(转染阴性对照序列的细胞)和anti-miRNA-21组(转染anti-miRNA-21序列的细胞),以每孔5.0×105个细胞接种于6孔板中,在37℃、CO2细胞培养箱中孵育24 h,按lipofeetamineTM2000说明书进行转染,最佳转染条件为20 pmol·L-1 NC-FAM oligo:1 μL LipofactamineTM 2000。
1.3 照射方法GC3000 Elan辐射器(MDS Nordion, 加拿大),γ射线,放射源为137Cs,活度为50.7E+12 Bq,源皮距为100 cm。
1.4 CCK8实验检测细胞存活率T47D和MDA-MB-361细胞分别分为0.0、2.5和5.0 Gy γ射线照射组;收集对数期细胞,96孔板中每孔加入100 μL,使待测细胞密度调至每孔5000个,置于37℃、CO2细胞培养箱中孵育24 h。协同γ射线辐射处理细胞(0.0、2.5和5.0 Gy),设3个复孔,37℃、CO2细胞培养箱中孵育24 ~ 72 h,倒置显微镜下观察细胞形态。每孔加入20 μL CCK8试剂,避光培养4 h。使用酶标仪测定450 nm波长处各孔的吸光度(A)值。对照组细胞存活率设为100%,实验组细胞存活率=实验组A值/对照组A值×100%。
1.5 流式细胞术检测不同周期细胞百分率T47D和MDA-MB-361细胞分别分为0.0、2.5和5.0 Gy γ射线照射组;收集对数生长期细胞接种于6孔板中,经0.0、2.5和5.0 Gy γ射线处理并连续培养24 h后,收集细胞并调整细胞悬液数至约1 ×106mL-1, 收集培养细胞,加入0.5 g·L-1 RNase 50 μL, 混匀,37℃水浴30 min,PBS缓冲液洗去RNase,100 μL PBS缓冲液重悬,再加入0.05 g·L-1 PI染液4℃避光染色5 min,采用流式细胞仪检测,并采用CellQμest3.0软件进行细胞周期DNA含量分析,计算不同细胞周期细胞百分率。
1.6 实时定量PCRmiRNA-21引物由上海生工公司合成,上游引物为5′-CAAG TGTGGGCTGCTGAGGA-3′,下游引物为5′-AGCCTGGGTACAGGTTGTTGATG-3′。非照射条件下miRNA-21水平检测分为正常乳腺组织、T47D细胞和MDA-MB-361细胞组,照射条件下T47D和MDA-MB-361细胞分别分为0.0和5.0 Gy γ射线照射组(检测时间0~72 h)。
用RNA分离试剂抽提正常乳腺组织和细胞中总RNA,取5 μg RNA用Promega MMLV逆转录酶试剂进行逆转录反应,反应体系为20 μL,取0.5 μL RT产物进行实时定量PCR反应。反应条件:10 μL SYBR Green Mix (2 ×),0.4 μL ROX Reference Dye Ⅱ,1 μL Primer1 (5 μmol·L-1),1 μL Primer2 (5 μmol·L-1),0.5 μL模板cDNA,7.1 μL DEPC水。荧光定量PCR扩增条件的设置:94℃、4 min,94℃、30 s,50℃、30 s,72℃、40 s,40个循环。以空白对照组组织或细胞中mRNA表达水平为1,计算实验组组织或细胞中mRNA表达水平。
1.7 miRNA-21转染后各组细胞放射抗性和不同周期细胞百分率检测miRNA-21转染后,T47D和MDA-MB-361细胞分别分为空白对照组、阴性对照组和anti-miRNA-21组,γ照射剂量为0.0、2.5和5.0 Gy,采用1.3和1.6中的方法检测各组细胞存活率和miRNA-21表达水平,即细胞的放射抗性;T47D细胞分为空白对照组、阴性对照组和anti-miRNA-21组,γ照射剂量为0.0和5.0 Gy,采用1.5中的方法检测各组细胞不同周期细胞百分率。
1.8 统计学分析采用SPSS 15.0统计软件进行统计学分析,采用Origin 8.0软件绘图。各组细胞存活率、不同细胞周期细胞百分率和miRNA-21表达水平均以x±s表示,计量资料符合正态分布,2组间样本均数比较采用t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 γ射线照射后各组T47D和MDA-MB-361细胞存活率T47D和MDA-MB-361细胞经0.0、2.5和5.0 Gy γ射线照射后,继续培养72 h,采用CCK8法检测细胞存活率。与0.0 Gy照射组比较,5.0 Gy照射组T47D和MDA-MB-361组细胞存活率均明显降低(P < 0.05或P < 0.01)。5.0 Gy照射组T47D细胞存活率明显高于MDA-MB-361细胞(t=6.521, P=0.003),提示T47D细胞具有更强放射抗性。见表 1。
| (n=3, x±s, η/%) | ||
| Group | Survival rate | |
| T47D cells | MDA-MB-361 cells | |
| 0.0 Gyradiation | 100.0±3.9 | 100.0±2.8 |
| 2.5 Gyradiation | 92.2±2.9 | 74.0±3.6* |
| 5.0 Gy radiation | 81.2±4.1*△ | 39.4±2.6** |
| * P < 0.05,* * P < 0.01 compared with 0.0 Gy radiation group; △ P < 0.01 compared with MDA-MB-361 cells. | ||
T47D和MDA-MB-361细胞经过0.0、2.5和5.0 Gy γ射线照射后,继续培养24 h,采用流式细胞仪分析细胞周期分布。与0.0 Gy照射组比较,2.5和5.0 Gy组T47D和MDA-MB-361细胞G2/M期细胞百分率明显升高(P < 0.05或P < 0.01),G1/S期细胞百分率明显降低(P < 0.05或P < 0.01)。经5.0 Gyγ射线照射后,T47D细胞G2/M期细胞百分率明显低于MDA-MB-361细胞(P < 0.05),提示T47D细胞的放射抗性与细胞周期有关。见图 1和表 2。
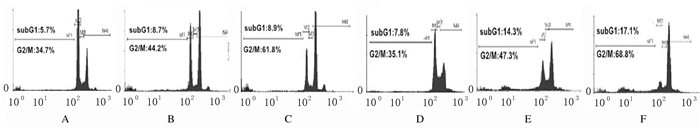
|
| A-C:T47D cells; D-F:MDA-MB-361 cells; A, D:0.0 Gyradiation group; B, E:2.5 Gy radiation group; C, F:5.0 Gy radiation group. 图 1 流式细胞术检测γ射线照射后各组T47D和MDA-MB-361细胞不同细胞周期细胞百分率 Fig. 1 Percentages of T47D and MDA-MB-361 cells at different cell cycles in various groups detected by flow cytomertry after γ-ray radiation |
|
|
| (n=3, x±s, η/%) | |||||||
| Group | Percentage of T47D cells | Percentage of MDA-MB-361 cells | |||||
| G1/S | G2/M | SubG1 | G1/S | G2/M | SubG1 | ||
| 0.0Gyradiation | 60.8±5.3 | 33.6±3.7 | 5.6±1.2 | 57.2±4.8 | 35.0±2.39 | 7.8±0.9 | |
| 2.5 Gyradiation | 46.7±4.7*△ | 44.6±5.8* | 8.7±0.9△ | 37.9±5.2* | 47.6±5.1* | 14.5±2.1* | |
| 5.0 Gyradiation | 29.5±6.3**△△ | 61.7±5.7**△ | 8.8±1.4*△△ | 14.0±3.2** | 68.8±8.4** | 17.2±2.0** | |
| * P < 0.05, * * P < 0.01 compared with 0.0 Gy radiation group; △ P < 0.05, △△ P < 0.01 compared with MDA-MB-361 cells. | |||||||
与正常乳腺组织比较,T47D和MDA-MB-361细胞中miRNA-21表达水平升高,其中T47D细胞miRNA-21表达水平最高,是MDA-MB-361细胞的5倍(t=14.214, P < 0.001),提示乳腺癌辐射抗性与miRNA-21有关。当给予2种细胞5.0 Gy γ射线照射后,连续培养72 h,T27D和MDA-MB-361细胞在8 h前均表现出明显的miRNA-21表达上调,而在8 h后均逐渐回落;其中,8 h时T27D细胞miRNA-21水平是0 h时的3.7倍(t=10.015, P=0.001),MDA-MB-361细胞miRNA-21表达水平是0 h时的1.9倍(t=4.069, P=0.017)。见图 2。
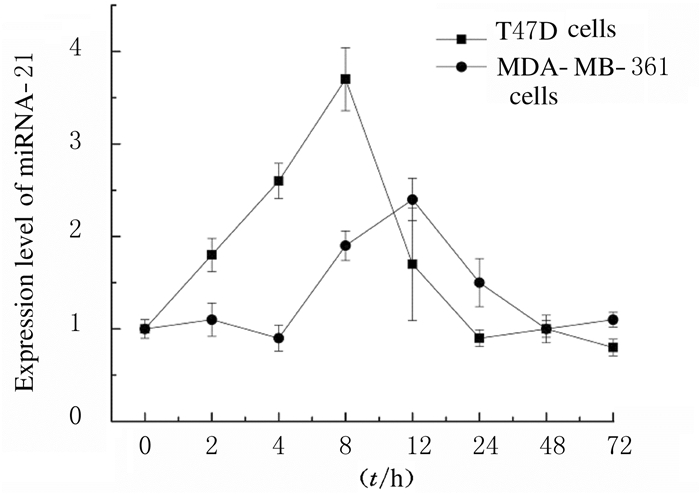
|
| 图 2 γ射线照射后不同时间乳腺癌T47D和MDA-MB-361细胞中miRNA-21表达水平 Fig. 2 Expression levels of miRNA-21in T47D and MDA-MB-361 cells at different time afterγ-ray radiation |
|
|
与空白对照组比较,anti-miRNA-21组T47D和MDA-MB-361细胞中miRNA-21表达水平明显降低(t=3.962, P=0.016; t=5.840, P=0.005),而阴性对照组与空白对照组间比较差异无统计学意义(P>0.05)(图 3A)。0.0 Gy γ射线照射后继续培养72 h,与空白对照组(0.0 Gy γ射线照射)比较,anti-miRNA-21组2种细胞存活率均明显降低(t=5.625, P=0.006; t=5.848, P=0.005);5.0 Gy γ射线照射后继续培养72 h,与空白对照组(5.0 Gy γ射线照射)比较,anti-miRNA-21组2种细胞存活率进一步降低(t=3.387, P=0.019;t=5.794, P=0.005),且明显低于0.0 Gy照射时的空白对照组(t=5.479, P=0.006; t=17.374, P < 0.01);阴性对照组与空白对照组间比较差异均无统计学意义(P>0.05)。见图 3B和C。

|
| *P < 0.05, * *P < 0.01 compared with blank control group; A: Expression levels of miRNA-21 in T47D and MDA-MB-361 cells after transfection; B, C: Survival rates of T47D and MDA-MB-361 cells after transfection. 图 3 各组T47D和MDA-MB-361细胞中miR-21表达水平和细胞存活率 Fig. 3 Expression levels of miRNA-21 in T47D and MDA-MB-361 cells and survival rates of cells in various groups |
|
|
与照射前比较,给予5.0 Gy γ射线照射后,空白对照组细胞G2/M期细胞百分率明显升高(t=4.628, P=0.009)。5.0Gy射线照射前,与空白对照组比较,anti-miRNA-21组G2/M期细胞百分率差异无统计学意义(P>0.05),subG1期细胞百分率明显升高(t=3.416, P=0.021);给予5.0 Gyγ射线照射后,与空白对照组比较,anti-miRNA-21组G2/M期细胞百分率明显降低(t=6.883, P=0.003),subG1期细胞百分率明显升高(t=6.025, P=0.004)。见图 4和表 3。
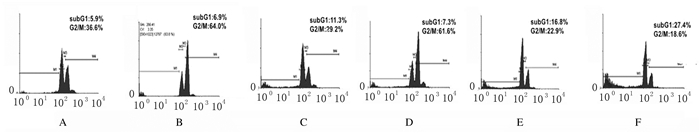
|
| A, B:Blank control group; C, D:Negative control group; E, F: Anti-miRNA-21 group; A, C, E: Before radiation; B, D, F:After γ-ray 5.0 Gy. 图 4 流式细胞术检测5.0 Gy γ射线照射前后各组不同细胞周期T47D细胞百分率 Fig. 4 Percentages of T47D cells at different cell cycles in various groups before and after 5.0 Gy γ-ray radiation detected by flow cytometry |
|
|
| Group | G1/S | G2/M | SubG1 |
| Blank control | |||
| Before radiation | 57.6±5.1 | 36.6±2.7 | 5.8±0.8 |
| After radiation | 29.2±2.6 | 64.0±5.6* | 6.8±2.0 |
| Negative control | |||
| Before radiation | 59.8±6.5 | 29.6±4.1 | 10.6±2.1 |
| After radiation | 30.9±4.0 | 61.5±5.7 | 7.6±1.8 |
| Anti-miRNA-21 | |||
| Before radiation | 60.5±7.2 | 22.8±3.6 | 16.7±3.2△ |
| After radiation | 54.0±6.2** | 18.6±2.9△△ | 27.4±4.1△△ |
| * P < 0.05, * * P < 0.01 vs before radiation; △ P < 0.05, △△ P < 0.01 vs blank control group. | |||
miRNA是一类由18 ~ 25个核苷酸组成的非编码内源性RNA分子,在果蝇、线虫、小鼠及人类等真核生物细胞中广泛存在[9-11]。miRNA通过碱基互补配对的方式与靶基因结合,导致靶基因降解,在机体发育、细胞增殖、代谢、凋亡、衰老和肿瘤发生发展等多种生物学过程中发挥调控作用。目前,经实验研究确认的miRNA共有234个,超过半数的miRNA定位于肿瘤发生相关的染色质区域,miRNA-21是一种具有致癌作用的miRNA[10]。最初在恶性胶质瘤[4]中发现miRNA-21的高表达,随后的研究[3]也显示其在乳腺癌中的高表达。MARTIN等[11]采用实时定量PCR检测了369例乳腺癌患者的乳腺癌组织的miRNA-21表达发现:乳腺癌组织中miRNA-21表达水平明显高于正常乳腺组织,且miRNA-21的高表达与乳腺癌患者肿瘤分级、不良预后和生存率有密切关联。研究[12-14]报道:miRNA-21能够下调金属蛋白酶抑制因子1(tissue inhibitor of matrix metalloproteinases 1,TIMP1)、第10号染色体缺失的磷酸酶及张力蛋白同源物(phosphate and tension homology deleted on chromsome 10,PTEN)和程序性细胞死亡因子4(programmed cell death 4,PDCD4)等抑癌基因的表达,并起到致癌作用。
本研究分析2种乳腺癌细胞株T47D和MDA-MB-361的放射敏感性,结果显示:给予同样剂量照射时,MDA-MB-361细胞存活率明显低于T47D细胞, 证实其具有更强的放射敏感性;2种细胞中miRNA-21表达水平均明显高于正常乳腺组织,但是T47D细胞拥有更高的miRNA-21表达;2种乳腺癌细胞在照射后8 h内均表现出明显的miRNA-21表达上调,提示miRNA-21与乳腺癌细胞的放射抗性有关。狄英波等[15]研究了3种乳腺癌细胞的放射敏感性发现:miRNA-21的表达从高到低分别为MDA-MB-231、MCF7和MDA-MB-435s,而克隆形成实验显示辐射敏感性从高到低为MDA-MB-435s、MCF7和MDA-MB-231,两者呈负相关关系,与本研究结果类似。
GABRIELY等[16]在乳腺癌细胞株MCF7中敲除了miRNA-21表达,结果显示:miRNA-21表达敲除后MCF7细胞体外增殖能力和小鼠异种移植瘤生长均被抑制,该抑制作用伴随着MCF7细胞凋亡率的升高。为探讨miRNA-21与乳腺癌放射敏感性的关系,本研究采用慢病毒转染的方法降低了T47D和MDA-MB-361细胞中miRNA-21表达,miRNA-21表达的下调明显降低了在放射条件下的2种细胞的细胞存活率,提示其表达下调能够起到乳腺癌放射增敏作用。但T47D细胞存活率仍高于MDA-MB-361细胞,可能是虽然anti-miRNA-21转染降低了miRNA-21的表达,但T47D细胞中miRNA-21表达仍明显高于MDA-MB-361细胞的缘故。
本研究结果显示:γ射线照射后T47D和MDA-MB-361细胞产生明显的G2/M期细胞阻滞,与多数研究[15]报道一致,且具有较强放射抗性的T47D细胞表现出较低的G2/M期细胞阻滞。放射治疗能引起肿瘤细胞DNA损伤,细胞在DNA双链断裂之后会立即启动检查点,以暂时停止细胞周期进程,主要的检查点在G1/S期和G2/M期,肿瘤细胞的放射敏感性主要与G2/M期阻滞引起的细胞周期延长有关,这也与本研究中2种乳腺癌细胞阻滞在G2/M期一致[17-19]。当转染降低miRNA-21表达后,流式细胞术结果显示:T47D细胞的G2/M期百分率由64.0%降至22.9%,明显消除了放射引发的G2/M期阻滞,而凋亡峰subG1期细胞却明显增加。ANASTASOV等[20]研究表明:不可逆的G2 /M期阻滞导致了乳腺癌细胞的放射抵抗,提示miRNA-21通过介导G2 /M期阻滞调节乳腺癌细胞的放射抗性。本研究中,由于5.0 Gyγ射线照射anti-miRNA-21组MDA-MB-361细胞存活率低至(6.2±3.1)%,与照射前比较,MDA-MB-361的细胞周期分布差异无统计学意义,故仅报道了T47D细胞的周期分布结果。
本研究明确了miRNA-21在人乳腺癌细胞中的放射敏感性中的调节作用,其机制与抑制细胞周期G2/M期阻滞有关。本研究结果为乳腺癌的临床靶向治疗提供了实验依据。
| [1] | 惠周光, 张烨, 张江鹄, 等. 2010年与2004年中国大陆地区乳腺癌改良根治术后放疗现状比较[J]. 中华放射肿瘤学杂志, 2012, 21(4): 352–356. DOI:10.3760/cma.j.issn.1004-4221.2012.04.018 |
| [2] | CROKER A K, ALLAN A L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells[J]. Breast Cancer Res Treat, 2012, 133(1): 75–87. |
| [3] | KUMAR S, KEERTHANA R, PAZHANIMUTHU A, et al. Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J]. Indian J Biochem Biophys, 2013, 50(3): 210–214. |
| [4] | ZHANG H L, YANG L F, ZHU Y, et al. Serum miRNA-21:Elevated levels in patients with metastatic hormone-refractory prostate cancer and potential predictive factor for the efficacy of docetaxel-based chemotherapy[J]. Prostate, 2011, 71(3): 326–331. DOI:10.1002/pros.v71.3 |
| [5] | COTE G A, GORE A J, MCELYEA S D, et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile[J]. Am J Gastroenterol, 2014, 109(12): 1942–1952. DOI:10.1038/ajg.2014.331 |
| [6] | BARANWAL S, ALAHARI S K. miRNA control of tumor cell invasion and metastasis[J]. Int J Cancer, 2010, 126(6): 1283–1290. |
| [7] | WANG X C, WANG W, ZHANG Z B, et al. Overexpression of miRNA-21 promotes radiation-resistance of non-small cell lung cancer[J]. Radiat Oncol, 2013, 8: 146. DOI:10.1186/1748-717X-8-146 |
| [8] | WONG S T, ZHANG X Q, ZHUANG J T, et al. MicroRNA-21 inhibition enhances in vitro chemosensitivity of temozolomide-resistant glioblastoma cells[J]. Anticancer Res, 2012, 32(7): 2835–2841. |
| [9] | KUMARSWAMY R, VOLKMANN I, THUM T. Regulation and function of miRNA-21 in health and disease[J]. RNA Biol, 2011, 8(5): 706–713. DOI:10.4161/rna.8.5.16154 |
| [10] | 钟莉莉, 赵银龙, 李炳锦, 等. MicroRNA-210对卵巢癌细胞生长及放射敏感性的影响[J]. 吉林大学学报:医学版, 2018, 44(2): 265–269. |
| [11] | MARTIN S L, KALA R, TOLLEFSBOL T O. Mechanisms for the inhibition of colon cancer cells by sulforaphane through epigenetic modulation of MicroRNA-21 and human telomerase reverse transcriptase (hTERT) down-regulation[J]. Curr Cancer Drug Targets, 2018, 18(1): 97–106. |
| [12] | KUMAR S, KEERTHANA R, PAZHANIMUTHU A, et al. Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J]. Indian J Biochem Biophys, 2013, 50(3): 210–214. |
| [13] | SHENOUDA S K, ALAHARI S K. MicroRNA function in cancer:oncogene or a tumor suppressor?[J]. Cancer Metastasis Rev, 2009, 28(3/4): 369–378. |
| [14] | WANG Z X, LU B B, WANG H, et al. MicroRNA-21 modulates chemosensitivity of breast cancer cells to doxorubicin by targeting PTEN[J]. Arch Med Res, 2011, 42(4): 281–290. DOI:10.1016/j.arcmed.2011.06.008 |
| [15] | 狄英波, 孙颖, 张桂英, 等. MicroRNA-21与乳腺癌细胞MDA-MB-231放射敏感性之间关系的研究[J]. 中国妇幼保健, 2012, 27(34): 5571–5573. |
| [16] | GABRIELY G, WURDINGER T, KESARI S, et al. MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators[J]. Mol Cell Biol, 2008, 28(17): 5369–5380. DOI:10.1128/MCB.00479-08 |
| [17] | CARLETTI M Z, FIEDLER S D, CHRISTENSON L K. MicroRNA 21 blocks apoptosis in mouse periovulatory granulosa cells[J]. Biol Reprod, 2010, 83(2): 286–295. DOI:10.1095/biolreprod.109.081448 |
| [18] | ZHANG L, KANG W Q, LU X L, et al. LncRNA CASC11 promoted gastric cancer cell proliferation, migration and invasion in vitro by regulating cell cycle pathway[J]. Cell Cycle, 2018, 17(15): 1886–1900. DOI:10.1080/15384101.2018.1502574 |
| [19] | ZHANG W F, XIONG Y W, ZHU T T, et al. MicroRNA let-7g inhibited hypoxia-induced proliferation of PASMCs via G0/G1 cell cycle arrest by targeting c-myc[J]. Life Sci, 2017, 170: 9–15. DOI:10.1016/j.lfs.2016.11.020 |
| [20] | ANASTASOV N, HÖFIG I, VASCONCELLOS I G, et al. Radiation resistance due to high expression of miR-21 and G2/M checkpoint arrest in breast cancer cells[J]. Radiat Oncol, 2012, 7: 206. DOI:10.1186/1748-717X-7-206 |
 2019, Vol. 45
2019, Vol. 45


