扩展功能
文章信息
- 梁春梅, 许旭三, 余华军, 周霞, 温霞, 李友, KOJIC Snezana, 汪亚君, 马国达
- LIANG Chunmei, XU Xusan, YU Huajun, ZHOU Xia, WEN Xia, LI You, KOJIC Snezana, WANG Yajun, MA Guoda
- 含心脏阿霉素反应蛋白基因的重组慢病毒过表达和RNA干扰载体的构建及鉴定
- Construction and identification of recombinant lentivirus overexpression and RNA interference vector containing cardiac adriamycin reactive protein gene
- 吉林大学学报(医学版), 2019, 45(04): 766-771
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 766-771
- 10.13481/j.1671-587x.20190404
-
文章历史
- 收稿日期: 2018-09-25
2. 广东医科大学实验动物中心, 广东 湛江 524023;
3. 塞尔维亚贝尔格莱德大学分子遗传学及遗传工程研究所, 塞尔维亚 贝尔格莱德 11010;
4. 广东医科大学附属医院临床医学研究中心, 广东 湛江 524001;
5. 黑龙江八一农垦大学生命科学与技术学院, 黑龙江 大庆 163319
2. Experiment Animal Center, Guangdong Medical University, Zhanjiang 524023, China;
3. Institute of Molecular Genetics and Genetic Engineering, University of Belgrade, Belgrade 11010, Serbia;
4. Clinical Research Center, Affiliated Hospital, Guangdong Medical University, Zhanjiang 524001, China;
5. College of Life Science & Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, China
心脏阿霉素反应蛋白(cardiac adriamycin responsive protein, CARP)是1997年JEYASEELAN等[1]在心肌细胞中鉴定出的一种能被阿霉素(adriamycin,ADR)迅速抑制的蛋白,因其在心脏中特异表达而得名。CARP基因编码319个氨基酸,具有与蛋白质-蛋白质相互作用相关的锚定重复序列、核定位信号以及与蛋白快速降解相关的PEST序列,与结构类似的具有PEST结构并富含脯氨酸的锚定重复序列蛋白(ARPP/Ankrd2)和糖尿病相关锚定重复序列蛋白(DARP)组成肌肉锚定重复序列蛋白(MARP)家族[2]。由于该蛋白具有锚定重复序列结构域,也被称为心肌锚定重复序列蛋白(cardiac ankyrin repeat protein,CARP),有的文献[3]也称其为Ankrd1。
CARP主要定位于心肌细胞肌节和细胞核,并在两者之间穿梭发挥作用。CARP同时具有结构蛋白、信号分子和转录调节因子的多重功能,在维持心肌结构和功能、感受并传递外界信号、转录调控、心脏发育和相关疾病的发展过程中发挥重要的作用[2-4]。研究[5-9]表明:CARP作为应激反应蛋白,具有拮抗细胞凋亡、调节炎症反应以及抑制心肌纤维化等作用。然而,CARP在ADR造成的心脏毒性中的作用及其分子机制尚不清楚。
本研究采用AdMax慢病毒包装系统,构建大鼠CARP基因过表达及RNA干扰载体,并包装高滴度的慢病毒,以期为研究CARP在ADR诱导的心肌损伤中的作用及机制提供一种方便而有效的工具。
1 材料与方法 1.1 细胞、主要试剂和仪器大肠杆菌菌株DH5α感受态细胞购自广州鼎国生物技术有限公司,HEK293T细胞系和H9C2细胞系购自中国科学院上海细胞库。慢病毒载体(GV358和GV248)和辅助质粒(Helper 1.0和Helper 2.0)购自上海吉凯基因化学技术有限公司,DMEM培养基、胎牛血清和胰酶购于美国Gibco公司,Lipofectamin 2000转染试剂购于美国Invitrogen公司,质粒提取试剂盒和胶回收纯化试剂盒购于天根生化科技(北京)有限公司,Age Ⅰ限制性内切酶、Taq酶和T4DNA连接酶购于日本TaKaRa公司,CARP和β-actin抗体购自美国Santa Cruz公司。MasterCycler Gradient PCR仪购自德国Eppendorf公司,电泳仪和水平电泳槽购自美国Bio-Rad公司,EVOS FL Auto全自动荧光倒置显微镜购自美国Life Technologies公司。
1.2 细胞培养HEK293T细胞和H9C2细胞培养于含10% FBS+1%双抗的高糖DMEM培养基中,并置于37℃、5% CO2恒温培养箱中。
1.3 过表达载体CARP-GV358构建和鉴定利用NCBI GenBank检索大鼠CARP基因mRNA的全长序列(NM_013220),设计获取目的基因片段的引物并在两端添加Age Ⅰ酶切位点(表 1)。连接含有Age Ⅰ酶切位点的目的片段和GV358载体,构建重组载体CARP-GV358。PCR鉴定,并对阳性克隆行测序验证。
| Primer | Sequence(5′-3′) |
| Acquisition of target gene | |
| F | GAGGATCCCCGGGTACCGGTCGCCACCATGATGGTTTTTCGAGTAGAGGAGC |
| R | TCCTTGTAGTCCATACCGGTGAACGTAGCTATGCGCGAGTTTTTG |
| Identification of CARP overexpression vector | |
| OE-F | GGGTCAATATGTAATTTTCAGTG |
| OE-R | CCTTATAGTCCTTATCATCGTC |
| Construction of vector for CARP interference | |
| sh-F | CCGGAAACTGCCAGTTGTAGAGAAACTCGAGTTTCTCTACAACTGGCAGTTTTTTTTG |
| sh-R | AATTCAAAAAAAACTGCCAGTTGTAGAGAAACTCGAGTTTCTCTACAACTGGCAGTTT |
根据siRNA的设计原则,使用美国Ambion公司的在线软件(http://www.ambion.com/techlib/misc/siRNAfinder.html),在CARP开放阅读框区域选择5′-AAACTGCCAGTTGTAGAGAAA-3′作为干涉靶序列,并通过BLAST同源性比较。设计发夹结构siRNA的正义链和反义链,每条寡核苷酸链包括:2个反向互补排列的19 nt特异性序列,两端的Age Ⅰ和EcoRⅠ酶切位点,RNA聚合酶Ⅲ转录终止信号TTTTTG以及1个6 nt茎环结构间区。引物序列见表 1。
将单链寡核苷酸退火形成双链DNA。采用Age Ⅰ酶切载体GV248,并与退火后的双链DNA产物用T4 DNA连接酶连接后转化DH5α感受态细菌,在氨苄青霉素抗性的LB平板上培养过夜,然后提取质粒测序鉴定。
1.5 重组慢病毒的包装、浓缩和滴度测定将处于对数生长期的HEK293T细胞接种于直径10 cm培养皿中,待细胞汇合率达到40%~50%时,通过Lipofectamin 2000将构建的穿梭质粒和辅助质粒转染HEK293T细胞,转染后观察细胞荧光情况,待HEK293T细胞全部出现绿色荧光,收集细胞,离心取上清,并冻存于-80℃保存备用。将重组慢病毒按照10倍倍比稀释后感染HEK293T细胞,3~5 d后观察荧光表达情况,计算病毒滴度。病毒滴度=GFP阳性细胞数×病毒稀释倍数/0.01 mL。
1.6 重组慢病毒感染H9C2细胞和CARP蛋白表达水平检测培养H9C2细胞完全贴壁并融合至80%~90%时,分为对照组、Scramble RNA组、CARP过表达组和shRNA CARP组,分别加入不同的慢病毒感染细胞,继续培养48 h后用荧光显微镜照相鉴定,Western blotting法检测各组细胞中CARP蛋白表达水平。具体步骤参照文献[10]操作,利用Image-Pro Plus软件进行蛋白灰度值分析,计算目的蛋白表达水平。
1.7 统计学分析采用GraphPad Prism 5.0统计软件进行统计学分析。CARP蛋白表达水平以x±s表示,采用Kolmogorov-Smirnov法进行正态性检验,P>0.1代表呈正态分布,组间比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 CARP-GV358载体的鉴定经Age Ⅰ酶切的CARP基因序列与GV358载体进行同源重组,得到CARP-GV358重组质粒。该质粒经PCR鉴定,电泳后可见1155bp的PCR产物片段(图 1)。提取重组质粒送华大基因测序,并与已知大鼠的CARP基因序列进行比对,结果显示:载体插入序列与已知序列完全吻合。
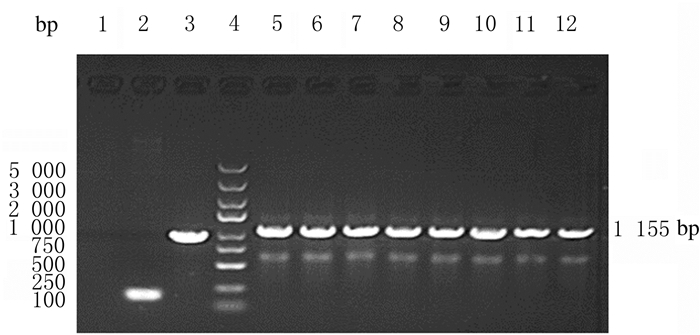
|
| Lane 1:Negative control(ddH2O); Lane 2:Negative control(self-connected control group); Lane 3:Positive control(GAPDH); Lane 4:Marker; Lane 5-12:Transformants. 图 1 琼脂糖凝胶电泳鉴定CARP过表达载体 Fig. 1 Identification of CARP overexpression vector by agarose gel electrophoresis |
|
|
将构建的CARP-GV358质粒转染到HEK293T细胞,并在荧光显微镜下观察表达情况。转染CARP-GV358质粒后,HEK293T细胞能检测到绿色荧光,见图 2(插页二),说明CARP-GV358质粒构建成功并在细胞中表达。

|
| A: Before transfection; B:After transfection. 图 2 荧光显微镜下鉴定CARP-GV358质粒(×100) Fig. 2 Identification of CARP-GV358 plasmid under fluorescence microscope (×100) |
|
|
将人工合成带有Age Ⅰ和EcoR Ⅰ酶识别序列的干扰片段与Age Ⅰ和EcoRⅠ酶切后线性化GV248载体退火重组,得到shCARP-GV248重组载体。随机挑选转化子送测序,shCARP-GV248阳性重组载体测序结果见图 3(插页二),可见CARP干扰序列已正确插入,无基因突变。
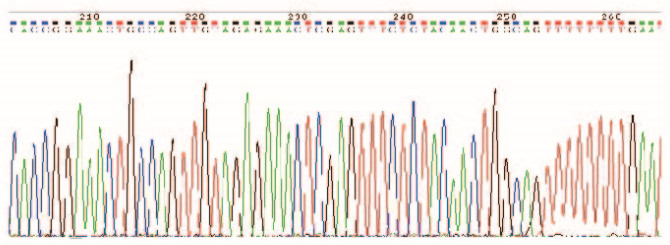
|
| 图 3 CARP siRNA表达载体插入序列的鉴定 Fig. 3 Identification of insertion squence of CARP siRNA expression vector |
|
|
收集的病毒液经过超速离心后,经终点稀释法测定,CARP过表达和RNA干扰(RNAi)病毒滴度分别为2×108和2×109 PFU· mL-1。
2.5 CARP过表达和RNAi慢病毒感染H9C2细胞表达的鉴定CARP过表达和RNAi慢病毒感染H9C2细胞后,收集细胞总蛋白。Western blotting法检测结果显示:与对照组比较,CARP过表达组细胞中CARP蛋白表达水平升高5.3倍(P=0.01),shRNA CARP组细胞中CARP蛋白表达水平降低53%(P=0.02)。见图 4。过表达的CARP蛋白出现2条条带,是因为GV358过表达慢病毒载体在插入CARP基因的多克隆位点后面添加了3XFlag的标签蛋白,该蛋白能与CARP蛋白共同表达,形成融合蛋白。
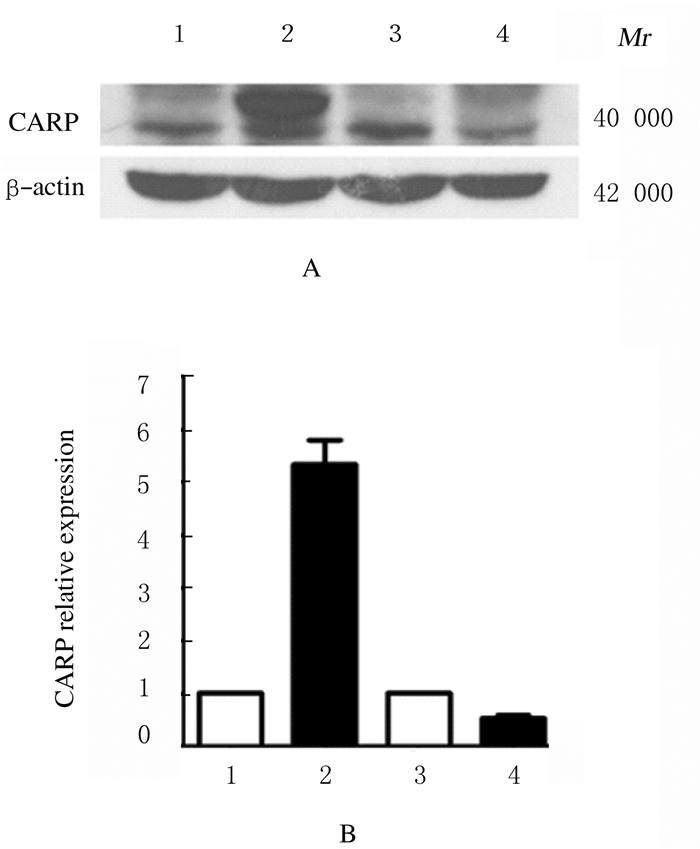
|
|
Lane 1: Control group; Lane 2: CARP group; Lane 3:Scramble RNA group; Lane 4: shRNA CARP group. 1:Control group; 2:CARP group; 3:Scramble RNA group; 4:shRNA CARP group. 图 4 Western blotting法检测各组H9C2细胞中CARP蛋白表达电泳图(A)和CARP蛋白表达水平(B) Fig. 4 Electrophoregram of CARP expressions(A) and CARP expression levels(B) in H9C2 cells in various groups detect by Western blotting method |
|
|
近年来我国肿瘤总发病率和死亡率呈现升高趋势,2015年我国新增429.2万肿瘤病例,281.4万人死于肿瘤,肿瘤的治疗已成为一项重大的公共卫生和经济问题[11]。ADR因价格便宜,疗效确切成为临床不可替代的广谱抗肿瘤药物。但ADR与心肌的高亲和力会导致心脏毒性,严重限制了ADR的临床应用[12-13]。
减少ADR心肌毒性的常用方法是使用心脏保护药物,但在药理和临床上试图开发减少ADR心肌毒性的药物却收效甚微。迄今为止,仅有右雷佐生用于减轻ADR心肌损伤的药物被美国食品药品管理局(FDA)批准,但可造成ADR抗肿瘤疗效降低和中性粒细胞减少[14]。因此,进一步阐明ADR心肌毒性的发生机制,发现阻断ADR心肌毒性的分子靶点,对于开发安全有效的预防ADR心肌毒性药物有重要意义。
CARP作为在心脏特异表达的信号分子,通过转录调控功能使心肌细胞对外界应激信号产生迅速反应,进而维持心肌细胞稳态。CARP的功能主要体现在3个方面:①维护心肌细胞结构。作为结构蛋白定位在横纹肌肌节的Ⅰ带,与Titin、Myopalladin和Calpain 3/p94等相互作用形成四聚体复合物,该复合物对于保持正常的心肌结构的稳定性和心脏的收缩功能至关重要,同时也可能介导了外界信号向心肌细胞内部的传递[15]。②传递细胞信号。多种细胞应激、细胞因子、激素和生长因子等信号都可通过CARP将信息传递到细胞核[16]。③调控基因表达。在细胞核内CARP作为转录辅助因子与Y-box结合蛋白1(Y box binding protein 1, YB-1)等转录因子形成复合物,影响肌球蛋白轻链2v(myosin light chain 2 ventricular gene,MLC-2v)、心房利钠肽(atrial natriuretic peptide,ANP)、脑钠素(brain natriuretic peptide,BNP)和心肌肌钙蛋白C(cardiac troponin C,cTnC)等基因的表达,使心肌细胞对各种信号做出迅速反应[17]。
从分子水平来讲,ADR心肌毒性过程包括3个环节:首先出现ADR的应激信号,继而细胞内信号转导以及核内基因转录活化,最终诱发ADR心肌毒性表型出现[18-19]。CARP作为心肌特异的ADR调控的靶基因及信号分子[1, 20],研究CARP在ADR诱导的心肌损伤中的作用及分子机制助于开发有效的心肌保护药物。在心肌细胞中筛选并鉴定ADR处理条件下,CARP调控的靶基因,对于解析CARP在ADR诱导的心肌损伤的分子机制至关重要。本课题组正在进行的研究表明:CARP在ADR心肌病的发生发展过程中起到一定的作用,可能成为ADR诱导的心肌损伤治疗的潜在作用靶点。
本研究利用慢病毒载体包装系统成功构建了慢病毒介导的CARP过表达和RNAi载体,为干预CARP表达提供了有效手段,并在大鼠心肌细胞H9C2中成功表达,从而为进一步研究CARP在阿霉素心肌病中的作用奠定了实验基础。
| [1] | JEYASEELAN R, POIZAT C, BAKER RK, et al. A novel cardiac-restricted target for doxorubicin. CARP, a nuclear modulator of gene expression in cardiac progenitor cells and cardiomyocytes[J]. J Biol Chem, 1997, 272(36): 22800–22808. DOI:10.1074/jbc.272.36.22800 |
| [2] | KOJIC S, RADOJKOVIC D, FAULKNER G. Muscle ankyrin repeat proteins:their role in striated muscle function in health and disease[J]. Crit Rev Clin Lab Sci, 2011, 48(5/6): 269–294. |
| [3] | 马国达, 肖兴军. 心肌锚定重复序列蛋白CARP的研究进展[J]. 生命科学, 2009, 21(3): 377–382. |
| [4] | LING SSM, CHEN YT, WANG J, et al. Ankyrin repeat domain 1 protein:A functionally pleiotropic protein with cardiac biomarker potential[J]. Int J Mol Sci, 2017, 18(7): E1362. DOI:10.3390/ijms18071362 |
| [5] | 许家林.心肌铆定重复序列蛋白(CARP)对心肌肥厚保护功能与分子机制[D].北京: 北京协和医学院, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10023-1012447729.htm |
| [6] | HAN XJ, CHAE JK, LEE MJ, et al. Involvement of GADD153 and cardiac ankyrin repeat protein in hypoxia-induced apoptosis of H9c2 cells[J]. J Biol Chem, 2005, 280(24): 23122–23129. DOI:10.1074/jbc.M501095200 |
| [7] | LEE MJ, KWAK YK, YOU KR, et al. Involvement of GADD153 and cardiac ankyrin repeat protein in cardiac ischemia-reperfusion injury[J]. Exp Mol Med, 2009, 41(4): 243–252. DOI:10.3858/emm.2009.41.4.027 |
| [8] | SONG Y, XU JL, LI YF, et al. Cardiac ankyrin repeat protein attenuates cardiac hypertrophy by inhibition of ERK1/2 and TGF-β signaling pathways[J]. PLoS One, 2012, 7(12): e50436. DOI:10.1371/journal.pone.0050436 |
| [9] | ZHANG N, YE F M, ZHU W, et al. Cardiac ankyrin repeat protein attenuates cardiomyocyte apoptosis by upregulation of Bcl-2 expression[J]. Biochim Biophys Acta, 2016, 1863(12): 3040–3049. DOI:10.1016/j.bbamcr.2016.09.024 |
| [10] | 马国达, 崔玉东, 翁凡, 等. CARP抗体制备及表达模式分析[J]. 细胞与分子免疫学杂志, 2009, 25(6): 507–509, 512. DOI:10.3321/j.issn:1007-8738.2009.06.010 |
| [11] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [12] | RUGGERI C, GIOFFRÉ S, ACHILLI F, et al. Role of microRNAs in doxorubicin-induced cardiotoxicity:An overview of preclinical models and cancer patients[J]. Heart Fail Rev, 2018, 23(1): 109–122. DOI:10.1007/s10741-017-9653-0 |
| [13] | RENU K, V G A, P B T P, et al. Molecular mechanism of doxorubicin-induced cardiomyopathy-An update[J]. Eur J Pharmacol, 2018, 818: 241–253. DOI:10.1016/j.ejphar.2017.10.043 |
| [14] | WU V. Dexrazoxane:a cardioprotectant for pediatric cancer patients receiving anthracyclines[J]. J Pediatr Oncol Nurs, 2015, 32(3): 178–184. DOI:10.1177/1043454214554008 |
| [15] | MILLER M K, BANG M L, WITT C C, et al. The muscle ankyrin repeat proteins:CARP, ankrd2/Arpp and DARP as a family of titin filament-based stress response molecules[J]. J Mol Biol, 2003, 333(5): 951–964. DOI:10.1016/j.jmb.2003.09.012 |
| [16] | LANGE S, GEHMLICH K, LUN A S, et al. MLP and CARP are linked to chronic PKCα signalling in dilated cardiomyopathy[J]. Nat Commun, 2016, 7: 12120. DOI:10.1038/ncomms12120 |
| [17] | ZOU Y, EVANS S, CHEN J, et al. CARP, a cardiac ankyrin repeat protein, is downstream in the Nkx2-5 homeobox gene pathway[J]. Development, 1997, 124(4): 793–804. |
| [18] | ROCHETTE L, GUENANCIA C, GUDJONCIK A, et al. Anthracyclines/trastuzumab:new aspects of cardiotoxicity and molecular mechanisms[J]. Trends Pharmacol Sci, 2015, 36(6): 326–348. DOI:10.1016/j.tips.2015.03.005 |
| [19] | SAWYER D B, PENG X Y, CHEN B, et al. Mechanisms of anthracycline cardiac injury:can we dentify strategies for cardioprotection?[J]. Prog Cardiovasc Dis, 2010, 53(2): 105–113. |
| [20] | CHEN B, ZHONG L, ROUSH S F, et al. Disruption of a GATA4/Ankrd1 signaling axis in cardiomyocytes leads to sarcomere disarray:implications for anthracycline cardiomyopathy[J]. PLoS One, 2012, 7(4): e35743. DOI:10.1371/journal.pone.0035743 |
 2019, Vol. 45
2019, Vol. 45


