扩展功能
文章信息
- 霍小蕾, 裴振, 杨浩, 张毅强, 贾建桃, 韩玲娜
- HUO Xiaolei, PEI Zhen, YANG Hao, ZHANG Yiqiang, JIA Jiantao, HAN Lingna
- LncRNA-BLACAT1调节CyclinD1/CDKN2B轴对非小细胞肺癌细胞增殖的影响及其机制
- Effect of LncRNA-BLACAT1 on cell proliferation of non-small cell lung cancer through regulation of CyclinD1/CDKN2B axis and its mechanism
- 吉林大学学报(医学版), 2019, 45(04): 759-765
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 759-765
- 10.13481/j.1671-587x.20190403
-
文章历史
- 收稿日期: 2018-10-26
2. 长治医学院生理学教研室, 山西 长治 046000;
3. 长治医学院附属和平医院肿瘤科, 山西 长治 046000;
4. 长治医学院生物化学教研室, 山西 长治 046000;
5. 长治医学院病理生理学教研室, 山西 长治 046000
2. Department of Physiology, Changzhi Medical College, Changzhi 046000, China;
3. Department of Oncology, Affiliated Heping Hospital, Changzhi Medical College, Changzhi 046000, China;
4. Department of Biochemistry, Changzhi Medical College, Changzhi 046000, China;
5. Department of Pathophysiology, Changzhi Medical College, Changzhi 046000, China
非小细胞肺癌(non-small cell lung cancer,NSCLC)是全世界范围内发病率和死亡率较高的胸部恶性肿瘤之一[1-2]。尽管目前NSCLC的疗效得到了极大的改善,但NSCLC患者的5年生存率仍不足20%[3]。因此,寻找新的NSCLC治疗靶点是NSCLC治疗的重要策略之一。
长链非编码RNA(long non-coding RNA, LncRNA)是近年来报道的一类新的肿瘤标志物和分子靶点[4-5]。膀胱癌相关转录因子1(bladder cancer associated transcript-1,BLACAT1)是近年来被报道的LncRNAs分子[6],与多种肿瘤的发生发展有关联[7-11]。在结直肠癌(colorectal cancer, CRC)中,BLACAT1可转录调节细胞周期重要节点分子p15的表达,促进CRC细胞的周期进程,从而导致CRC细胞的恶性增殖[7];在宫颈癌中,BLACAT1可通过激活Wnt信号转导通路,促进上皮细胞间质转化(epithelial-mesenchymal transition, EMT)的关键分子β-连环蛋白(β-catenin)和基质金属蛋白酶7(MMP-7)的表达,从而导致宫颈癌细胞侵袭和转移[10]。然而,BLACAT1在NSCLC中的研究鲜有报道。本研究通过生物信息学分析、临床样本检测和分子功能学实验检测,探讨BLACAT1与NSCLC患者临床和病理特征的关系以及分子功能,为BLCACT1在NSCLC治疗中的潜在应用提供理论基础。
1 材料与方法 1.1 主要试剂LipofectAMINE 2000购于美国Invitrogen公司,Trizol试剂和逆转录试剂盒(miScriptⅡRT Kit)购于德国QIAGEN公司,逆转录试剂盒(Reverse transcription system)购于美国Promega公司,siRNA片段购于广州瑞博生物有限公司,细胞周期与细胞凋亡检测试剂盒(Cell Cycle and Apoptosis Analysis Kit)购于碧云天生物科技公司,细胞浆/核RNA抽提试剂盒购于美国Ambion生物公司,细胞周期蛋白D1(CyclinD1)、细胞周期蛋白依赖性激酶抑制剂2B(CDKN2B)和GAPDH抗体购于上海优宁维公司。
1.2 一般资料收集2014年12月—2016年1月长治医学院附属和平医院住院NSCLC患者25例,均行手术切除,且均经病理证实为NSCLC。患者年龄35~75岁,平均年龄(55.23±3.45)岁。所有患者满足以下要求:术前未接受生物治疗或者放化疗,未并发其他肿瘤等,并且可收集患者完整检查、治疗和手术资料。标本先置于液氮罐中10 min,然后取出于-80℃条件下保存。
GSE19804和GSE18842数据集是在高通量基因表达数据库(Gene Expression Omnibus, GEO)公共数据库平台下载的关于NSCLC数据集(http://www.ncbi.nlm.nih.gov/gds/),分析平台为GPL570,BLACAT1在GPL570平台中对应的探针号为232105_ at。GSE19804包含60例NSCLC患者的癌组织和癌旁组织;GSE18842包含45名正常人肺组织和46例NSCLC患者癌组织。而Kmplot网站(http://kmplot.com/analysis/index.php?p=service&cancer=lung)包括了1145例NSCLC患者临床预后资料。
1.3 细胞系本研究中人NSCLC细胞系A549、NCI-H266、NCI-H1299和人正常支气管上皮细胞系HBE均购于中国科学院上海生命科学研究院细胞资源中心。A549、NCI-H266、H1299和HBE细胞均在含10%胎牛血清(FBS)和1%双抗的RPMI1640培养基中培养。
1.4 细胞转染将对数生长期的A549细胞接种于细胞培养板中,用5μmol·L-1阴性对照(si-NC)和干扰试剂(si-BLACAT1-1、si-BLACAT1-2)与转染试剂lip3000组合转染。siRNA片段的序列:si-BLACAT1-1,5′-AGGCUGGUUUCUGCCCUCAUCCUUU-3′;si-BLACAT1-2,5′- GCCCAGCUUCUAGUCCUCUCCUUAU-3′;si-NC,siN05815122147。转染后的细胞分别为si-NC组(转染si-NC)、si-BLACAT1-1组(转染si-BLACAT1-1)、si-BLACAT1-2组(转染si-BLACAT1-2)和si-BLACAT1-1+2组(转染si-BLACAT1-1和si-BLACAT1-2)。采用实时荧光定量PCR(qRT-PCR)法检测各组细胞中BLACAT1mRNA表达水平,判断BLACAT1 siRNA在A549细胞中的抑制效率,选择抑制效率最高的干扰试剂转染组作为后续实验的si-BLACAT1组。
1.5 qRT-PCR法检测采用TRIzol法提取各组细胞的总RNA,逆转录得到cDNA,进行qRT- PCR检测。引物序列如下:LncRNA-BLACAT1,F5′-GTCTCTGCCCTTTTGAGCCT -3′,R 5′-GTGGCTGCAGTGTCATACCT-3′;CyclinD1,F 5′-TCGTTGCCCTCTGTGCCACA-3′,R 5′-GCAGTCCGGGTCACACTTGA-3′;CDKN2B,F 5′-CTATGTTTGAATAATTCCAG-3′,R 5′-CGCGTCGCCGCGUUAAGAAC-3′;U6(细胞核内参),F 5′-CTCGCTTCGGCAGCACA -3′,R 5′-AACGCTTCACGAATTTGCGT-3′;18S(细胞质内参),F 5′-GTGGGCCGAAGATATGCTCA -3′,R 5′-TTGGCTAGGACCTGGCTGTA-3′;GAPDH (细胞质内参),F 5′-TGCACCACCAACTGCTTAGC-3′,R 5′-GGCATGGACTGTGGTCATGAG-3′。根据GenBank序列,用Primer Premier 5.0和Oligo 6.22软件设计引物,由华大基因生物科技有限公司合成。PCR反应条件:95℃、5 min;95℃、30s,60℃、30s,72℃、30s,40个循环。读取目的基因及内参的循环阈值(Ct值),并计算目的基因与内参的Ct值差值(ΔCt),以2-ΔΔCt值代表目的基因mRNA相对表达水平。
1.6 流式细胞术检测不同细胞周期细胞百分率收集各组细胞,采用70%的冷乙醇固定,4℃过夜。用碘化丙啶(0.05 g·L-1)和RNA酶(2 g·L-1)常温下染色30 min,行流式细胞仪检测和分析细胞周期,采用Cell Lab Quanta SC软件计算不同细胞周期细胞百分率。
1.7 细胞集落形成实验检测集落形成能力将各组细胞按1 000个/孔分别接种于6孔板中,培养约15 d后,肉眼可见细胞集落时,终止培养。PBS缓冲液清洗数次后,4%多聚甲醛固定30 min,再用1%结晶紫染液染色10 min,晾干,拍照。统计各组细胞集落形成数代表细胞集落形成能力。每组设置3个复孔。
1.8 CCK8实验检测细胞增殖活性实验在96孔细胞培养板中进行,各板加入100 μL混合培养液(90 μL联合培养基+10 μL CCK8溶液),37℃孵育2 h,用光吸收酶标仪(SpectraMax 190)测定450 nm处各组细胞的吸光度(A)值,以A值代表细胞增殖活性。每组设置5个复孔。
1.9 细胞核/质RNA分离和检测收集A549细胞约2×106个,分为2份,分别用于抽提总RNA和抽提核/质RNA。总RNA的抽提采用TRIzol法,细胞浆/核RNA的抽提步骤参考胞浆/核RNA抽提试剂盒说明书。将qRT-PCR法测得的细胞核RNA样本中lncRNA BLACAT1、U6、GAPDH、18S基因表达水平减去各基因在总RNA样本中的表达水平,得到ΔCt,然后计算2-△Ct,最后进行Log10(2-△Ct)转换即得到最终的表达水平[12]。当BLACAT1表达水平大于0时, 即表示该分子主要分布在细胞核中;反之,当BLACAT1表达水平小于0时,在横坐标下方,即表示该分子主要分布在细胞浆中。
1.10 Western blotting法检测细胞中Cyclin D1和CDKN2B蛋白表达水平将RIPA裂解液加入烧瓶或6孔板中并在冰上裂解(大于30 min),收集蛋白裂解液。将50 μg蛋白质(根据蛋白质浓度转化)加入10%SDS-PAGE中进行电泳分离,电泳条件为积层胶80 V、40 min,分离胶120 V、90 min,在100 V的条件下湿转膜90 min,室温封闭1 h,一抗4℃孵育过夜(Cyclin D1和CDKN2B一抗的稀释比例为1:500,GAPDH一抗的稀释比例为1:1000),洗膜,二抗37℃孵育1h,洗膜,显影。用Scion Image软件分析各组细胞中Cyclin D1、CDKN2B和GAPDH相应蛋白条带的灰度值,计算各组细胞中Cyclin D1/GAPDH和CDKN2B/GAPDH灰度值比值,代表Cyclin D1和CDKN2B蛋白表达水平。
1.11 统计学分析采用SPSS18.0统计软件进行统计学分析。公共数据库分析结果,NSCLC组织和NSCLC细胞系中BLACAT1 mRNA表达水平,各组A549细胞不同周期细胞百分率、集落形成能力和细胞增殖活性,各组A549细胞中BLACAT1、CyclinD1、CDKN2B mRNA和蛋白表达水平,均以x±s表示。组间两两比较采用t检验。检验水准为α=0.05。
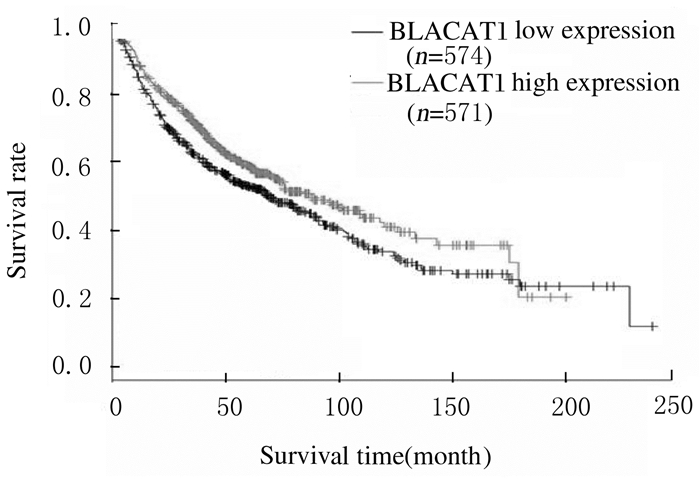
2 结果 2.1 NSCLC公共数据库中BLACAT1mRNA表达水平提取GEO中的NSCLC样本信息,分析BLACAT1在NSCLC样本中的表达差异,结果显示:在GSE19804和GSE18842数据集中,癌组织中BLACAT1 mRNA表达水平明显高于癌旁组织(P<0.01)(表 1)。此外,Kmplot网站分析结果也显示:NSCLC患者中,BLACAT1低表达的患者生存时间较长[HR=0.81(0.68~0.95), P= 0.011]。见图 1。
| (x±s) | |||
| Data set | Tissue | n | BLACAT1 |
| GSE19804 | Paracarcinoma | 60 | 4.982±0.550 |
| Tumor | 60 | 6.260±0.851* | |
| GSE18842 | Paracarcinoma | 45 | 3.811±0.192 |
| Tumor | 46 | 4.767±0.803* | |
| * P<0.01 compared with paracarcinoma tissue. | |||
|
| 图 1 Kmplot网站分析BLACAT1表达水平与NSCLC患者生存时间的关系 Fig. 1 Correlation between expression level of BLACAT1 and survival time of NSCLC patients analyzed by Kmplot website |
|
|
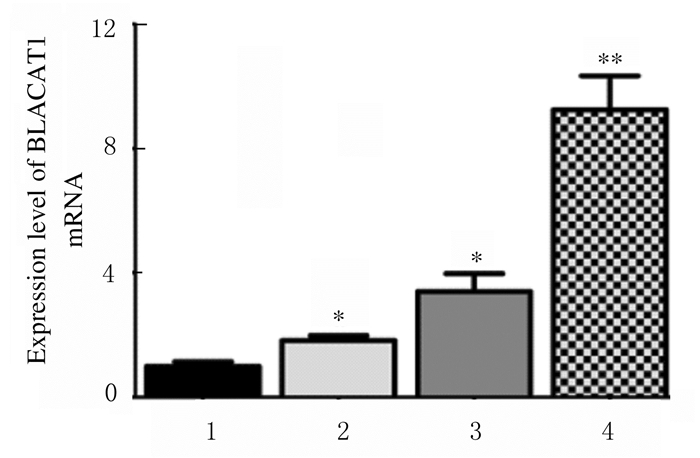
检测25例NSCLC患者癌组织和癌旁组织中BLACAT1mRNA表达水平, 结果显示:与癌旁组织(1.029±0.707)比较,NSCLC患者癌组织中BLACAT1 mRNA表达水平(1.724±1.022)明显升高(P<0.05)。NSCLC细胞系检测显示:A549、NCI-H266和NCI-H1299细胞中BLACAT1 mRNA表达水平明显高于HBE细胞(P<0.05或P<0.01)(图 2),其中A549细胞中BLACAT1 mRNA表达水平最高(P<0.01)。通过LncRNA定位分析的lncLocator网站[13](www.csbio.sjtu.edu.cn/bioinf/lncLocator.)预测BLACAT1在细胞内的分布情况,结果显示:BLACAT1主要分布于细胞浆中(表 2)。通过qRT-PCR法检测BLACAT1 mRNA在A549细胞中亚细胞定位情况,BLACAT1表达水平为-(0.94±0.13),表明其主要定位于细胞浆中。
|
| 1:HBEcells; 2:NCI-H1299 cells; 3:NCI-H266 cell; 4:A549 cells.*P<0.05, * * P<0.01 compared with HBE cells. 图 2 qRT-PCR法检测NSCLC细胞系中BLACAT1 mRNA表达水平 Fig. 2 Expression levels of BLACAT1 in NSCLC cell lines detected by qRT-PCR method |
|
|
| Subcellular localization | Score |
| Cytoplasm | 0.818 866 582 146 |
| Nucleus | 0.086 936 082 897 |
| Ribosome | 0.022 747 608 555 |
| Cytosol | 0.063 843 486 798 |
| Exosome | 0.007 606 239 602 |
与si-NC组比较,si-BLACAT1-1、si-BLACAT1-2和si-BLACAT1-1+ 2组BLACAT1mRNA表达水平均明显降低(P<0.05或P<0.01),其中si-BLACAT1-1+2组BLACAT1mRNA表达水平最低,即BLACAT1 siRNA在A459细胞中的抑制效率最高(图 3),故选择该组作为后续实验的si-BLACAT1组。

|
| 1:si-NCgroup; 2:siBLACAT1-1 group; 3:si-BLACAT1-2 group; 4:si-BLACAT1-1+2 group.*P < 0.05, * *P < 0.01 compared with si-NC group. 图 3 qRT-PCR法检测BLACAT1 siRNA在A549细胞中的表达水平 Fig. 3 Expression levels of BLACAT1 siRNA in A549 cells detected by qRT-PCR method |
|
|
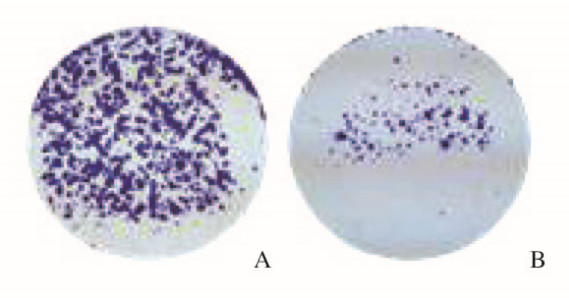
流式细胞术检测结果显示:si-NC组细胞G0/G1期细胞百分率为61.15%±1.07%,S期细胞百分率为24.28%±1.16%,与si-NC组比较,si-BLACAT1组细胞G0/ G1期细胞百分率(71.6%±0.96%)明显升高(P<0.05),S期细胞百分率(16.04%±0.92%)明显降低(P<0.05) (图 4,见插页一)。细胞集落形成实验结果显示:与si-NC组(317.00± 57.97)比较,si-BLACAT1组细胞集落形成能力(58.00±7.37)明显降低(P<0.05) (图 5,见插页一)。CCK8实验结果显示:与si-NC组(0.92±0.07)比较,si-BLACAT1组细胞增殖活性(0.67±0.08)明显降低(P<0.01)(图 6)。

|
| A:si-NC group; B:si-BLACAT1 group. 图 4 流式细胞术检测2组不同细胞周期A549细胞百分率 Fig. 4 Percentages of A549 cells in different cell cycles in two groups detected by flow cytometry |
|
|
|
| A:si-NC group; B:si-BLACAT1 group. 图 5 2组细胞集落形成实验结果 Fig. 5 Results of clone formation assay of cells in two groups |
|
|

|
| *P < 0.01 compared with si-NC group. 图 6 CCK8实验检测各组A549细胞增殖活性 Fig. 6 Proliferation activities of A549 cells in various groups detected by CCK8 assay |
|
|
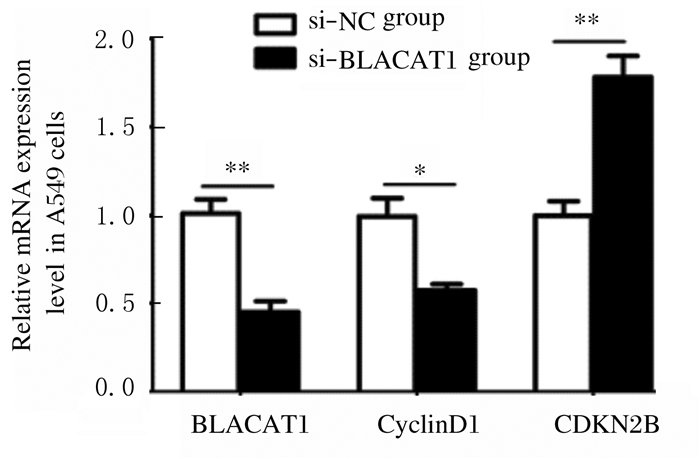
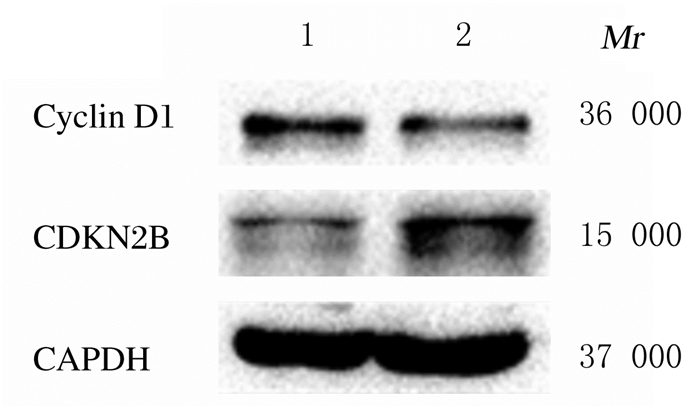
qRT-PCR法检测:与si-NC组比较,si-BLACAT1组A549细胞中BLACAT1和CyclinD1 mRNA表达水平明显降低(P<0.05或P<0.01),CDKN2B mRNA表达水平明显升高(P<0.01);Western blotting法检测:与si-NC组比较,si- BLACAT1组A549细胞中CyclinD1蛋白表达水平明显降低(P<0.05),CDKN2B蛋白表达水平明显升高(P<0.05)。见图 7、8和表 3。
|
| *P < 0.05, * *P < 0.01 compared with si-NC group. 图 7 qRT-PCR法检测各组A549细胞中BLACAT1、CyclinD1和CDKN2B mRNA表达水平 Fig. 7 Expression levels of BLACAT1, CyclinD1, and CDKN2B in A549 cells in various groups detected by qRT-PCR method |
|
|
|
| Lane 1:si-NC group; Lane 2:si-BLACAT1 group. 图 8 Western blotting法检测各组A549细胞中CyclinD1和CDKN2B蛋白表达电泳图 Fig. 8 Electrophoregram of expressions of CyclinD1 and CDKN2B proteins in A549 cells in various groups detected by Western blotting method |
|
|
| (x±s) | ||
| Group | CyclinD1 | CDKN2B |
| si-NC | 0.94±0.12 | 1.01±0.12 |
| si-BLACAT1 | 0.54±0.07* | 2.27±0.29* |
| * P<0.05 compared with si-NC group. | ||
NSCLC的发生发展是一个极其复杂的过程,涉及多个基因和多条信号通路紊乱,目前NSCLC的发病机制尚未明确。据统计,我国近年来NSCLC患者的死亡率以及新发病例数逐年升高[14]。随着分子靶向治疗在多种疾病(如神经退行性疾病、肿瘤和代谢性疾病等)中的应用,寻找灵敏度高、特异性强的有效分子治疗靶向成为治疗NSCLC的新策略。
LncRNA是一类转录本长度大于200nt、存在于真核生物细胞各个细胞器的RNAs分子[15-17],与多种疾病有关联[4]。BLACAT1是长度为2616bp的LncRNAs,位于人类染色体1q32.1的位置[18]。大量研究[11, 19]表明:BLACAT1在各种肿瘤,如乳头状甲状腺癌(papillary thyroid carcinoma,PTC)和结直肠癌(colorectal cancer, CRC)等组织中异常高表达。LIAO等[11]报道:与正常组织比较,PTC患者癌组织中BLACAT1表达水平明显升高,且其高表达与PTC患者较差的预后呈正相关关系。此外,CHEN等[19]通过生物信息学分析BLACAT1在多种肿瘤中的临床表达特征发现:BLACAT1高表达与多种肿瘤患者(结直肠癌、胃癌和乳腺癌等)的总生存时间(overall survival, OS)和无病生存时间(disease-free survival, DFS)呈正相关关系。本研究结果显示:与正常肺组织比较,NSCLC组织中BLACAT1表达水平明显上调,BLACAT1低表达NSCLC患者的存活时间明显高于BLACAT1高表达患者;同时,NSCLC细胞系A549、NCI-H266和NCI-H1299细胞中BLACAT1表达水平也高于支气管正常上皮细胞系HBE细胞。本研究结果表明:NSCLC患者癌组织中BLACAT1表达水平明显上调,其有可能成为NSCLC的标志物。
BLACAT1在肿瘤组织中高表达,并且其高表达往往与肿瘤的恶性生物学表型有关[20]。本研究结果显示:与si-NC组比较,si-BLACAT1组A549细胞中处于S期细胞百分率明显降低,G0/ G1期细胞百分率明显增加,集落形成数量和细胞增殖活性均明显降低,表明抑制BLACAT1的表达可明显抑制A549细胞的恶性细胞增殖表型。
细胞周期抑制蛋白CDKN2B可抑制G1期细胞进入S期,而细胞周期促进蛋白CyclinD1可推进这一进程[21]。目前,尚无文献报道BLACAT1如何影响NSCLC细胞增殖。本研究结果显示:抑制A549细胞中BLACAT1表达后,可阻滞A549细胞从G1期进入S期。同时,结合BLACAT1主要表达于A549细胞浆中这一结果,本文作者推测:表达于A549细胞浆中的BLACAT1,可能通过调节细胞从G1期进入S期所涉及关键蛋白的表达而发挥调控NSCLC生物学行为的作用。同时,本研究结果显示:与si-NC组比较,si-BLACAT1组细胞中CyclinD1mRNA和蛋白表达水平明显降低,而CDKN2BmRNA和蛋白表达水平明显升高。
综上所述,在NSCLC中高表达的BLACAT1可通过调控NSCLC细胞中CyclinD1/CDKN2B轴的表达水平,从而调节NSCLC的恶性细胞增殖。然而,本研究缺乏动物体内实验的进一步佐证。随着对LncRNA研究策略的逐步深入,可能会发现越来越多潜在的作为NSCLC分子靶标的LncRNAs。
| [1] | FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [2] | SÈVE P, REIMAN T, DUMONTET C. The role of betaⅢ tubulin in predicting chemoresistance in non-small cell lung cancer[J]. Lung Cancer, 2010, 67(2): 136–143. DOI:10.1016/j.lungcan.2009.09.007 |
| [3] | RAUNGRUT P, WONGKOTSILA A, LIRDPRAPAMONGKOL K, et al. Prognostic significance of 14-3-3γ overexpression in advanced non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2014, 15(8): 3513–3518. DOI:10.7314/APJCP.2014.15.8.3513 |
| [4] | BEERMANN J, PICCOLI M T, VIERECK J, et al. Non-coding RNAs in development and disease:background, mechanisms, and therapeutic approaches[J]. Physiol Rev, 2016, 96(4): 1297–1325. DOI:10.1152/physrev.00041.2015 |
| [5] | HE W, CAI Q Q, SUN F Y, et al. Linc-UBC1 physically associates with polycomb repressive complex 2(PRC2) and acts as a negative prognostic factor for lymph node metastasis and survival in bladder cancer[J]. Biochim Biophys Acta, 2013, 1832(10): 1528–1537. DOI:10.1016/j.bbadis.2013.05.010 |
| [6] | 王廷刚, 薛峰, 李宇, 等. miR-26a靶向HMGA1基因对结肠癌细胞生长、侵袭和迁移的影响[J]. 吉林大学学报:医学版, 2018, 44(6): 1205–1211. |
| [7] | SU J, ZHANG E B, HAN L, et al. Long noncoding RNA BLACAT1 indicates a poor prognosis of colorectal cancer and affects cell proliferation by epigenetically silencing of p15[J]. Cell Death Dis, 2017, 8(3): e2665. DOI:10.1038/cddis.2017.83 |
| [8] | WU X, ZHENG Y Z, HAN B, et al. Long noncoding RNA BLACAT1 modulates ABCB1 to promote oxaliplatin resistance of gastric cancer via sponging miR-361[J]. Biomed Pharmacother, 2018, 99: 832–838. DOI:10.1016/j.biopha.2018.01.130 |
| [9] | SHAN D, SHANG Y M, HU T X. Long noncoding RNA BLACAT1 promotes cell proliferation and invasion in human cervical cancer[J]. Oncol Lett, 2018, 15(3): 3490–3495. |
| [10] | WANG C H, LI Y H, TIAN H L, et al. Long non-coding RNA BLACAT1 promotes cell proliferation, migration and invasion in cervical cancer through activation of Wnt/β-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(10): 3002–3009. |
| [11] | LIAO D H, LV G, WANG T, et al. Prognostic value of long non-coding RNA BLACAT1 in patients with papillary thyroid carcinoma[J]. Cancer Cell Int, 2018, 18: 47. DOI:10.1186/s12935-018-0544-9 |
| [12] | HUARTE M, GUTTMAN M, FELDSER D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3): 409–419. DOI:10.1016/j.cell.2010.06.040 |
| [13] | CAO Z, PAN X Y, YANG Y, et al. The lncLocator:a subcellular localization predictor for long non-coding RNAs based on a stacked ensemble classifier[J]. Bioinformatics, 2018, 34(13): 2185–2194. DOI:10.1093/bioinformatics/bty085 |
| [14] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [15] | BAZZINI A A, JOHNSTONE T G, CHRISTIANO R, et al. Identification of small ORFs in vertebrates using ribosome footprinting and evolutionary conservation[J]. EMBO J, 2014, 33(9): 981–993. DOI:10.1002/embj.201488411 |
| [16] | CHEN L L. Linking long noncoding RNA localization and function[J]. Trends Biochem Sci, 2016, 41(9): 761–772. DOI:10.1016/j.tibs.2016.07.003 |
| [17] | 刘相良, 袁铭成, 纪伟, 等. 长链非编码RNA在肺癌发生发展中作用的研究进展[J]. 吉林大学学报:医学版, 2017, 43(2): 450–453. |
| [18] | YE J R, LIU L, ZHENG F. Long noncoding RNA bladder cancer associated transcript 1 promotes the proliferation, migration, and invasion of nonsmall cell lung cancer through sponging miR-144[J]. DNA Cell Biol, 2017, 36(10): 845–852. DOI:10.1089/dna.2017.3854 |
| [19] | CHEN X L, DAI M Y, ZHU H Z, et al. Evaluation on the diagnostic and prognostic values of long non-coding RNA BLACAT1 in common types of human cancer[J]. Mol Cancer, 2017, 16(1): 160. DOI:10.1186/s12943-017-0728-2 |
| [20] | BARRETT T, TROUP D B, WILHITE S E, et al. NCBI GEO:mining tens of millions of expression profiles:database and tools update[J]. Nucleic Acids Res, 2007, 35(Database issue): D760–D765. |
| [21] | SCHWARTZ G K, SHAH M A. Targeting the cell cycle:a new approach to cancer therapy[J]. J Clin Oncol, 2005, 23(36): 9408–9421. DOI:10.1200/JCO.2005.01.5594 |
 2019, Vol. 45
2019, Vol. 45


