扩展功能
文章信息
- 陈宇, 马贤德, 刘昱麟, 宫照东, 姜开运
- CHEN Yu, MA Xiande, LIU Yulin, GONG Zhaodong, JIANG Kaiyun
- 山茱萸对苯扎氯铵诱导的干眼症小鼠视黄醇转运的调控作用
- Regulatory effects of fructus corni on retinol transport in mice with dry eye syndrome induced by benzalkonium chloride
- 吉林大学学报(医学版), 2019, 45(04): 752-758
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 752-758
- 10.13481/j.1671-587x.20190402
-
文章历史
- 收稿日期: 2019-01-19
2. 辽宁中医药大学教学实验中心生物技术实验室, 辽宁 沈阳 110847;
3. 辽宁中医药大学研究生学院, 辽宁 沈阳 110847;
4. 辽宁中医药大学附属医院, 辽宁 沈阳 110847;
5. 辽宁中医药大学中医学院, 辽宁 沈阳 110847
2. Biotechnology Laboratory of Teaching Experiment Center, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China;
3. Graduate School, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China;
4. Affiliated Hospital, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China;
5. School of Traditional Chinese Medicine, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China
干眼症又称结膜干燥症,是由多种原因引起的泪液质或量的异常,或泪液动力学异常所导致的泪膜稳定性下降,并伴有眼部不适等症状的多种疾病的总称[1-2]。中医学认为:酸入肝,酸补肝,而肝开窍于目。中医学范畴无干眼症之说,但有古籍中有“白涩症”的记载,与现代的干眼症极其相似。其发病机制为“阴虚津亏”。视黄醇(维生素A)存在于肝组织中,故本研究采用酸味中药山茱萸对苯扎氯铵诱导的干眼症模型小鼠进行干预,观察酸味中药对干眼症小鼠体内视黄醇转运的干预作用,揭示“酸补肝明目”的分子机制。
视黄醇及其主要衍生物(全反式视黄酸和视黄醛)具有多种生物学功能,既能够调控脂肪细胞及肌纤维细胞的分化、迁移、侵袭和增殖,又能调节上皮细胞的完整性和功能,还能参与类固醇和干扰素的生成以及调控免疫细胞的功能,尤其是对胚胎发育有着极其重要的影响[1]。视黄醇主要存在于肝脏中,在视黄醇结合蛋白(retinol blinding protein,RBP)和前蛋白(prealbumin,PA)的参与下,完成在血液中的转运,在细胞内视黄醇结合蛋白(cellular retional binding protein,CRBP)和RBP受体—维甲酸诱导蛋白6(stimulated by retinoic acid gene 6, STRA6)的参与下,完成视黄醇向细胞内部的转运,从而发挥相应的生物学作用。近年来,视黄醇用于治疗干眼症的报道[3-4]屡见不鲜,但关于山茱萸水煎剂通过调节视黄醇在体内的转运参与干眼症治疗的作用机制报道较少,本课题组前期曾开展过相关研究[5-6]。另有研究者[7-9]进行了视黄醇缺乏干眼症的相关研究,但并未对视黄醇转运途径进行深入探讨。本研究在前期对视黄醇缺乏型干眼症研究的基础上,通过观察山茱萸对干眼症模型小鼠血清中PA和RBP水平、肝组织中视黄醇水平、泪腺组织中CRBP和STRA6表达水平的影响,探讨酸味药山茱萸水煎剂对干眼症小鼠视黄醇转运途径的调控作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器SPF级BALB/c小鼠60只,6~8周龄,雌雄各半,购自辽宁长生生物科技有限公司,实验动物生产许可证号:SCXK(辽)2010-0001,体质量18~22g,饲养于辽宁中医药大学实验动物中心,实验动物饲养许可证号:SYXK(辽)2013-0009,适应性饲养1周后开始实验。PA检测试剂盒、视黄醇检测试剂盒和BP检测试剂盒购于武汉优尔生商贸有限公司,anti-RBP和anti-STRA6购于英国Abcam公司。苯扎氯铵购自美国GMA公司,用蒸馏水将苯扎氯铵配制成浓度为0.2%的溶液,-20℃冰箱中保存备用。山茱萸饮片购自辽宁中医药大学附属医院门诊药局。取山茱萸饮片60 g,以150 mL蒸馏水浸泡1 h,先用大火煮沸20 min,后以小火维持沸腾状态20 min,纱布过滤,收集药液,重新向饮片中加入蒸馏水100 mL,重新按上述方法煎煮40 min,如此反复3次,收集3次药液混匀,称量体积,加热沸腾,浓缩至100 mL,为低剂量山茱萸组给药浓度;等量饮片同法煎煮药液,浓缩至50 mL,为中剂量山茱萸组给药浓度;等量饮片同法煎煮药液,浓缩至25 mL,为高剂量山茱萸组给药浓度;4℃冰箱保存备用,每3 d制备1次药液。石斛夜光丸购自北京同仁堂股份有限公司,按照人与动物等效给药剂量换算,小鼠给药量为2.5 g·kg-1,取石斛夜光丸1丸(9 g),剪碎并以50 mL蒸馏水浸泡1 h,吸管吹打均匀,制备成悬浊液,定容至72 mL,4℃冰箱保存备用,每2 d配置1次药液。
MK3型酶标仪[赛默飞世尔科技(中国)有限公司],VE-180型双垂直电泳槽和4200SF型凝胶成像分析系统(上海天能科技有限公司),DM2000(4X-1000X)型数码显微镜(德国徕卡仪器有限公司),1H4K型迷你离心机和3H16RI型高速冷冻离心机(湖南赫西仪器装备有限公司),SHA-B型恒温振荡器(常州国华电器有限公司),WD-9405B型脱色摇床(北京市六一仪器厂)。
1.2 实验动物分组、干眼症动物模型的建立和评价60只BALB/c小鼠随机分为空白对照组,模型组,阳性对照组,低、中和高剂量山茱萸组,每组10只。除空白对照组外,其余各组小鼠均按照BARABINO等[10]研究方法,采用双眼滴苯扎氯铵溶液的方法复制干眼症动物模型。苯扎氯铵浓度为0.2%,滴眼量为每眼5 μL,每日1次,连续6周。滴眼6周后,采用泪液检测滤纸测定各组小鼠基础泪液分泌量(以滤纸被泪液浸湿的长度代表泪液分泌量)[8],采用荧光素染色法观察各组小鼠泪膜破裂时间[8],评价模型是否成功。
1.3 药物干预模型制备成功后,次日开始,各组小鼠均给予相应干预。空白对照组小鼠不作处理,正常饲养;模型组小鼠经口灌胃生理盐水,20mL·kg-1体质量;阳性对照组小鼠经口灌服石斛夜光丸溶液,20 mL·kg-1体质量,按照人与动物等效给药剂量换算,给药量为2.5 g·kg-1;低、中和高剂量山茱萸组小鼠分别经口灌服600、1200和2 400 g·L-1山茱萸水煎剂,20 mL·kg-1体质量。各组小鼠均每日给药1次,连续4周。
1.4 小鼠血清中PA和RBP水平检测末次给药后,各组小鼠再次测定泪液分泌量和泪膜破裂时间。麻醉后经球后静脉丛采集全血,分离血清,采用酶联免疫吸附(双抗体夹心)法检测血清中PA和RBP水平。按照试剂盒说明书操作,根据试剂盒标准品绘制标准曲线,拟合标准方程,计算小鼠血清中PA和RBP的水平。
1.5 小鼠肝组织中视黄醇水平检测各组小鼠取血后处死,迅速置于冰面上,剖开腹部,取肝组织约200 mg,装于1.5 mL冻存管中,-80℃保存,采用酶联免疫吸附法检测肝组织匀浆中视黄醇水平,操作步骤按照说明书中进行,根据试剂盒标准品绘制标准曲线,拟合标准方程,计算小鼠肝组织中视黄醇水平。
1.6 免疫组织化学法检测小鼠泪腺组织中CRBP和STRA6蛋白表达水平各组随机选取6只小鼠(12眼),以眼科剪及眼科镊摘取球后泪腺组织,浸泡于4%多聚甲醛溶液中,常温固定24 h后,制备石蜡切片,采用免疫组织化学法检测CRBP和STRA6蛋白表达水平。常规制备石蜡切片,脱蜡至水,抗原修复并去除内源性过氧化物酶后,封闭1 h,一抗(1:400)4℃冰箱孵育过夜,二抗室温孵育2 h,DAB显色,并以苏木素复染,镜下观察并采集照片,测定5个随机视野的平均吸光度(A)值,以A值的平均值作为该样本中目的蛋白表达水平。
1.7 免疫印迹法检测各组小鼠泪腺组织中CRBP和STRA6蛋白表达水平各组剩余小鼠按1.6中方法采集泪腺组织,冷冻保存,采用裂解法抽提泪腺组织中总蛋白,蛋白定量后测定蛋白浓度,加入5×上样缓冲液,沸水浴变性5 min,以50 μg/孔的蛋白量上样,并垂直电泳,湿转法将凝胶中蛋白转印至PVDF膜,一抗(1:500)4℃冰箱孵育过夜,二抗室温孵育2 h,洗膜后滴加ECL发光液,凝胶成像分析系统中采集图像,并测定条带灰度值,以目的条带灰度值/内参条带灰度值的比值作为该蛋白的相对表达水平。
1.8 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组小鼠血清中PA和RBP水平,肝组织中视黄醇水平,泪腺组织中CRBP和STRA6蛋白表达水平均以x±s表示,进行正态性和方差齐性检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果 2.1 各组小鼠泪液分泌量给药干预前,与空白对照组比较,其他各组小鼠泪液分泌量明显减少(P<0.01)。给药干预后,与空白对照组比较,模型组小鼠泪液分泌量明显减少(P<0.01);与模型组比较,阳性对照组,低、中和高剂量山茱萸组小鼠泪液分泌量均有不同程度增加(P<0.05或P<0.01);与阳性对照组比较,低和中剂量山茱萸组小鼠泪液分泌量明显减少(P<0.01)。见表 1。
| (n=10, x±s, l/mm) | ||
| Group | Tear secretion amount | |
| Before administration | After administration | |
| Blank control | 6.80±0.87 | 7.29±1.08 |
| Model | 2.32±0.54** | 2.25±0.51** |
| Positive control | 2.29±0.47** | 6.37±1.08*△ |
| Fructus corni | ||
| Low dose | 2.40±0.45** | 4.08±0.86**△# |
| Medium dose | 2.44±0.51** | 4.74±0.83**△# |
| High dose | 2.27±0.47** | 6.86±1.25△ |
| F | 106.65 | 36.05 |
| P | 0.000 | 0.000 |
| * P<0.05,* * P<0.01 vs blank control group;△ P<0.01 vs model group;# P<0.01 vs positive control group. | ||
给药干预前,与空白对照组比较,其他各组小鼠泪膜破裂时间明显缩短(P<0.01)。给药干预后,与空白对照组比较,模型组小鼠泪膜破裂时间明显缩短(P<0.01);与模型组比较,阳性对照组,低、中和高剂量山茱萸组小鼠泪膜破裂时间均有不同程度延长(P<0.01);与阳性对照组比较,高剂量山茱萸组小鼠泪膜破裂时间进一步延长(P<0.05)。见表 2。
| (n=10, x±s, t/s) | ||
| Group | Tear film rupture time | |
| Before administration | After administration | |
| Blank control | 6.88±0.67 | 6.87±0.60 |
| Model | 2.06±0.75* | 1.60±0.40* |
| Positive control | 1.87±0.60* | 4.35±0.70*△ |
| Fructus corni | ||
| Low dose | 1.99±0.50* | 3.82±0.85*△ |
| Medium dose | 1.98±0.52* | 4.00±0.64*△ |
| High dose | 1.87±0.44* | 5.06±0.71*△# |
| F | 101.56 | 50.76 |
| P | 0.000 | 0.000 |
| * P<0.01 vs blank control group;△ P<0.01 vs model group;# P<0.05 vs positive control group. | ||
与空白对照组比较,其余各组小鼠血清中PA和RBP水平明显降低(P<0.01);与模型组比较,阳性对照组,低、中和高剂量山茱萸组小鼠血清中PA和RBP水平明显升高(P<0.01);与阳性对照组比较,高剂量山茱萸组小鼠血清中PA和RBP水平明显升高(P<0.05或P<0.01)。见表 3。
| (n=10, x±s) | |||
| Group | PA[ρB/(μg·L-1)] | RBP[ρB/(μg·L-1)] | Retinol[wB/(ng·g-1)] |
| Blank control | 1.15±0.16 | 2.21±0.34 | 1.76±0.21 |
| Model | 0.37±0.06 * | 0.63±0.13* | 0.71±0.19* |
| Positive control | 0.64±0.07*△ | 1.35±0.20*△ | 1.18±0.16*△ |
| Fructus corni | |||
| Low dose | 0.60±0.08*△ | 1.17±0.18*△ | 0.73±0.17*## |
| Medium dose | 0.67±0.10*△ | 1.40±0.24*△ | 0.95±0.15*△## |
| High dose | 0.76±0.13*△# | 1.66±0.32*△## | 1.16±0.19*△ |
| F | 57.74 | 45.12 | 47.56 |
| P | 0.000 | 0.000 | 0.000 |
| * P<0.01 vs blank control group;△ P<0.01 vs model group;# P<0.05,## P<0.01 vs positive control group. | |||
与空白对照组比较,模型组小鼠肝组织中视黄醇水平明显降低(P<0.01);与模型组比较,阳性对照组,低、中和高剂量山茱萸组小鼠肝组织中视黄醇水平明显升高(P<0.01);与阳性对照组比较,低和中剂量山茱萸组小鼠肝组织中视黄醇水平明显降低(P<0.01)。见表 3。
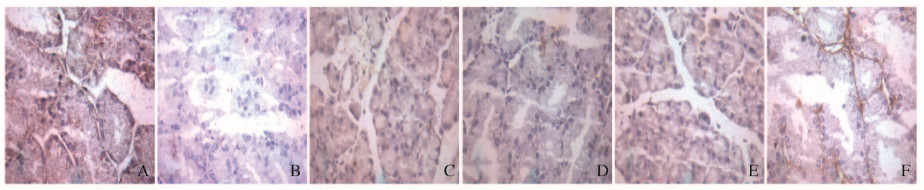
2.5 免疫组织化学法检测各组小鼠泪腺组织中CRBP和STRA6蛋白表达水平与空白对照组比较,模型组小鼠泪腺组织中CRBP和STRA6蛋白表达水平明显降低(P<0.01);与模型组比较,阳性对照组,低、中和高剂量山茱萸组小鼠泪腺组织中CRBP和STRA6蛋白表达水平明显升高(P<0.05或P<0.01);与阳性对照组比较,高剂量山茱萸组小鼠泪腺组织中CRBP和STRA6表达水平进一步升高(P<0.01)。见表 4和图 1、2(插页一)。
| (n=6, x±s) | ||
| Group | CRBP | STRA6 |
| Blank control | 0.239±0.020 | 0.222±0.022 |
| Model control | 0.112±0.020** | 0.122±0.012** |
| Positive control | 0.185±0.014**△△ | 0.186±0.025**△△ |
| Fructus corni | ||
| Low dose | 0.171±0.020**△△ | 0.154±0.020**△# |
| Medium dose | 0.208±0.024*△△ | 0.194±0.021*△△ |
| High dose | 0.229±0.038 △△## | 0.247±0.024△△## |
| F | 20.85 | 24.38 |
| P | 0.000 | 0.000 |
| * P<0.05, * * P<0.01 vs blank control group;△ P<0.05, △△ P<0.01 vs model group;# P<0.05,## P<0.01 vs positive control group. | ||

|
| A:Blank control group; B:Model group; C:Positive control group; D-F:Low, medium, and high doses of fructus corni groups. 图 1 各组小鼠泪腺组织中CRBP蛋白表达(DAB,×400) Fig. 1 Expressions of CRBP protein in lacrimal gland tissue of mice in various groups(DAB, ×400) |
|
|
|
| A:Blank control group; B:Model group; C:Positive control group; D-F:Low, medium, and high doses of fructus corni groups. 图 2 各组小鼠泪腺组织中STRA6蛋白表达情况(DAB,×400) Fig. 2 Expressions of STRA6 protein in lacrimal gland tissue of mice in various groups(DAB, ×400) |
|
|
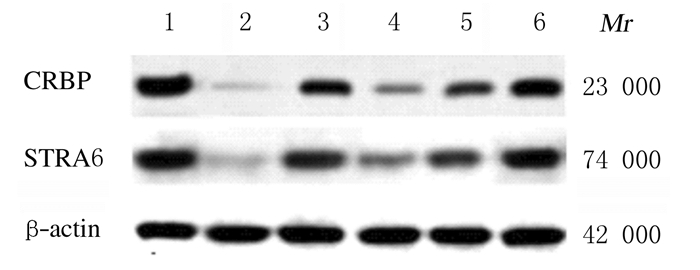
与空白对照组比较,模型组小鼠泪腺组织中CRBP和STRA6蛋白表达水平明显降低(P<0.01);与模型组比较,阳性对照组,低、中和高剂量山茱萸组小鼠泪腺组织中CRBP和STRA6蛋白表达水平明显升高(P<0.01);与阳性对照组比较,低剂量山茱萸组小鼠泪腺组织中CRBP蛋白表达水平明显降低(P<0.01),而高剂量山茱萸组小鼠泪腺组织中STRA6蛋白表达水平明显升高(P<0.01)。见表 5和图 3。
| (n=6, x±s) | ||
| Group | CRBP/β-actin | STRA6/β-actin |
| Blank control | 0.601±0.057 | 0.541±0.057 |
| Model control | 0.272±0.041** | 0.277±0.034** |
| Positive control | 0.452±0.050**△ | 0.430±0.036**△ |
| Fructus corni | ||
| Low dose | 0.368±0.057**△# | 0.382±0.063**△ |
| Medium dose | 0.462±0.051**△ | 0.468±0.038*△ |
| High dose | 0.494±0.055**△ | 0.512±0.052△# |
| F | 22.40 | 25.08 |
| P | 0.000 | 0.000 |
| * P<0.05, * * P<0.01 vs blank control group;△ P<0.01 vs model group;# P<0.01 vs positive control group. | ||
|
| Lane 1:Blank control group; Lane 2:Model group; Lane 3:Positive control group; Lane 4:Low dose of fructus corni group; Lane 5:Medium dose of fructus corni dose group; Lane 6:High dose of fructus corni group. 图 3 各组小鼠泪腺组织中CRBP和STRA6蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of CRBP and STRA6 proteins in lacrimal gland tissue of mice in various groups |
|
|
干眼症是由于泪液质或量的异常而引发的泪膜稳定性下降,并伴有一组眼部不适症状的眼部疾患。随着电脑和手机等电子产品应用范围的日益扩大,干眼症发病率逐年升高,严重困扰着人类的视觉健康。此外,苯扎氯铵为滴眼液中常用的防腐剂之一,也是临床引发干眼症不适症状的常见因素。因此,在干眼症的基础研究中,研究者常采用苯扎氯铵滴眼的方式复制干眼动物模型。本研究结果显示:苯扎氯铵滴眼6周,小鼠泪液分泌量明显减少,泪膜破裂时间明显缩短,结合以往文献[11-12]报道,提示苯扎氯铵诱导的干眼症动物模型比较稳定可靠。
本研究采用山茱萸水煎剂对苯扎氯铵诱导的干眼症小鼠进行干预,结果显示:与模型组比较,各剂量山茱萸组小鼠泪液分泌量均明显增多,泪膜破裂时间明显延长,提示山茱萸能够明显改善苯扎氯铵导致的干眼症状。干眼症与视黄醇水平有密切关联,视黄醇又称维生素A或抗干眼病维生素,是一类脂溶性化合物。肝脏是人体内视黄醇含量最多的器官,能合成一种在体内转运视黄醇的蛋白质RBP,在肝功能障碍时肝细胞合成RBP减少,可造成血浆视黄醇水平降低,导致对弱光敏感性下降,严重时发生夜盲[13]。
研究[14]表明:视黄醇对角膜上皮细胞具有非常重要的作用,当视黄醇缺乏时,杯状细胞化角膜上皮细胞微绒毛减少,从而导致角膜上皮不能正常生长及分化,发生角膜上皮角化或鳞化,甚至泪腺萎缩。而视黄醇可逆转这一改变,促进眼表上皮细胞和杯状细胞分泌黏蛋白[15]。因此,视黄醇的转运过程在干眼症的发生过程中发挥着至关重要的作用。视黄醇主要存在于肝组织中,在RBP和PA的参与下,完成向血液中的转运。
本研究为了进一步探讨酸味中药山茱萸对干眼症小鼠的干预作用机制,检测了小鼠肝脏组织中视黄醇及血清中RBP和PA水平,结果显示:与空白对照组比较,模型组小鼠血清中PA、RBP水平和肝组织中视黄醇水平明显降低,而药物干预后小鼠血清中PA、RBP水平和肝组织中视黄醇水平明显升高,提示干眼症发生时,机体处于视黄醇缺乏状态,同时因较低水平的视黄醇不能有效刺激RBP和PA的分泌,血清RBP和PA表达水平也明显降低。本文作者推测:山茱萸对视黄醇吸收利用具有促进作用,其机制可能是山茱萸通过促进视黄醇的吸收而实现上调PA和RBP表达水平,进而加快视黄醇的转运。
视黄醇完成肝组织向血液中的转运后,在CRBP和STRA6的参与下,进行视黄醇向细胞内部的转运,从而发挥相应的生物学作用[16]。研究[17]表明:当机体组织中需要视黄醇时,酯酶会将肝脏中的视黄醇水解,然后再与RBP和PA结合形成复合体(复合体为水溶性,并且能够被细胞膜识别),并释放至肝脏外,进入血液循环,运输至靶组织中。视黄醇-RBP-PA复合体进入靶组织后,通过RBP与细胞膜上的受体结合,并将视黄醇释放至细胞内,RBP即完成使命,从复合体中解离,并发生变性,失去结合到细胞膜受体的能力,经过肾小球滤过和肾小管的重吸收,分解为氨基酸[18]。另一方面,进入靶细胞的视黄醇会立即与膜受体结合,再与CRBP结合形成复合体,从而与膜受体分离并转运至细胞内[19-20]。
本研究对各组小鼠泪腺组织中CRBP和STRA6蛋白表达水平进行检测,结果显示:与空白对照组比较,模型组小鼠泪腺组织中CRBP和STRA6蛋白表达水平明显降低;与模型组比较,阳性对照组和各剂量山茱萸组小鼠泪腺组织中CRBP和STRA6蛋白表达水平不同程度的升高。本研究结果表明:干眼症的发生伴随CRBP蛋白及其受体STRA6蛋白的低水平表达,干眼症的发生不仅是视黄醇转运发生了障碍,细胞内的转运过程也受到了影响,该影响主要表现为CRBP和STRA6蛋白的表达低下,而酸味药山茱萸干预后,CRBP和STRA6蛋白的低水平表达状态得以纠正,加强了细胞内视黄醇的转运,从而发挥对泪腺上皮细胞的保护作用,最终实现抗干眼作用。
综上所述,PA、RBP和STRA6均参与了视黄醇的转运过程,最终使视黄醇在细胞内发挥生物学作用。而视黄醇的缺乏会造成上皮组织的干燥,全身各种组织的上皮细胞均可受到影响,受累最早的是眼结膜、角膜和泪腺上皮细胞[21]。因此,调控视黄醇的转运对干眼症的治疗具有十分重要的意义。酸味中药山茱萸通过增加视黄醇的吸收及转运而发挥调控视黄醇转运相关蛋白的表达,发挥抗干眼作用。本研究结果为“酸入肝抗炎,酸补肝明目”的中医学基础理论奠定了分子学基础。
| [1] | ZEEV M S, MILLER D D, LATKANY R. Diagnosis of dry eye disease and emerging technologies[J]. Clin Ophthalmol, 2014, 8: 581–590. |
| [2] | 薛研, 赵耀东, 颉瑞萍, 等. "进火补"针法治疗气阴两虚型干眼症[J]. 中国针灸, 2018, 38(6): 609–612. |
| [3] | 何媛, 洪薇薇, 赵海雁, 等. 维生素A棕榈酸酯眼用凝胶联合羧甲基纤维素钠对白内障术后干眼的预防[J]. 国际眼科杂志, 2018, 18(7): 1264–1267. |
| [4] | 昝云强, 赵维杰. 针灸配合补充维生素A治疗干眼症的疗效观察[J]. 天津中医药, 2017, 34(12): 823–825. DOI:10.11656/j.issn.1672-1519.2017.12.10 |
| [5] | 姜开运, 于凯洋. 五味子对维生素A缺乏型干眼症RBP、STRA6蛋白表达的影响[J]. 辽宁中医药大学学报, 2016, 18(8): 27–29. |
| [6] | 姜开运, 牛爽, 李珂. 五味子治疗维生素A缺乏型干眼症疗效及作用机制[J]. 辽宁中医药大学学报, 2016, 18(7): 33–35. |
| [7] | 刘超, 耿燕. NFκ-Bp65、NOS2在维生素A缺乏干眼模型兔角膜中的表达及意义[J]. 眼科研究, 2009, 27(1): 19–22. DOI:10.3760/cma.j.issn.2095-0160.2009.01.005 |
| [8] | 马轶群, 王琇, 杨青, 等. 维生素A缺乏干眼症模型兔泪液分泌及泪膜稳定性的改变[J]. 眼科新进展, 2006, 26(7): 517–520. DOI:10.3969/j.issn.1003-5141.2006.07.011 |
| [9] | 马轶群, 王传富, 王青. 维生素A缺乏干眼症兔泪腺凋亡及相关基因的表达[J]. 眼科新进展, 2003, 23(6): 406–408. DOI:10.3969/j.issn.1003-5141.2003.06.007 |
| [10] | BARABINO S, SHEN LL, CHEN L, et al. The controlled-environment chamber:a new mouse model of dry eye[J]. Invest Ophthalmol Vis Sci, 2005, 46(8): 2766–2771. DOI:10.1167/iovs.04-1326 |
| [11] | LIN Z R, LIU X C, ZHOU T, et al. A mouse dry eye model induced by topical administration of benzalkonium chloride[J]. Mol Vis, 2011, 17: 257–264. |
| [12] | RU Y S, HUANG Y, LIU H J, et al. α-Melanocyte-stimulating hormone amelio-rates ocular surface dysfunctions and lesions in a scopolamine-induced dry eye model via PKA-CREB and MEK-Erk pathways[J]. Sci Rep, 2016, 5: 18619. DOI:10.1038/srep18619 |
| [13] | 王朝晖. 羟糖苷滴眼液联合维生素A棕榈酸酯凝胶治疗视网膜脱离术后干眼的疗效观察[J]. 临床眼科杂志, 2018, 26(3): 243–245. DOI:10.3969/j.issn.1006-8422.2018.03.016 |
| [14] | 丛越, 王万梅. 维生素A缺乏干眼病角膜组织上皮细胞Fas、FasL、Bax和bcl-2的表达与细胞凋亡的关系研究[J]. 中国实验诊断学, 2017, 21(10): 1820–1823. DOI:10.3969/j.issn.1007-4287.2017.10.052 |
| [15] | NOECKER RJ, HERRYQERS LA, ANWARUDDIN R. Coreal and cenjunceivial changes caused by commondly used glancoma medications[J]. Corneal, 2004, 23(5): 490–496. DOI:10.1097/01.ico.0000116526.57227.82 |
| [16] | BREEN C J, MARTIN D S, MA H, et al. Production of functional human vitamin A transporter/RBP receptor (STRA6) for structure determination[J]. PLoS One, 2015, 10(3): e0122293. DOI:10.1371/journal.pone.0122293 |
| [17] | MONACO H L, RIZZI M, CODA A. Structure of a complex of two plasma proteins:transthyretin and retinol-binding protein[J]. Science, 1995, 268(5213): 1039–1041. DOI:10.1126/science.7754382 |
| [18] | 金宏. 视黄醇转运的分子机制[J]. 生理科学进展, 1997, 28(2): 166–168. DOI:10.3321/j.issn:0559-7765.1997.02.018 |
| [19] | MALPELI G, STOPPINI M, ZAPPONI M C, et al. Interactions with retinol and retinoids of bovine cellular retinol-binding protein[J]. Eur J Biochem, 1995, 229(2): 486–493. DOI:10.1111/ejb.1995.229.issue-2 |
| [20] | 付玉, 张盼, 张雅文, 等. 猪视黄醇结合蛋白基因研究进展[J]. 中国畜牧杂志, 2018, 54(12): 10–13. |
| [21] | ROSS A C.Vitamin A and carotenoids[A]//SHILS M E, SHIKE M, ROSS A C. Modern nutrition in health and disease[M]. 10th ed. Baltimore: Lippincott Williams & Wilkins, 2006: 351-371. |
 2019, Vol. 45
2019, Vol. 45


