扩展功能
文章信息
- 王叶, 王红, 张书剑, 姬华祎, 金正勇
- WANG Ye, WANG Hong, ZHANG Shujian, JI Huayi, JIN Zhengyong
- 谷氨酰胺对新生大鼠高氧肺损伤的干预作用及其机制
- Intervention effect of glutamine on hyperoxia lung injury in neonatal rats and its mechanism
- 吉林大学学报(医学版), 2019, 45(04): 747-751
- Journal of Jilin University (Medicine Edition), 2019, 45(04): 747-751
- 10.13481/j.1671-587x.20190401
-
文章历史
- 收稿日期: 2019-02-27
2. 吉林大学中日联谊医院儿科, 吉林 长春 130033
2. Department of Pediatrics, China-Japan Union Hospital, Jilin University, Changchun 130033, China
持续高浓度的吸氧可以使肺组织的结构和功能发生改变,称之为高氧肺损伤(hyperoxia lung injury, HALI)[1]。早产儿及低出生体质量儿易发生HALI,可导致支气管肺发育不良。新生儿HALI发病机制的研究具有重要的临床意义,近年来已成为国内外学者的研究热点,目前认为其发病中主要包括炎症反应、氧化应激反应和细胞凋亡等[2],而白细胞介素6(interleukin-6,IL-6)、白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症介质在HALI发病中也有一定的作用[3]。相关研究[4]证实:谷氨酰胺(glutamine,GLN)对急性肺损伤具有保护作用,但未见GLN在HALI中的作用及对IL-6、IL-1β和TNF-α影响的相关报道。本研究通过建立新生大鼠HALI模型,以模拟临床上早产儿长期暴露于高氧导致的肺损伤,探讨GLN作为药物干预防治新生大鼠肺组织水肿及抑制炎症反应作用,为HALI的预防和治疗提供有效的理论支持。
1 材料与方法 1.1 药物、试剂和仪器GLN(日本Sigma-Aldrich公司),IL-1β抗体、IL-6抗体和TNF-α抗体(英国Abcam公司)。液氮机由吉林省延吉市畜牧局冷冻站提供,电磁搅拌器(CL-4A)和恒温槽(W501)(郑州长城科工贸有限公司),电子天平(BT25S,法国sartorius公司),超低温冰箱(MDF-382E,日本三洋公司),低速离心机(TGL-16,湖南湘仪实验室仪器开发有限公司),彩色病理图像分析仪(TD2000,北京天地百年科技有限责任公司),万能显微镜(VANOX型,日本Olympus公司),氧气测量仪(CYS-1,上海嘉定学联仪表厂)。
1.2 实验动物分组和模型制备足月新生Wistar大鼠90只,雌雄不限,由延边大学动物科提供。大鼠生后1 d内编号,随机分为对照组(吸入氧浓度为21%)、高氧组(吸入氧浓度>85%)和高氧+ GLN组,每组30只。对照组新生大鼠在同一室内呼吸常压空气,将高氧组和高氧+ GLN组新生大鼠放在材质相同的玻璃箱内,每天用数字式测氧仪测氧浓度3次,使玻璃箱内氧浓度维持在85%以上,玻璃箱内氧浓度保持一致,在玻璃箱底部加入钠石灰吸收CO2。使室内和玻璃箱内温度稳定在25℃~ 26℃,湿度维持在60% ~ 70%,每天开箱5 min,记录2组大鼠一般情况,更换垫料,及时加入水和饲料。实验第1天开始,高氧+GLN组新生大鼠每天定时腹腔注射GLN(0.75 g·kg-1·d-1),另2组新生大鼠腹腔注射等量生理盐水。对照组和高氧+ GLN组进行母鼠交换,防止母鼠因高氧影响新生鼠喂养及护理导致的实验误差。
1.3 标本采集和处理分别于实验第3、7和14天取大鼠肺组织,进行各项指标检测。大鼠处死后,取出完整肺组织后浸泡于4%多聚甲醛溶液中24 h,进行脱水、透明、包埋和切片,行HE染色,采用形态显微镜观察肺组织病理变化并拍照。将肺组织经液氮处理后, 保持在-80℃超低温冰箱中备用。
1.4 肺组织含水量测定随机选择新生大鼠用10%水合氯醛0.7 mL灌肠麻醉,剪开胸腔,完全露出心、肺,取肺组织,用医用棉清洁后立即称质量,记为湿重(W)。放入60℃烤箱内每天称量,持续2 d未见质量变化时记为肺组织干重(D)。采用Elliot公式[(W-D)/W×100%]计算肺组织含水量。记录结果,单位为%。
1.5 大鼠肺组织匀浆中IL-6、IL-1β和TNF-α水平检测采用生理盐水漂洗并称量肺组织后放入研磨器充分研磨,将匀浆液移入EP管中并标记,3 000 r·min-1、4℃低温离心15 min,保留上清,保存在-30℃冰箱中待测。按照IL-6、IL-1β和TNF-α检测试剂盒说明书操作并记录结果,单位为mg·g-1。
1.6 统计学分析采用SPSS20.0统计软件进行统计学分析。生后不同时间大鼠体质量、肺组织含水量和肺组织匀浆中IL-6、IL-1β和TNF-α水平以x±s表示,同日龄大鼠组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠不同时间体质量实验第3、7和14天,与同时间对照组比较,高氧组大鼠体质量明显降低(P<0.05);与同时间高氧组比较,高氧+ GLN组大鼠体质量明显增加(P<0.05)。见表 1。
| (n=10, x±s, m/g) | |||
| Group | Body weight | ||
| (t/d) 3 | 7 | 14 | |
| Control | 11.70±1.51 | 18.34±1.56 | 33.17±1.40 |
| Hyperoxia | 9.22±0.57* | 14.33±1.60* | 29.84±1.59* |
| Hyperoxia+GLN | 10.54±0.77△ | 15.64±1.73△ | 32.37±1.88△ |
| * P<0.05 compared with control group; △ P<0.05 compared with hyperoxia group. | |||
与对照组比较,高氧组大鼠肺泡结构有一定程度的破坏,伴有肺泡融合、间隔增宽、间质炎性渗出及纤维组织增生等改变,在高氧中暴露时间越长损伤程度越重;与同时间高氧组比较,高氧+ GLN组大鼠肺泡损伤程度、炎性渗出和纤维组织增生程度均减轻(图 1,见插页一)。
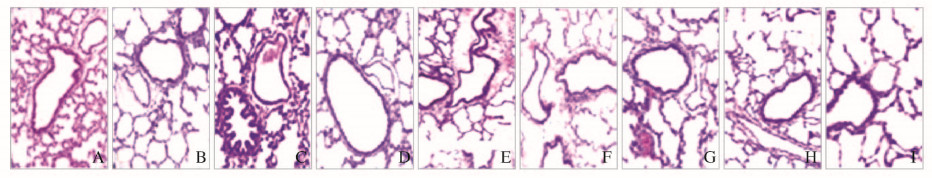
|
| A-C: Control Group; D-F: Hyperoxia group; G-I: Hyperoxia+GLN group; A, D, G:3d; B, E, H:7d; C, F, I:14d. 图 1 各组大鼠不同时间肺组织病理形态表现(×200) Fig. 1 Pathomorphology of lung tissue of rats in various groups at different time(×200) |
|
|
实验第3、7和14天,与同时间对照组比较,高氧组大鼠肺组织含水量明显增加(P<0.05),且高氧暴露时间越长含水量越高。实验第3、7和14天,与同时间高氧组比较,高氧+GLN组大鼠肺组织含水量明显降低(P<0.05)。见表 2。
| (n=10, x±s, η/%) | |||
| Group | Water content | ||
| (t/d) 3 | 7 | 14 | |
| Control | 5.59±0.44 | 5.68±0.38 | 5.85±0.42 |
| Hyperoxia | 6.26±0.33* | 6.78±0.39* | 7.26±0.75* |
| Hyperoxia+GLN | 5.69±0.55△ | 6.20±0.29△ | 6.60±0.54△ |
| * P<0.05 compared with control group;△ P<0.05 compared with hyperoxia group. | |||
实验第3、7和14天,与同时间对照组比较,高氧组大鼠肺组织匀浆中IL-6、IL-1β和TNF-α水平明显升高(P < 0.05)。与同时间高氧组比较,高氧+ GLN组大鼠肺组织匀浆中IL-6、IL-1β和TNF-α水平明显降低(P < 0.05)。高氧组大鼠肺组织匀浆中IL-6、IL-1β和TNF-α水平随时间延长而升高,在第7天时达到高峰,第14天时较第7天稍降低。见表 3。
| Group | IL-6 | ||
| (t/d) 3 | 7 | 14 | |
| Control | 1.25±0.65 | 1.47±0.62 | 1.29±0.37 |
| Hyperoxia | 28.26±1.57* | 33.98±1.78* | 29.87±1.68* |
| Hyperoxia+GLN | 22.25±1.64△ | 27.44±1.63△ | 22.62±1.61△ |
| Group | IL-1β | ||
| (t/d) 3 | 7 | 14 | |
| Control | 1.76±0.27 | 1.96±0.31 | 1.88±0.35 |
| Hyperoxia | 5.62±0.24* | 5.76±0.22* | 5.62±0.33* |
| Hyperoxia+GLN | 3.63±0.35△ | 4.40±0.21△ | 3.86±0.32△ |
| Group | TNF-α | ||
| (t/d) 3 | 7 | 14 | |
| Control | 0.48±0.03 | 0.50±0.03 | 0.51±0.09 |
| Hyperoxia | 0.63±0.03* | 0.68±0.02* | 0.56±0.02* |
| Hyperoxia+GLN | 0.56±0.03△ | 0.64±0.02△ | 0.52±0.02△ |
| * P<0.05 compared with control group;△ P<0.05 compared with hyperoxia group. | |||
支气管肺发育不良(BPD)又称新生儿慢性肺病,是早产儿,尤其是小早产儿呼吸系统常见疾病,严重影响早产儿的存活率及生活质量,也是婴儿期慢性呼吸系统疾病的主要病因[5-6], 而HALI是其重要病因之一。本研究通过新生大鼠HALI模型模拟人类新生儿BPD的典型病生理改变,结果显示:高氧组大鼠肺组织第3、7、14天时均出现典型病理变化,如肺泡结构破坏、肺泡融合、间质炎性渗出和纤维组织增生等,同时高氧组新生大鼠第3、7和14天肺组织含水量较同时间对照组明显增加,随着时间延长,含水量差别逐渐扩大。上述结果与有关HALI研究[7-8]结论一致, 说明本实验新生鼠HALI模型成功建立。
GLN对肺组织损伤具有保护作用已得到证实。目前研究[9-13]显示:热休克蛋白(HSPs)和GLN对危重患者的保护作用已明确,HSPs的免疫调节、抗氧化、炎症调节、抗细胞凋亡和改善组织代谢作用与GLN有密切关联;GLN为目前临床唯一安全的HSPs诱导剂,通过HSPs对细胞发挥保护作用,HSPs可以抑制核因子κB(NF-κB)的活性,从而减少炎症介质产生。本实验通过测量新生大鼠体质量、肺组织含水量、肺组织HE染色病理和肺组织匀浆中IL-6、IL-1β及TNF-α水平,探讨GLN在缓解高氧诱导的新生大鼠肺组织水肿及抑制炎症反应中的作用。
本研究结果显示:实验第3、7和14天,与同时间对照组比较,高氧组新生大鼠体质量明显降低,高氧+GLN组新生大鼠体质量较同时间高氧组大鼠明显增加。由此可见,高氧环境可导致新生鼠生存率降低,新生鼠和幼鼠生长发育落后,生长延迟,与国内相关学者研究一致[14];而腹腔注射GLN新生大鼠体质量较同时间高氧组升高,表明GLN对高氧导致的新生大鼠体质量下降有一定的缓解作用。
高浓度氧可引起肺内皮细胞和上皮细胞损伤,能够破坏肺泡上皮细胞完整性,进而导致肺水肿[15]。本研究结果显示:高氧组大鼠于实验第3、7和14天肺组织含水量较同时间对照组明显增加,与同时间高氧组比较高氧+GLN组大鼠肺组织含水量明显降低,表明GLN对高氧导致的肺部水肿具有缓解作用。
本研究中肺组织病理变化结果显示:与对照组比较,高氧组大鼠肺泡结构有一定程度的破坏,可伴有肺泡融合、间隔增宽、间质炎性渗出和纤维组织增生等改变,在高氧中暴露时间越长损伤程度越重;与同时间高氧组比较,高氧+GLN组大鼠肺泡损伤程度、炎性渗出及纤维组织增生程度均降低,表明高浓度氧可导致肺损伤,出现炎症性改变,与部分研究[16-18]结果一致,GLN对高氧导致的肺损伤起到一定程度的保护作用。
研究[19-21]表明:在急性肺损伤时,炎症反应发生早期,IL-6、IL-1β和TNF-α均为促炎细胞因子,抑制这些因子的产生可以使急性肺损伤减轻。本研究结果显示:与同时间对照组比较,高氧组大鼠肺组织匀浆中IL-6、IL-1β和TNF-α水平明显升高,与同时间高氧组比较,高氧+GLN组大鼠肺组织匀浆中IL-6、IL-1β和TNF-α水平明显降低,表明高氧环境可使肺组织中IL-6、IL-1β和TNF-α水平增加,且随着高氧暴露时间延长,在第7天达到最高值,随后有所下降。本研究结果表明:GLN在高氧导致的肺损伤中可以抑制IL-6、IL-1β和TNF-α表达,从而对肺损伤起到保护作用, 与有些研究[22]结论一致。
综上所述,高氧可以诱导新生大鼠肺水肿及肺损伤,腹腔注射GLN可缓解高氧导致的新生大鼠肺水肿,减轻肺泡结构的损伤和破坏,并可通过抑制IL-6、IL-1β和TNF-α表达减轻肺部炎症反应,进而对肺损伤起到保护作用。
| [1] | KALLET RH, MATTHAY MA. Hyperoxic acute lung injury[J]. Respir Care, 2013, 58(1): 123–141. DOI:10.4187/respcare.01963 |
| [2] | 张喆, 曹大伟, 张新日. 高氧肺损伤机制研究进展[J]. 国际呼吸杂志, 2018, 38(6): 461–464. DOI:10.3760/cma.j.issn.1673-436X.2018.06.014 |
| [3] | 郑潇玥, 陈晓. 氧化应激在重症新生儿高氧肺损伤中的作用研究进展[J]. 南昌大学学报:医学版, 2016, 56(1): 92–95. |
| [4] | 王卉, 边浩鹏, 程琦, 等. 谷氨酰胺对肝癌切除术患者炎症反应及肺损伤的影响[J]. 中国医药导报, 2018, 15(25): 79–82. |
| [5] | JOBE AH, BANCALARI E. Bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2001, 163(47): 1723–1729. |
| [6] | 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 4版. 北京: 人民卫生出版社,2016: 416-422. |
| [7] | 甘燕子, 郝锦丽, 曾其毅, 等. 高氧诱导新生鼠肺上皮细胞凋亡损伤与肺表面活性蛋白的变化[J]. 临床儿科杂志, 2015, 33(9): 817–821. DOI:10.3969/j.issn.1000-3606.2015.09.015 |
| [8] | 金正勇, 金贞爱, 池永学, 等. rh-CCSP对高氧暴露下新生大鼠肺损伤的影响[J]. 临床儿科杂志, 2012, 30(12): 1182–1184, 1190. DOI:10.3969/j.issn.1000-3606.2012.12.021 |
| [9] | 谈定玉, 顾勤. 热休克蛋白与谷氨酰胺对危重病人的保护作用[J]. 中国急救医学, 2006, 26(4): 287–290. DOI:10.3969/j.issn.1002-1949.2006.04.018 |
| [10] | 杨文宏, 邱方. 谷氨酰胺对急性肺损伤的保护作用及机制[J]. 中国医药指南, 2012, 10(18): 490–492. DOI:10.3969/j.issn.1671-8194.2012.18.377 |
| [11] | 张海鸿, 刘秀香, 赵国英, 等. 谷酰胺对新生大鼠急性高氧肺损伤的保护机制[J]. 山东医药, 2012, 52(21): 8–10. DOI:10.3969/j.issn.1002-266X.2012.21.004 |
| [12] | 刘荣, 罗振中. 谷氨酰胺预处理对肝缺血-再灌注后肺损伤的干预效果及机制[J]. 临床军医杂志, 2014, 42(12): 1211–1214. DOI:10.3969/j.issn.1671-3826.2014.12.01 |
| [13] | 冼乐武, 李奇林, 谢可兵. 谷氨酰胺对呼吸机所致肺损伤中HSP70表达的影响[J]. 中国急救医学, 2008, 28(8): 731–733. DOI:10.3969/j.issn.1002-1949.2008.08.020 |
| [14] | 宁巍, 李静, 漆秀洁, 等. 高氧致SD大鼠年龄相关的肺损伤及可能机制[J]. 上海交通大学学报:医学版, 2016, 36(11): 1562–1567. |
| [15] | CARNESECCHI S, DEFFERT C, PAGANO A, et al. NADPH oxidase-1 plays a crucial role in hyperoxia-induced acute lung injury in mice[J]. Am J Respir Crit Care Med, 2009, 180(10): 972–981. DOI:10.1164/rccm.200902-0296OC |
| [16] | 丁璐, 吴本清, 黄进洁, 等. 促红细胞生成素对新生大鼠高氧肺损伤细胞凋亡的影响[J]. 中国当代儿科杂志, 2010, 12(7): 576–579. |
| [17] | 苏立明, 金正勇, 许春花, 等. 异丙酚注射液和微量肝素对新生大鼠高氧肺损伤的影响[J]. 中国妇幼保健, 2015, 30(1): 144–147. |
| [18] | 钱莉玲, 常立文, 张谦慎, 等. 85%高浓度氧长期暴露诱发早产大鼠肺损伤[J]. 中国当代儿科杂志, 2003, 5(2): 95–99. DOI:10.3969/j.issn.1008-8830.2003.02.004 |
| [19] | LI HL, TAN G, TONG LQ, et al. Pentoxifylline inhibits pulmonary inflammation induced by infrarenal aorticcross-clamping dependent of adenosine receptor A2A[J]. Am J Transl Res, 2016, 8(5): 2210–2221. |
| [20] | VENDRAME S, KLIMIS-ZACAS D. Anti-inflammatory effect of anthocyanins via modulation of nuclear factor-κB and mitogen-activated proteinkinase signaling cascades[J]. Nutr Rev, 2015, 73(6): 348–358. DOI:10.1093/nutrit/nuu066 |
| [21] | 黄丽丽, 刘玲, 邱海波. 急性呼吸窘迫综合征诊断的进步与发展[J]. 中国实用内科杂志, 2018, 38(11): 977–980. |
| [22] | 高强, 相茹, 徐莉莉, 等. 谷氨酰胺对急性肺损伤患者的保护作用与机制研究[J]. 川北医学院学报, 2017, 32(2): 224–226. DOI:10.3969/j.issn.1005-3697.2017.02.021 |
 2019, Vol. 45
2019, Vol. 45


