扩展功能
文章信息
- 邹俊, 陈冰, 方铭慧, 胡正
- ZOU Jun, CHEN Bing, FANG Minghui, HU Zheng
- 具有人免疫系统和异体人黑色素瘤生长的人源化小鼠模型的构建和鉴定
- Establishment and identification of humanized mouse models with human immune system and allogeneic human melanoma growth
- 吉林大学学报(医学版), 2019, 45(03): 718-724
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 718-724
- 10.13481/j.1671-587x.20190344
-
文章历史
- 收稿日期: 2019-01-03
2. 吉林大学中日联谊医院麻醉科, 吉林 长春 130033
2. Department of Anesthesiology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
肿瘤严重威胁人类的健康,据统计,2017年全球新增1 810万肿瘤患者,有960万患者因肿瘤死亡[1]。近年的研究表明:机体会自发产生具有抗肿瘤功能的免疫力,增加这种抗肿瘤能力就能够提高肿瘤治疗效果;肿瘤局部形成的免疫抑制性微环境导致肿瘤逃逸免疫系统的监视,影响肿瘤的治疗效果。因此,深入研究人肿瘤免疫逃逸机制并开发更有效的抗肿瘤药物和治疗方法是当今生物医学领域的焦点和难点。
肿瘤免疫学问题的研究和肿瘤免疫治疗方法的研发离不开动物模型。小鼠与人体之间具有很大的差异,因而从小鼠中获得的研究结果通常无法应用于人体。由于小鼠和人类蛋白序列的差异,人免疫检查点抗体通常无法阻断小鼠细胞上的免疫检查点。因此,开发能更为真实地模拟人类肿瘤治疗情况的动物模型对深入研究人肿瘤免疫和抗肿瘤新药开发均具有重要意义。近年来,以人源化小鼠为代表的新型动物模型由于能够直接反映人类的某些生理和病理学特征,受到了广泛的关注。人源化小鼠一般是指具有人类基因、细胞和组织的小鼠,被认为是连接基础研究和临床转化的桥梁。其中,具有人类免疫系统的人源化小鼠模型已经广泛应用于人类免疫系统相关疾病(感染、自身免疫病和移植排斥等)的研究中,其在肿瘤免疫和抗肿瘤药物评价的作用也开始受到关注。通过在NOD/SCID或者NOD/SCID IL2rg-/-小鼠(清髓后)肾被膜下移植人胚胎胸腺及肝脏组织并联合尾静脉输注CD34+胎肝细胞建立的人源化小鼠[2](又称BLT小鼠)具有高水平人免疫系统嵌合,且能产生抗原特异性T细胞免疫反应和体液免疫反应,是应用最为广泛的人源化小鼠模型之一[3-5]。肿瘤浸润淋巴细胞(tumor inflitrating lymphocyte, TIL)是从肿瘤组织中分离出的浸润淋巴细胞,不同肿瘤来源的TIL细胞中CD4+T细胞和CD8+T细胞比例有差异。本研究通过在人源化小鼠体内植入异体人黑色素瘤细胞[6],建立能用于人肿瘤免疫和抗肿瘤药物评价(免疫检查点)的活体研究平台。
1 材料与方法 1.1 动物、主要试剂和仪器NOD-Prkdcem26Cd52Il2rgem26Cd22/Nju (NOD/SCID IL2rg-/-, NCG)小鼠,雌性,6~8周龄,体质量(21.88±0.47)g,购于南京大学-南京生物医药研究院,动物合格证号:201801566。胚胎胸腺和造血干细胞从废弃胚胎(17~21周)中分离、纯化(患者已签署知情同意书)。人A375黑色素瘤细胞由美国麻州总医院JENNIFER WARGO博士赠予。DMEM培养基和胎牛血清(美国Gibco公司),抗人CD45等抗体(美国Biolegend/ BD/eBioscience公司),抗小鼠CD45/Ter119抗体和FACS Fortessa(美国BD公司),抗人CD34磁珠抗体和MACS免疫磁珠分选仪(美国美天旎公司),鼠抗人单克隆CD8抗体(美国DAKO公司),红细胞裂解液(中国索莱宝公司),淋巴细胞分离液1.077(美国Sigma-Aldrich公司)。微量移液器(美国Rainin公司),水平离心机(美国Beckman公司),小动物及细胞辐照仪(美国Rad Source Technologies公司),Olympus BX53F正置显微镜和Cellsens dimension成像软件(日本Olympus公司)。
1.2 人源化小鼠模型的构建将胎肝研磨、过滤后制备成单细胞悬液,通过Ficoll密度梯度离心法分离单个核细胞,标记anti-CD34免疫磁珠,通过MACS方法纯化CD34+细胞(纯度>90%),备用;将胚胎胸腺剪切成1~2 mm3的小块,置于冰上备用。对NOD/SCID IL2rg-/-小鼠进行1.75 Gy全身照射,4 h后于其肾被膜下行胸腺移植,并通过尾静脉注射(1~2)×105 CD34+胎肝细胞。所构建的人源化小鼠饲养于吉林大学第一医院转化研究院SPF动物房。
1.3 人源化小鼠外周血中人类免疫系统嵌合情况检测术后3、6、9、12和15周,小鼠颌下取血,Ficoll分离外周血单个核细胞,标记抗人CD45/CD3/CD20/CD33及抗小鼠CD45/Ter119荧光抗体后,行流式细胞术检测。
1.4 肿瘤接种和肿瘤生长情况观察人源化小鼠构建15周后在其背臀部右侧皮下接种5 ×106个A375细胞,每5 d记录肿瘤长短径并计算肿瘤体积(V)(V = 1/2 ×长径×短径2),绘制肿瘤生长曲线。肿瘤体积长至1 500~2 000 mm3时,处死小鼠进行相关检测。
1.5 免疫组织化学法检测人源化小鼠淋巴器官和肿瘤组织中人淋巴细胞的组成和表型小鼠处死后,部分肿瘤组织保存于4%多聚甲醛(PFA)中,标记小鼠抗人CD8抗体(clone name:C8/144B, 货号M710301-2),SP标记羊抗鼠/兔IgG抗体(货号KIT-9710),DAB显色后于正置显微镜下观察并照相,以红棕色染色为阳性表达,完全不显色则为阴性表达。
1.6 CD8+/CD4+的计算采用FlowJo10.0软件分析细胞比例。读取并计算CD8+T细胞和CD4+T细胞的比例。CD8+/CD4+=CD8+T细胞比例/CD4+T细胞比例。
1.7 统计学分析采用GraphPad Prism 7.0软件进行统计学分析。各免疫细胞嵌合比例和CD8+/CD4+T细胞比值以x±s表示,符合正态分布和总体方差齐的多组数据之间比较采用单因素方差分析,组间两两比较采用Bonferroni检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 人源化小鼠外周血中人类免疫系统嵌合情况模型构建3周时,小鼠外周血中即能检测到人CD45+免疫细胞(34.18%±4.06%),随后人免疫细胞嵌合比例逐渐升高(图 1)。CD20+ B细胞和CD3+ T细胞为人源化小鼠外周血中的主要免疫细胞类型,其中移植后3周可检测到少量人B细胞(5.33%±1.31%),且其比例在移植后6周时达到高峰(74.23%±1.59%),随后B细胞的嵌合比例逐渐降低。与人B细胞的情况不同,移植后9周时才能检测到CD3+ T细胞(6.50%±1.92%),随后T细胞比例逐渐升高;移植后15周人T细胞嵌合比例为(33.53±8.57)%。人CD4+ T(CD3+CD4+)细胞和人CD8+ T(CD3+CD8+)细胞在人源化小鼠外周血中均能被检测到;与人类外周血类似,人源化小鼠外周血中人CD4+ T细胞和CD8+ T细胞比例也约为1:4。见图 1。

|
| 图 1 小鼠人源化重建后外周血中人免疫细胞百分比 Fig. 1 Percentages of human immune cells in peripheral blood of mice after humanization |
|
|
移植后15周时,通过皮下注射在人源化小鼠身上接种人A375黑色素瘤细胞,并定期测量肿瘤生长情况。所接种的A375细胞在人源化小鼠中逐渐生长。人肿瘤细胞在前18天生长较为缓慢,随后快速生长。见图 2。

|
| 图 2 人源化小鼠接种A375细胞后人黑色素瘤生长曲线 Fig. 2 Growth curve of human melanoma in humanized mice after inoculated with A375 cells |
|
|
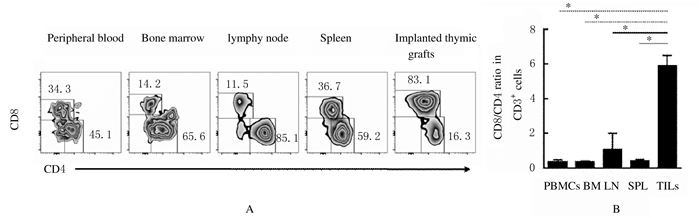
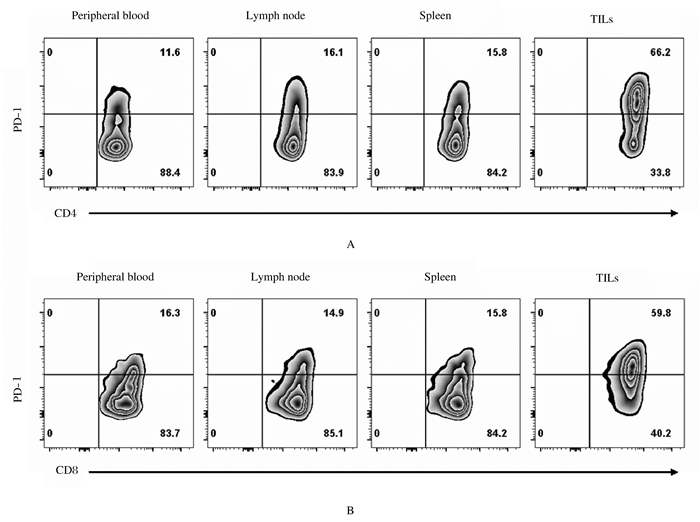
接种A375细胞6周后处死小鼠,采用流式细胞术和免疫组织化学法检测人肿瘤组织和小鼠免疫器官中人免疫细胞组成情况,结果显示:人源化小鼠外周血、骨髓、淋巴结和脾脏组织中均可发现高水平人CD45+免疫细胞嵌合;其中,人免疫细胞主要为CD3+ T细胞和CD20+B细胞,也有少量CD33+髓系细胞及CD56+ NK细胞。人黑色素瘤组织中也有大量CD45+人免疫细胞(86.62%±4.97%),其成分绝大多数为人CD3+ T细胞,几乎检测不到人B细胞、髓系细胞和NK细胞(图 3)。人CD8+/CD4+ T细胞比值:肿瘤组织中CD8+/CD4+T细胞比值明显高于其他组织(F= 21.19, P < 0.01);亚组分析发现:肿瘤组织局部CD8+/CD4+T细胞比值明显高于外周血、骨髓、淋巴结和脾脏组织(P < 0.01),而其他组织之间CD8+/CD4+ T细胞比值比较差异无统计学意义(P>0.05)。见图 4。检测人源化小鼠外周血和肿瘤组织中T细胞上PD-1分子表达显示:肿瘤浸润CD4+ T细胞和CD8+ T细胞表面的PD-1分子表达比例高于其在外周血、淋巴结和脾脏中的水平。见图 5。

|
| A:Peripheral blood; B:Bone marrow; C:Lymph nodes; D:Spleen; E:Implanted thymic grafts; F: TILs. 图 3 人源化小鼠接种A375细胞后免疫器官和肿瘤组织中人免疫细胞的组成 Fig. 3 Compositions of human immune cells in immune organs and tumor tissue of humanized mice after inoculated with A375 cells |
|
|
|
| A: Representative flow cytometric profiles of CD8+/CD4+ ratios; B: Summarized results of CD8+/CD4+ ratios.*P < 0.01 vs TILs. 图 4 人源化小鼠接种A375细胞后免疫器官和肿瘤组织中CD8+/CD4+T细胞比值 Fig. 4 Ratios of CD8+/CD4+ Tcells in immune organs and tumor tissue of humanized mice after inoculated with A375 cells |
|
|
|
| A: CD4+T cells; B: CD8+T cells. 图 5 人源化小鼠接种A375细胞后淋巴组织和肿瘤组织中T细胞上PD-1分子的表达 Fig. 5 Expressions of PD-1 molecule on human T cells in lymphoid tissue and tumor tissue of humanized mice after inoculated with A375 cells |
|
|
通过在免疫缺陷小鼠上移植人造血干细胞和(或)人免疫组织能够在小鼠体内重建人类的免疫系统,该类人源化小鼠模型已在国际上广泛应用于诸多人免疫系统相关疾病的研究中[6-9]。随着肿瘤免疫治疗热潮的兴起,基础研究和生物医药工业开始将目光投向对人源化小鼠在肿瘤领域的应用[10-12]。人源化小鼠模型可通过多种方式进行构建,例如直接注射人外周血单核细胞(peripheral blood mononuclear cells, PBMCs)的PBL-SCID模型[13-14]、通过给新生免疫缺陷小鼠移植人造血干细胞建立的人免疫系统(human immune system,HIS)小鼠模型[15-17]和本课题组所应用的通过人胚胎胸腺组织和人CD34+胎肝细胞联合移植建立的人源化小鼠模型。与前两类模型比较,本课题所采用人源化小鼠模型有以下优点:①该人源化小鼠具有很好的人胸腺发育,且人T细胞在人胸腺组织中经过HLA分子介导的阳性选择发育而来,能够产生高效的HLA依赖的抗原特异性免疫反应;②淋巴结发育较好,能够介导抗原特异性的体液免疫反应;③肠道中人免疫细胞重建良好。因此,该人源化小鼠模型被认为是当前研究人免疫系统相关问题的最佳模型之一。然而,该人源化小鼠也有一些缺点,主要表现为由于某些淋巴因子在小鼠和人类之间缺乏交叉反应(交叉反应性弱)导致的部分免疫细胞(DC细胞、巨噬细胞和NK细胞)重建水平和功能较弱。本研究结果显示:虽然总的人免疫细胞嵌合比例很高,但人CD33+髓系细胞和CD56+NK细胞在免疫组织中比例很低,但这些缺点已经可以通过相应手段(使用人细胞因子转基因小鼠或注射人细胞因子)进行改善。
本研究通过在已有人免疫系统重建的人源化小鼠模型中接种人A375黑色素瘤细胞,建立了同时具有人免疫系统和人黑色素瘤生长的人源化小鼠模型,但该模型中人免疫系统和人黑色素瘤为不同供体来源,其HLA分子并不匹配。因此人源化小鼠中的人免疫系统会对人黑色素瘤生长有一定抑制作用,这也解释了为何黑色素瘤早期生长速度较慢,而当肿瘤长大(形成抑制性肿瘤微环境)后生长速度才显著加快。人体免疫系统中,CD8+T细胞具有很强的杀伤肿瘤的能力,免疫原性高的肿瘤组织中常能检测到高水平的CD8+T细胞浸润[18]。与该现象类似,本研究结果显示:肿瘤组织中CD8+/CD4+T细胞比值明显高于其在外周血和淋巴组织中的水平。上述结果表明人源化小鼠肿瘤组织中浸润有大量具有抗肿瘤能力的CD8+T细胞。本文作者发现:这些肿瘤浸润CD4+T和CD8+T细胞表面均有高水平的PD-1分子表达。这一方面解释了为何肿瘤组织中浸润大量人T细胞仍然能够逃逸免疫攻击而快速生长,也表明本研究所建立的具有人免疫系统和异体黑色素瘤的人源化小鼠模型可用于PD-1等免疫检查点阻断剂的功能评价。
由于人免疫细胞对异体肿瘤组织的免疫攻击与人体肿瘤抗原特异性T细胞的抗肿瘤作用并不完全一致,该模型尚不能完全模拟肿瘤患者体内的生理和病理过程,且该模型不适于血液系统肿瘤(白血病和淋巴瘤)的免疫治疗研究。因此,开发具有人免疫系统和同源人肿瘤的人源化小鼠模型是该领域的趋势之一。本实验室近期通过将致癌基因(MLL-AF9)导入人CD34+造血干细胞,并结合免疫系统人源化小鼠模型,建立同时具有人免疫系统和同源急性淋巴细胞白血病发生的人源化小鼠模型,并将该模型应用于受体淋巴细胞输注[19]和CAR-T等免疫治疗的研究中[20]。因此,本研究中人源化小鼠模型将在人类肿瘤免疫学研究和肿瘤免疫治疗转化应用领域发挥重要作用。
| [1] | BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.v68.6 |
| [2] | LAN P, TONOMURA N, SHIMIZU A, et al. Reconstitution of a functional human immune system in immunodeficient mice through combined human fetal thymus/liver and CD34+ cell transplantation[J]. Blood, 2006, 108(2): 487–492. DOI:10.1182/blood-2005-11-4388 |
| [3] | SHULTZ L D, BREHM M A, GARCIA-MARTINEZ J V, et al. Humanized mice for immune system investigation:progress, promise and challenges[J]. Nat Rev Immunol, 2012, 12(11): 786–798. DOI:10.1038/nri3311 |
| [4] | COVASSIN L, JANGALWE S, JOUVET N, et al. Human immune system development and survival of non-obese diabetic (NOD)-scid IL2γ(null) (NSG) mice engrafted with human thymus and autologous haematopoietic stem cells[J]. Clin Exp Immunol, 2013, 174(3): 372–388. DOI:10.1111/cei.2013.174.issue-3 |
| [5] | DE LA ROCHERE P, GUIL-LUNA S, DECAUDIN D, et al. Humanized mice for the study of immuno-oncology[J]. Trends Immunol, 2018, 39(9): 748–763. DOI:10.1016/j.it.2018.07.001 |
| [6] | HU Z, XIA J X, FAN W, et al. Human melanoma immunotherapy using tumor antigen-specific T cells generated in humanized mice[J]. Oncotarget, 2016, 7(6): 6448–6459. |
| [7] | HU Z, VAN ROOIJEN N, YANG Y G. Macrophages prevent human red blood cell reconstitution in immunodeficient mice[J]. Blood, 2011, 118(22): 5938–5946. DOI:10.1182/blood-2010-11-321414 |
| [8] | HU Z, YANG Y G. Full reconstitution of human platelets in humanized mice after macrophage depletion[J]. Blood, 2012, 120(8): 1713–1716. DOI:10.1182/blood-2012-01-407890 |
| [9] | SAMAL J, KELLY S, NA-SHATAL A, et al. Human immunodeficiency virus infection induces lymphoid fibrosis in the BM-liver-thymus-spleen humanized mouse model[J]. JCI Insight, 2018, 3(18): e120430. DOI:10.1172/jci.insight.120430 |
| [10] | BUROVA E, HERMANN A, WAITE J, et al. Characterization of the anti-PD-1 antibody REGN2810 and its antitumor activity in human PD-1 knock-in mice[J]. Mol Cancer Ther, 2017, 16(5): 861–870. DOI:10.1158/1535-7163.MCT-16-0665 |
| [11] | WANG M, YAO L C, CHENG M, et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy[J]. FASEB J, 2018, 32(3): 1537–1549. DOI:10.1096/fj.201700740R |
| [12] | ROSATO R R, DAVILA-GONZALEZ D, CHOI D S, et al. Evaluation of anti-PD-1-based therapy against triple-negative breast cancer patient-derived xenograft tumors engrafted in humanized mouse models[J]. Breast Cancer Res, 2018, 20(1): 7–16. DOI:10.1186/s13058-018-0935-9 |
| [13] | MOSIER D E, GULIZIA R J, BAIRD S M, et al. Transfer of a functional human immune system to mice with severe combined immunodeficiency[J]. Nature, 1988, 335(6187): 256–259. DOI:10.1038/335256a0 |
| [14] | KING M A, COVASSIN L, BREHM M A, et al. Human peripheral blood leukocyte non-obese diabetic-severe combined immunodeficiency interleukin-2 receptor gamma chain gene mouse model of xenogeneic graft-versus-host-like disease and the role of host major histocompatibility complex[J]. Clin Exp Immunol, 2009, 157(1): 104–118. DOI:10.1111/cei.2009.157.issue-1 |
| [15] | TRAGGIAI E, CHICHA L, MAZZUCCHELLI L, et al. Development of a human adaptive immune system in cord blood cell-transplanted mice[J]. Science, 2004, 304(5667): 104–107. DOI:10.1126/science.1093933 |
| [16] | SHULTZ L D, LYONS B L, BURZENSKI L M, et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells[J]. J Immunol, 2005, 174(10): 6477–6489. DOI:10.4049/jimmunol.174.10.6477 |
| [17] | WATANABE Y, TAKAHASHI T, OKAJIMA A, et al. The analysis of the functions of human B and T cells in humanized NOD/shi-scid/gammac(null) (NOG) mice (hu-HSC NOG mice)[J]. Int Immunol, 2009, 21(7): 843–858. DOI:10.1093/intimm/dxp050 |
| [18] | LI H J, VAN DER LEUN A M, YOFE I, et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma[J]. Cell, 2019, 176(4): 775–789. DOI:10.1016/j.cell.2018.11.043 |
| [19] | XIA J X, HU Z, YOSHIHARA S, et al. Modeling human leukemia immunotherapy in humanized mice[J]. EBio Med, 2016, 10(1): 101–108. |
| [20] | JIN C H, XIA J X, RAFIQ S, et al. Modeling anti-CD19 CAR T cell therapy in humanized mice with human immunity and autologous leukemia[J]. EBio Medicine, 2019, 39: 173–181. |
 2019, Vol. 45
2019, Vol. 45


