扩展功能
文章信息
- 曹赢坤, 刘利平, 马小山, 叶国炜, 姜一宁, 白世琦, 李蕴潜
- CAO Yingkun, LIU Liping, MA Xiaoshan, YE Guowei, JIANG Yining, BAI Shiqi, LI Yunqian
- 婴儿左侧颞部低度恶性肌纤维母细胞肉瘤1例报告及文献复习
- Left temporal low-grade myofibroblastic sarcoma of infant: A case report and literature review
- 吉林大学学报(医学版), 2019, 45(03): 705-708
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 705-708
- 10.13481/j.1671-587x.20190341
-
文章历史
- 收稿日期: 2019-01-04
低度恶性肌纤维母细胞肉瘤(low-grade myofibroblastic sarcoma, LGMS)是一种罕见肿瘤,1988年由MENTZEL等[1]首次发现并描述。随后,LGMS被WHO归类于《国际肿瘤疾病分类》软组织和骨骼肿瘤分类。LGMS是一种间叶组织源性的梭形细胞瘤,表现为肌纤维母细胞分化。LGMS一般为低度恶性,具有局部复发的倾向,头部和颈部多发,很少发生远处转移[1-4]。LGMS患者多为成年人,既往报道年龄最小患者为2岁[5]。目前发生于婴儿且侵及颅内的LGMS病例未见报道。2017年2月13日本科收治1例4月龄左侧颞部LGMS并侵及颅内的患儿,本文作者结合文献报道如下。
1 临床资料 1.1 一般资料患儿,男性,4月龄,因发现左侧颞部肿物20余天于2017年2月13日就诊于本科。皮下肿物约1元硬币大小,质韧,活动度差,局部皮肤无红肿,无破溃。无突眼、流泪、眼睑活动异常和眼球活动受限等症状,病程中患儿一般状态良好。入院查体:生命体征正常,生长发育和营养状况符合同龄儿,左侧颞部可见1个圆形皮下肿物,直径约为2.5cm,质韧,活动度差,局部皮肤无红肿,无破溃。其余各系统查体未见明显异常。
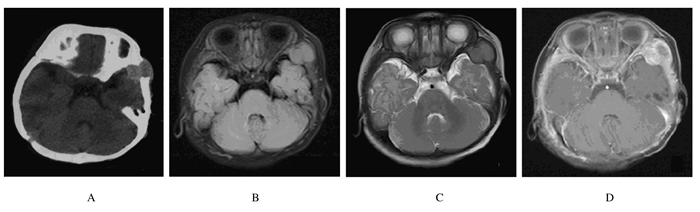
1.2 辅助检查头部CT提示:左侧颞部皮下占位性病变,CT值约为20~40 Hu,大小约为2.0 cm×2.0 cm×2.0 cm,病变侵破颞骨进入颅内(图 1A)。头部MRI平扫+增强提示:左侧颞骨局部见不规则结节状影,病变侵入颅内,但与周围脑组织边界尚清,大小约为1.9 cm×1.6 cm×2.0 cm,T1WI、T2WI和FLAIR均呈等信号,增强扫描呈不均匀强化(图 1B~D)。
|
| 图 1 LGMS患者术前头部CT影像(A)和MRI影像(B~D) Fig. 1 CT(A) and MRI images of(B-D) of head of LGMS patient before operation |
|
|
手术在全麻下进行,取发迹线内左侧冠状切口,切开颞肌后见肿物。肿物无明显包膜,与颞肌无粘连,但与颞骨、硬膜粘连较紧密,剖面呈灰白色,鱼肉状易碎组织,颅内外肿物全切后可见硬膜完整。严密止血后以生理盐水冲洗术区,颅骨缺损未予修补,缝皮术终。免疫组织化学检测结果:Ki-67(+10%),Vimentin(+),SMA(+),Desmin(-),Calponin(-),MyoD1(-),Myogenin(-),AE1/AE3(-),CD31(-),CD34(-),H-caldesmon(-),S-100(-),见图 2(封三)。术后病理:左侧颞部低度恶性间叶源性肿瘤,结合免疫组织化学结果考虑为LGMS(WHO:Ⅰ级)。其内可见大量梭型呈鱼骨样排列的肿瘤细胞,轻度异型,核分裂像1~6个/10HPF,偶见小灶状坏死,局部间质纤维化及胶原变形,肿瘤细胞破坏骨组织,可见残存的骨小梁,未见炎性细胞浸润。

|
| 图 2 LGMS患者肿瘤组织大体形态(A)和HE染色(B)、SMA染色(C)及Vimentin染色(D)形态表现(×200) Fig. 2 General morphology(A), results of HE staining(B), SMA staining (C), and Vimentin staining(D) of tumor tissue of LGMs patients (×200) |
|
|
病理诊断:LGMS。患儿术后无神经系统阳性体征,切口愈合良好,未接受放、化疗等辅助治疗。术后3个月复查头颅MRI显示肿瘤全切除(图 3),未见肿瘤残余及复发。随访16个月,未见LGMS复发或转移。

|
| 图 3 LGMS患者术后3个月头部MRI影像 Fig. 3 MRI image of LGMS patient 3 months after operation |
|
|
LGMS是由肌成纤维细胞构成的恶性软组织肿瘤,患者平均年龄为40岁,多为成年男性[3],既往文献[5]报道:年龄最小的LGMS患者是2岁,尚无有关婴儿罹患该病的报道。LGMS多见于头颈部(尤其是舌与咽喉部)和四肢软组织,除此之外也可见于全身的各个组织和器官[6-11],但同时累及颅内外者尚未见报道。
LGMS通常表现为缓慢生长的无痛性肿块,一些患者可能出现发热、寒战、白细胞增多或脑膜刺激[12]。LGMS具有一定的侵袭性[13],但极少出现转移[14]。在某些情况下,LGMS具有不完整的包膜,可能浸润邻近的纤维组织、脂肪或骨骼肌[15]。本例患者除无痛性增长的包块,未见其他特异性症状和体征,但由于患者年龄小且尚处在生长发育阶段,病程相对较短。且发病于颞部,侵蚀颅骨,未见全身转移,符合既往研究所报道的LGMS生长特点。既往报道的LGMS病例,CT一般可见界限清楚的肿块,呈软组织密度影,且可见不同程度增强;MRI、T1WI和T2WI一般为等信号或稍高信号肿块,可见不均匀强化,18FDG-PET-CT可见肿块FDG摄取,但缺乏特异性征象[13, 16-17]。影像学检查对于发现占位以及指导手术具有临床价值。
尽管本病术后有原位复发倾向[5],但手术切除仍是主要的治疗手段[6]。术中将肿瘤全切并在必要时选择扩大切除可能有助于减少肿瘤的术后复发率[6]。放、化疗对本病的疗效尚不明确,甚至有学者[9]认为术后放疗可能会导致该病复发。因此术后应慎行放、化疗。本例患者在影像学检查后,接受手术治疗切除肿瘤,术后未接受放、化疗。既往报道LGMS预后一般较好,一项基于人群的研究[6]显示:LGMS的5年总生存率为71.6%,疾病特异性生存率为76.3%;多因素回归分析显示:只有年龄较大与较差的生存率显著相关。本例患者术后随访16个月,未见残余肿瘤或肿瘤原位复发,但未来仍需长期随访。
病理诊断和免疫组织化学检测是LGMS诊断的金标准。镜下可见大量的肌纤维母细胞呈弥漫性、浸润性生长,界限不清,细胞质呈嗜酸性,梭形核,核仁小而不明显,核异型性较轻,核分裂象数为1~6个/10 HPF,肿瘤细胞位于胶原基质中,通常伴有明显的玻璃样变。肿瘤侵犯骨组织,可见残存的骨小梁。肿瘤组织中无或偶见炎性细胞浸润。免疫组织化学结果显示:几乎所有患者的Vimentin染色为阳性,同时至少还有1个肌源性标记物(Desmin、SMA、MSA和Actin等)染色为阳性[1]。在电镜下可见到肌纤维母细胞的超微结构特点[1]。在结节性筋膜炎、颅筋膜炎、炎症性肌纤维母细胞瘤和婴儿肌纤维瘤等病变中也可见到肌纤维母细胞,但在结节性筋膜炎、颅筋膜炎和炎症性肌纤维母细胞瘤中均有明显的炎性细胞浸润,而婴儿肌纤维瘤是血管周围肌样分化肿瘤,在镜下可见特异性的血管外皮瘤样结构[18],有助于与LGMS相鉴别。基因检测可能有助于诊断LGMS,但尚无确切结论[19]。本例患者的病理诊断符合既往报道的LGMS病理特点,但未进行相关基因检测。
本文作者报道了1例罕见的4月龄左侧颞部LGMS患者的临床诊治过程。患者因发现生长性皮下肿物就诊,肿物在影像学上表现为侵袭性生长,为防止肿物向颅内进一步生长影响到患儿中枢神经系统,在排除手术禁忌证后积极行手术治疗,术中将肿瘤全部切除。患儿术后恢复良好。组织病理和免疫组织化学结果符合LGMS病理学特点。考虑患儿年龄尚小,且放、化疗对该病治疗效果均不明确,术后未给予放、化疗治疗,建议定期复查头部CT或MRI,观察有无原位复发或转移。患儿预后良好,手术后随访16个月无复发。LGMS诊断仍面临许多挑战,特别是在区分低度恶性病变与中度恶性病变时。基因诊断可能是LGMS诊断和术后随访的有效方法,但该方法的效果需进行进一步评估。
| [1] | MENTZEL T, DRY S, KATENKAMP D, et al. Low-grade myofibroblastic sarcoma:analysis of 18 cases in the spectrum of myofibroblastic tumors[J]. Am J Surg Pathol, 1998, 22(10): 1228–1238. DOI:10.1097/00000478-199810000-00008 |
| [2] | CAI C, DEHNER L P, EL-MOFTY S K. In myofibroblastic sarcomas of the head and neck, mitotic activity and necrosis define grade:a case study and literature review[J]. Virchows Arch, 2013, 463(6): 827–836. DOI:10.1007/s00428-013-1494-1 |
| [3] | QIU J Y, LIU P, SHI C, et al. Low-grade myofibroblastic sarcomas of the maxilla[J]. Oncol Lett, 2015, 9(2): 619–625. DOI:10.3892/ol.2014.2790 |
| [4] | YAMADA T, YOSHIMURA T, KITAMURA N, et al. Low-grade myofibroblastic sarcoma of the palate[J]. Int J Oral Sci, 2012, 4(3): 170–173. DOI:10.1038/ijos.2012.49 |
| [5] | ZHANG S, MA Y, MA T, et al. Low-grade myofibroblastic sarcoma of the orbit:A case report and literature review[J]. Medicine (Baltimore), 2017, 96(51): e9172. DOI:10.1097/MD.0000000000009172 |
| [6] | CHAN J Y, GOOI Z, WONG E W, et al. Low-grade myofibroblastic sarcoma:A population-based study[J]. Laryngoscope, 2017, 127(1): 116–121. DOI:10.1002/lary.26146 |
| [7] | PENG L, TU Y, LI Y, et al. Low-grade myofibroblastic sarcoma of the pancreas:A case report and literature review[J]. J Cancer Res Ther, 2018, 14(Supplement): S796–S799. |
| [8] | NIU R, WANG J F, ZHANG D C, et al. Low-grade myofibroblastic sarcoma of gastric cardia on 18F-FDG positron emission tomography/computed tomography:An extremely rare case report[J]. Medicine (Baltimore), 2018, 97(4): e9720. DOI:10.1097/MD.0000000000009720 |
| [9] | MARUYAMA T, NAKASONE T, NIMURA F, et al. Indolent growth of low-grade myofibroblastic sarcoma of the cheek mimics benign lesions:A case report and literature review[J]. Oncol Lett, 2017, 13(6): 4307–4314. DOI:10.3892/ol.2017.6020 |
| [10] | KATALINIC D, SANTEK F. Giant low-grade primary myofibroblastic sarcoma of the posterior chest wall[J]. World J Surg Oncol, 2017, 15(1): 96. DOI:10.1186/s12957-017-1167-7 |
| [11] | HADJIGEORGIOU G F, SAMARAS V, VARSOS V. Low-grade myofibroblastic sarcoma of the thoracic spine:report of an extreme rare case[J]. Br J Neurosurg, 2017, 31(6): 731–733. DOI:10.1080/02688697.2016.1220505 |
| [12] | NIEDZIELSKA I, JANIC T, MROWIEC B. Low-grade myofibroblastic sarcoma of the mandible:a case report[J]. J Med Case Rep, 2009, 3: 8458. DOI:10.4076/1752-1947-3-8458 |
| [13] | VLAD D, ALBU S. Low-grade myofibroblastic sarcoma of the larynx[J]. J Craniofac Surg, 2016, 27(3): e270–271. DOI:10.1097/SCS.0000000000002499 |
| [14] | SARGAR K M, SHEYBANI E F, SHENOY A, et al. Pediatric fibroblastic and myofibroblastic tumors:A pictorial review[J]. Radiographics, 2016, 36(4): 1195–1214. DOI:10.1148/rg.2016150191 |
| [15] | FISHER C. Myofibrosarcoma[J]. Virchows Arch, 2004, 445(3): 215–223. DOI:10.1007/s00428-004-1038-9 |
| [16] | HAN S R, YEE G T. Low grade myofibroblastic sarcoma occurred in the scalp[J]. J Korean Neurosurg Soc, 2015, 58(4): 385–388. DOI:10.3340/jkns.2015.58.4.385 |
| [17] | GHOSH A, BANDOPADHYAY A, SARKAR R. Low-grade myofibroblastic sarcoma of maxillary sinus and buccal mucosa:Two rare cases and review of the literature[J]. Indian J Pathol Microbiol, 2019, 62(1): 119–121. DOI:10.4103/IJPM.IJPM_99_18 |
| [18] | LARRALDE M, FERRARI B, MARTINEZ J P, et al. Infantile myofibromatosis[J]. An Bras Dermatol, 2017, 92(6): 854–857. DOI:10.1590/abd1806-4841.20175001 |
| [19] | MIKAMI Y, FUJⅡ S, KOHASHI K I, et al. Low-grade myofibroblastic sarcoma arising in the tip of the tongue with intravascular invasion:A case report[J]. Oncol Lett, 2018, 16(3): 3889–3894. |
 2019, Vol. 45
2019, Vol. 45


