扩展功能
文章信息
- 杜雅彦, 刘洋, 卢沐, 怀施涛, 吕作利, 魏育涛
- DU Yayan, LIU Yang, LU Mu, HUAI Shitao, LYU Zuoli, WEI Yutao
- 冠心病患者心外膜脂肪组织和血浆中脂联素相关miR-371b-5p表达及其对脂肪细胞因子分泌的影响
- Expressions of adiponectin-related miR-371b-5p in epicardial adipose tissue and plasma of patients with coronary heart disease and its effect on secretion of adipocytokines
- 吉林大学学报(医学版), 2019, 45(03): 643-650
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 643-650
- 10.13481/j.1671-587x.20190329
-
文章历史
- 收稿日期: 2018-08-08
2. 首都医科大学附属朝阳医院京西院区急诊科, 北京 100020;
3. 石河子大学医学院附属第一医院心胸外二科, 新疆 石河子 832008;
4. 广东省第二人民医院心胸外科, 广东 广州 510000
2. Department of Cardiothoracic Surgery, Guangdong Second Provincial General Hospital, Guangzhou 510000, China;
3. Affiliated Beijing Chaoyang Hospital, Capital University of Medical Sciences, Beijing 100020, China;
4. Second Department of Thoracic and Cardiovascular Surgery, First Affiliated Hospital, School of Medical Sciences, Shihezi University, Shihezi 832008, China
冠心病(coronary artery disease, CAD)是欧洲发达国家导致死亡的主要因素。冠心病的风险包括脂质紊乱、高血压、吸烟、肥胖、糖尿病和性别(男性)。内脏(腹部脂肪)沉积物比下身脂肪沉积物更有害。心外膜脂肪组织(epicardial adipose tissue, EAT)是一种沉积在心肌组织表面的独特的内脏脂肪库,在代谢综合征的进展中起重要作用。研究[1]表明:EAT产生几种生物活性分子,如抗炎和促炎介质及细胞因子,这可能会明显增强旁分泌对心脏功能的影响或形成影响许多生理过程的各种效应,可能会对心脏功能产生影响。微小RNA(miRNAs)是一类长度约为22个核苷酸的单链非编码RNA[2],其通过与靶基因互补位点结合的方式调控基因的表达并调控多种疾病发生发展。近年研究[3]显示:miRNAs在CAD发病机制的各个环节中均起作用,检测与CAD有关的miRNA表达谱可为CAD的早期诊断提供新的依据,为CAD的治疗提供新的靶点。人类miR-371b-5p的编码基因位于19q13.42,属于miR-371簇,miR-371b-5p表达异常可诱发多种疾病的发生发展。miR-371b-5p高度保守,在肝细胞癌、鼻咽癌、前列腺癌和狼疮性肾炎中高表达,但其与CAD关系的相关研究国内外少见报道。研究[4]显示:miR-371和miR-369-5p能分别促进和抑制间充质干细胞的成脂分化,并且伴随着某些脂肪细胞的关键分子的基因—脂联素(adiponectin,APN,又称ADIPOQ)与脂肪酸结合蛋白4(atty acid-binding protein 4,FABP4)表达的变化,提示miR-371和miR-369-5p与脂肪细胞成脂分化有密切关系,并且该分化过程是通过调控ADIPOQ和FABP4的表达量实现的。
上述研究在人间充质细胞中验证了miR-371对成脂分化的促进作用,但其对CAD发生发展影响的具体机制尚不明确。本课题组[5]前期通过芯片筛选发现:在CAD患者EAT中脂联素相关miR-371b-5p高表达。本研究观察CAD和非冠心病患者EAT及血液中miR-371b-5p的表达, 在体外从细胞水平通过miR-371b-5p过表达脂质体转染诱导成熟的3T3-L1脂肪细胞,探讨其对脂肪细胞的可能作用机制,为CAD的治疗提供实验依据。
1 资料与方法 1.1 临床资料收集2016年3月—2017年6月在石河子大学医学院附属第一医院心胸外二科行冠状动脉旁路移植术的34例CAD患者作为CAD组,行瓣膜置换术的16例非CAD患者作为non-CAD组。留取手术当天空腹卧位肘静脉血5 mL,留取血清置于-80℃冰箱保存。开胸后获取右室表面约1 gEAT,0.9%氯化钠溶液清洗并去除结缔组织后置于液氮中保存。纳入标准:CAD组和non-CAD组患者年龄为40~75岁,均为汉族;CAD组患者符合CAD的诊断标准,non-CAD组患者冠状动脉造影阴性,需行瓣膜置换手术(瓣膜为退行性变)。排除标准:①并发糖尿病或糖耐量异常者;②患其他类型心脏病,如风湿性心脏病患者;③患有恶性肿瘤者;④近期有创伤或行外科手术者;⑤急、慢性感染者;⑥长期患肝、肾等脏器疾病及其他内分泌疾病者。手术前根据病历收集所有研究对象的一般资料和化验检查资料,其中,2组患者的年龄、性别、腰围(waist circumference,WC)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、体质量指数(body mass index,BMI)、空腹血糖(fasting plasma glucose, FPG)、总胆固醇(total cholesterol,TC)和甘油三酯(triglycerides,TG)比较差异无统计学意义(P>0.05)。与non-CAD组比较,CAD组患者低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDL-c)和超敏C反应蛋白水平明显升高(P < 0.01),高密度脂蛋白胆固醇(high density lipoproteincholesterol,HDL-c)和ADIPOQ水平明显降低(P < 0.05)。本研究通过新疆石河子大学医学院附属第一医院心胸外二科医院伦理委员会批准(编号:2014-072-01),所有研究对象均签署知情同意书。
1.2 细胞、引物和主要试剂3T3-L1前体脂肪细胞购自中科院上海细胞库。引物和内参均由上海生工公司设计合成,miRNA模拟物及抑制物由上海吉玛制药公司设计合成。RNA提取试剂和qRT-PCR反应试剂盒购自日本TaKaRa公司。
1.3 细胞培养和诱导分化3T3-L1前体脂肪细胞采用含有10% FBS的高糖DMEM培养基,于37℃、5%CO2培养箱中培养。将生长状态良好的3T3-L1前体脂肪细胞经胰酶消化培养,取对数生长期细胞,以每毫升1×106个细胞均匀接种于培养皿,待细胞生长至80%~90%并接触抑制2 d退出对数增长期后,更换为含终浓度为0.5 mmol·L-13-异丁基-1-甲基黄嘌呤(IBMX)、5 mg·L-1胰岛素(INS)和1 μmol·L-1地塞米松(DEX)的细胞分化诱导液诱导2 d后,再更换为含有55 mg·L-1 INS的维持培养基继续培养2 d,每隔2d更换含10% FBS的DMEM培养液。分化7 d后采用油红O染色鉴定诱导效率。
1.4 细胞转染诱导成功的细胞待细胞密度达70%~80%时进行转染。将细胞分为miR-371b-5p过表达组(转染miR-371b-5p模拟物)、抑制剂组(转染miR-371b-5p抑制剂)和空白对照组(不做任何处理)。采用Opti-MEM稀释模拟物和抑制剂,并分别与转染试剂脂质体Lipofectmine 2000按2:1混合均匀,室温放置20 min,使其形成稳定的复合物。再将复合物加入6孔板中,混匀、将6孔板置于37℃、5%CO2细胞培养箱中继续培养。设置3个复皿,转染24 h后收集细胞。
1.5 实时荧光定量PCR(qRT-PCR)法检测qRT-PCR法检测CAD组和non-CAD患者EAT和血浆中miR-371b-5p表达水平以及细胞中白细胞介素6(IL-6)、Kruppel样因子4(KLF4)、单核细胞因子趋化蛋白1(MCP-1)和APN mRNA表达水平。3组细胞转染24 h后,吸出培养液,采用PBS清洗3次,采用日本TaKaRa公司MiniBEST Universal RNA Extraction Kit细胞和组织RNA提取试剂盒提取上述3组细胞的总RNA,提取RNA后使用核酸定量分析仪分析RNA纯度。合格的RNA按照PrimeScriptTMRT reagent Kit with Gdna Eraser试剂盒说明书将RNA反转录合成cDNA,采用Step On荧光定量PCR仪(ABI公司,美国)检测各组细胞中IL-6、KLF4、MCP-1和APN mRNA的相对表达水平。以U6为内参对照基因,采用2-ΔΔCt法表示miR-371b-5p相对于内参基因的相对表达水平。引物序列见表 1。
| Primer name | Primer(5′-3′) | Size(bp) |
| miR-371b-5p | CGA CTC AAA AGA TGG CGG CAC T | 22 |
| Universal reverse primer | GAATCGAGCACCAGTTACGC | 22 |
| APN | F: AGGTTGGATGGCAGGCR: GTCTCACCCTTAGGACCAAGAA | 129 |
| KLF4 | F: CTGAACAGCAGGGACTGTCAR: GTGTGGGTGGCTGTTCTTTT | 218 |
| MCP | F: GTGCTGACCCCAAGAAGGAR: GAGGTGGTTGTGGAAAAGG | 108 |
| IL-6 | F: GTGAAAGCAGCAAAGAGGCAR: TTGGGTCAGGGGTGGTTATT | 78 |
| U6 | F: GCTTCGGCAGCACATATACTAAAATR: CGCTTCACGAATTTGCGTGTCAT | 202 |
选取TargetScan、miRDB、miRTarBase和miRWalk4个靶基因预测软件对差异miRNAs进行综合靶基因预测。为了减少软件预测的假阳性,取至少同时满足2个预测软件的基因作为靶基因。将miR-371b-5p的靶基因输入到DAVID (https://david-d.ncifcrf.gov/)数据库进行GO(Gene Ontology)分析及KEGG(Kyoto Encyclopedia of Genes and Genomes)信号通路分析,通过Fisher Exact Test计算P值。其中GO功能富集分析包括3个部分:分子功能(molecular function,MF)、细胞组件(cell component,CC)以及生物过程(biological process,BP)。采用STRING蛋白质互作网络图数据库(https://string-db.org/)进行靶基因的蛋白互作(protein-protein interaction,PPI)网络分析。
1.7 统计学分析采用SPSS 22.0和GraphPad Prism 7.0统计软件进行统计学分析。CAD患者EAT和血浆中miR-371b-5p的表达水平、患者基本临床数据和细胞中APN、KLF4、IL-6及MCP-1mRNA表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析(LSD法)。以P < 0.05为差异有统计学意义。
2 结果 2.1 qRT-PCR法检测CAD组和non-CAD组患者EAT和血浆中miR-371b-5p表达水平采用qRT-PCR法检测CAD和non-CAD组患者EAT和血浆中miR-371b-5p的表达水平,与non-CAD组比较,CAD组患者EAT和血浆中miR-371b-5p表达水平均升高(P < 0.01)。见表 2。
| Group | n | Expression level of miR-371b-5p | |
| EAT | Plasma | ||
| Non-CAD | 16 | 1.00±0.00 | 1.00±0.00 |
| CAD | 34 | 16.28±0.04* | 2.37±0.05* |
| * P < 0.01 compared with non-CAD group. | |||
3T3-L1前脂肪细胞培养过程中,未诱导分化的3T3-L1细胞呈梭形,胞浆中无脂滴,细胞生长至贴壁面积达70%后,处于生长停滞期;诱导分化7 d后,90%以上细胞均分化成熟,有较多的脂滴聚集。油红O染色结果显示脂肪细胞中的脂滴染成红色。见图 1(插页六)。
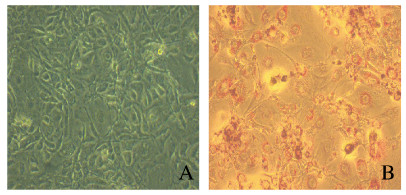
|
| 图 1 鸡尾酒法诱导7 d后3T3-L1前脂肪细胞形态表现(油红O,×200) Fig. 1 Morphology of 3T3-L1 preadipocytes after induction by cocktail method for 7 d (Oil red O, ×200) |
|
|
3组细胞转染24 h后,qRT-PCR法检测3组细胞中IL-6、KLF4、MCP-1和APN mRNA表达水平, 与空白对照组比较,miR-371b-5p过表达组3T3-L1脂肪细胞中APN和KLF4 mRNA表达水平降低(P=0.043,P=0.045),IL-6和MCP-1mRNA表达水平升高(P=0.037,P=0.041),见图 2A;miR-371b-5p抑制剂组3T3-L1脂肪细胞中APN和KLF4 mRNA表达水平升高(P=0.025,P=0.027),IL-6和MCP-1 mRNA表达水平降低(P=0.039,P=0.041),见图 2B。
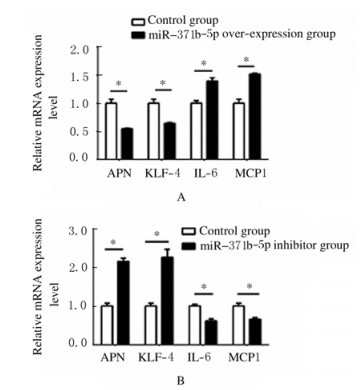
|
| *P < 0.05 compared with control group; A:miR-371b-5p over-expression group; B:miR-371b-5p inhibitor group. 图 2 3组3T3-L1脂肪细胞中APN、KLF4、IL-6和MCP-1 mRNA表达水平 Fig. 2 Expression levels of APN, KLF4, IL-6, and MCP-1 mRNA in 3T3-L1 preadipocytes in various groups |
|
|
选取TargetScan、miRDB、miRTarBase和miRWalk4个靶基因预测软件对miR-371b-5p及APN进行靶向结合预测,两者保守结合位点见图 3。为了减少软件预测的假阳性,取同时满足至少2个预测软件的结果。

|
| 图 3 靶基因预测软件预测miR-371b-5p和APN mRNA 3′-UTR保守结合位点 Fig. 3 Conserved binding sites of miR-371b-5p and APN mRNA 3′-UTR predicted by taget gene prediction software |
|
|
采用DAVID在线分析软件对miR-371b-5p对应靶基因进行GO富集分析结果显示:相关靶基因分别富集于MF,转录激活因子活性,RNA聚合酶Ⅱ核心启动子近端区域序列特异性DNA结合;CC,转录阻遏复合物,线粒体膜间隙;BP,转录,DNA模板化。见表 3。
| Group | GO enrichment analysis | Biological process | P |
| MF | GO:0003714 | Transcription activator activity | < 0.01 |
| MF | GO:0000978 | DNA binding specific to proximal region of RNA polymerase Ⅱ Core promoter | < 0.01 |
| CC | GO:0017053 | Transcriptional repression complex | < 0.01 |
| CC | GO:0005758 | Mitochondrial membrane space | < 0.01 |
| BP | GO:0009617 | Transcription, DNA template | < 0.01 |
KEGG通路富集分析结果显示:miR-371b-5p预测靶基因共参与了11种通路,分别是MAPK信号通路、PI3K-Akt信号通路、mTOR信号通路、胰岛素信号通路、TGF-β信号通路、TNF信号通路、泛素介导的蛋白水解信号通路、胰岛素抵抗信号通路、HIF-1信号通路、Toll样受体信号通路和NF-κB信号通路。以P值的负对数制图,见图 4。
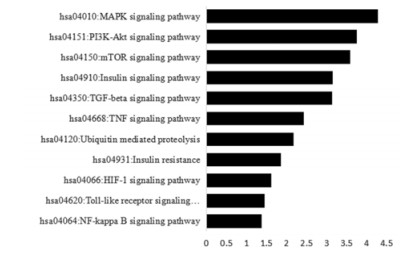
|
| 图 4 miR-371b-5p对应靶基因的KEGG信号通路分析 Fig. 4 Analysis on KEGG signal pathway of miR-371b-5p target genes |
|
|
通过进一步KEGG信号通路分析显示:miR-371b-5p靶基因主要参与心血管相关信号通路、炎症相关信号通路以及糖代谢相关信号通路等。本研究进一步重点探讨miR-371b-5p的靶基因ADIPOQ(APN)所在的脂肪细胞因子信号通路。见图 5。

|
| 图 5 miR-371b-5p靶基因APN(ADIPQ)在脂肪细胞因子信号通路中的分布 Fig. 5 Distribution of target gene APN (ADIPQ) of miRNA-371b-5p in adipocytokine signaling pathways |
|
|
采用STRING 10软件分析所筛选出的miR-371b-5p靶基因蛋白网络互作图。图中共有28个预测基因的靶蛋白,其相互作用形成了多中心互作网络图。该网络图包括28个节点分别代表 28种蛋白质,节点之间不同颜色的连线代表蛋白质之间相互作用的不同证据种类,结果显示:ADIPOQ(APN)、瘦素(LEP)、AKT1、MAPK10、PPARGC1A、PRKAA1和SLC2A4这7种靶蛋白在维持网络稳定性和相互作用中起到关键性作用,尤其是ADIPOQ、LEP和AKT1处于整个网络的核心位置,与其他靶蛋白相互作用非常密切,因此其编码的蛋白可能是重要的下游靶蛋白。见图 6(插页六)。
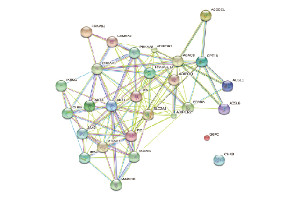
|
| 图 6 PPI预测miR-371b-5p的靶蛋白互作网络图 Fig. 6 Target protein interaction network map of mi-371b-5p predicted by PPI |
|
|
21世纪以来,CAD是欧洲、美国以及亚洲国家导致死亡的最主要原因,占世界死亡人数的近三分之一。CAD的发生发展与脂代谢紊乱密切相关。EAT是一种位于心肌和心包脏层之间独特的内脏脂肪组织,EAT和心肌具有相同的微循环,这表明这2种结构之间有紧密的相互作用[6]。在生理条件下,EAT保护和支持心脏发挥正常功能。有研究[7]表明:EAT厚度是CAD的独立危险因素,其厚度和代谢活性与CAD的严重程度呈正相关关系,在CAD患者中,增厚的EAT可能通过分泌促炎性细胞因子和其他机制促进斑块的发展。本课题组前期研究[8]结果显示:CAD患者EAT厚度增加,EAT中APN表达水平降低。
APN是一种脂肪细胞衍生的因子,对不同类型细胞具有提高胰岛素敏感性、抗脂毒性、抗凋亡和抗炎作用,被认为是具有保护作用的生物活性蛋白质。具体表现:①循环中APN水平与冠状动脉狭窄程度呈正相关关系,是冠状动脉严重程度的重要标志;②APN通过升高巨噬细胞中IL-10的表达促进金属蛋白酶1组织抑制剂的产生,从而有助于动脉粥样硬化斑块的稳定[9];③APN通过促进巨噬细胞向其炎性M2状态的极化,减弱血管炎症反应[10];④APN抑制单核细胞与TNF-α刺激的内皮细胞黏附促进内皮细胞健康,减弱内皮炎症并最终抑制动脉粥样硬化的发生[11];⑤APN可以通过降低氧化应激来保护主动脉免受动脉粥样硬化损伤,并且减少主动脉根部的病变形成尺寸并降低血清中TC、TG和LDL-c水平[12]。APN通过直接影响血管成分细胞(巨噬细胞、内皮细胞和平滑肌细胞)的行为来预防动脉粥样硬化进展。本研究通过预测发现:CAD患者EAT中高表达的miR-371b-5p靶向调控APN表达,本研究以miR-371b-5p为切入点,观察miR-371b-5p对APN的调控以及对脂肪细胞因子KLF4、IL-6和MCP-1表达的影响,初步探讨miR-371b-5p对CAD发生发展的影响。
miRNAs是一种具有调节功能的RNA,通过与对应的靶信使RNA(mRNA)3′-UTR特异性结合来直接降解靶mRNA,从而抑制靶mRNA的翻译,进行基因的转录后水平调控。miRNAs在脂肪组织中表达有差异,因此被认为是代谢紊乱、CAD、2型糖尿病诊断和治疗潜在的生物学标志物[13]。研究[14]显示:miR-323-3p靶向调控APN,抑制其mRNA的表达,从而引起胰岛素抵抗;miR-375通过3′-UTR结合位点靶向抑制细胞中APN表达,从而增加脂肪细胞因子和炎症因子的表达[15]。miR-143可通过PPARγ途径对脂肪细胞APN分泌和表达产生影响[16]。本课题组前研究芯片筛选出CAD患者EAT中miR-371b-5p表达具有差异性(P<0.05,Fold change>2)。本实验进一步通过qRT-PCR验证:与non-CAD组比较,CAD组患者EAT和血浆中miR-371b-5p呈高表达;生物信息学预测:CAD患者EAT中高表达的miR-371b-5p调控APN,从而引起脂代谢紊乱和炎症。以上实验结果提示:miR-371b-5p可能参与CAD患者EAT代谢紊乱的发病机制,miR-371b-5p与CAD的发生发展密切相关。
动脉粥样硬化是动脉血流中内皮层紊乱、单核细胞迁移至血管壁并分化为巨噬细胞及泡沫细胞的炎性反应,动脉粥样硬化的发生发展与一系列因子密切相关,如APN、KLF4、IL-6和MCP-1。KLF4是一类具有锌指结构的转录因子,能够激活IL-10基因的表达,起到抗炎作用[17]。IL-6是由多种类型细胞产生的炎症因子,主要通过其介导的信号通路促进炎症反应[18]。MCP-1也称为趋化因子(CC基序)配体2(CCL2),是一种可以活化单核细胞、巨噬细胞和淋巴细胞的趋化因子。MCP-1参与炎症、伤口愈合、纤维化和血管形成过程[19]。
本课题组前期研究[8, 20]显示:CAD患者EAT厚度增加,CAD患者血清及EAT中APN水平较非CAD患者降低。本研究结果表明:miR-371b-5p调控APN的表达,并且体外细胞实验中转染miR-371b-5p模拟物后,与空白对照组比较,3T3-L1脂肪细胞分泌的APN和KLF4表达水平降低,IL-6和MCP-1表达水平升高;转染miR-371b-5p抑制剂后,APN和KLF4表达水平升高,IL-6和MCP-1表达水平降低;上述结果提示:CAD患者EAT中miR-371b-5p抑制APN的表达,而APN的表达被抑制可能引起EAT中脂代谢紊乱,继而促进脂肪组织炎症因子的表达。
生物信息学分析显示:miR-371b-5p靶基因的GO功能主要富集于转录激活因子活性、RNA聚合酶Ⅱ核心启动子正调控、线粒体间信号传导、特异性DNA结合和转录和DNA模板化等生物学过程。KEGG通路富集分析结果显示:miR-371b-5p相关的主要信号通路分别是脂肪细胞因子信号通路、PI3K/Akt信号通路、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路和TNF信号通路。脂肪细胞因子信号通路中APN、LEP和TNF-α位于上游,这3种因子均参与CAD的发生发展。LEP是一种脂肪细胞分泌的激素,能调节能量稳态,减少能量摄入并增加能量消耗,能够抑制肥胖,延缓CAD发生[21]。TNF-α是已知的促炎性细胞因子,在慢性炎症性疾病的发病中具有关键作用。有研究[22]表明:TNF-αG-308A多态性与胆固醇、TG、TNF-α水平独立相关,可能导致北印度人CAD的发展。磷脂酰肌醇3-激酶(PI3Ks)信号通路通过磷酸化多种酶、激酶和转录因子等下游因子,进而调节肿瘤细胞的增殖、存活和侵袭转移等功能[23]。mTOR是PI3K/Akt下游的一种重要的丝氨酸-苏氨酸蛋白激酶,其整合细胞外多种信号刺激,参与体内多条信号通路,影响转录及蛋白质合成,并且与细胞凋亡、自噬和生长等均有重要联系[24]。PPI图显示:APN、LEP和AKT1处于核心位置,与其他靶蛋白紧密互作,miR-371b-5p主要调控的靶蛋白可能就是其编码的。CAD的发生发展不仅与这3个关键蛋白相关,还与靶蛋白之间的相互作用相关。由以上生物信息学分析可推测miR-371b-5p通过调控APN、LEP和AKT1,参与脂肪细胞因子、mTOR和TNF-α等心血管相关以及炎症相关信号通路,调控脂肪组织发育等生物学过程,引起脂代谢及炎症代谢紊乱,从而影响CAD的发生发展,但其具体机制有待进一步研究。靶蛋白APN参与调控脂肪细胞因子分泌和炎症因子表达,发挥抗炎及抗动脉粥样硬化作用。CAD心外膜脂肪组织中miR-371b-5p表达增加的具体机制有待进一步研究。
综上所述,在CAD患者EAT中,脂代谢紊乱可能间接引起miR-371b-5p高表达,而miR-371b-5p靶向调控APN,并通过脂肪细胞因子信号通路、PI3K/Akt信号通路、mTOR信号通路以及TNF信号通路影响KLF4、IL-6和MCP-1等因子分泌,引起脂代谢及炎症代谢紊乱,从而影响CAD的发生发展。
| [1] | CARVALHO E, LOPASCHUK G D, BØRSHEIM E, et al. Reply to Katlandur, Ozbek, and Keser[J]. Am J Physiol Endocrinol Metab, 2016, 310(10): E863. DOI:10.1152/ajpendo.00113.2016 |
| [2] | VINKHUYZEN AA, WRAY NR, YANG J, et al. Estimation and partition of heritability in human populations using whole-genome analysis methods[J]. Annu Rev Genet, 2013, 47: 75–95. DOI:10.1146/annurev-genet-111212-133258 |
| [3] | PAUL P, CHAKRABORTY A, SARKAR D, et al. Interplay between miRNAs and human diseases[J]. J Cell Physiol, 2018, 233(3): 2007–2018. DOI:10.1002/jcp.v233.3 |
| [4] | BORK S, HORN P, CASTOLDI M, et al. Adipogenic differentiation of human mesenchymal stromal cells is down-regulated by microRNA-369-5p and up-regulated by microRNA-371[J]. J Cell Physiol, 2011, 226(9): 2226–2234. DOI:10.1002/jcp.22557 |
| [5] | LIU Y, FU W, LU M, et al. Role of miRNAs in epicardial adipose tissue in CAD patients with T2DM[J]. BioMed Res Int, 2016, 2016(16): e29236. |
| [6] | IACOBELLIS G. Epicardial and pericardial fat:close, but very different[J]. Obesity (Silver Spring, Md), 2009, 17(4): 625. DOI:10.1038/oby.2008.575 |
| [7] | WU Y, ZHANG A, HAMILTON D J, et al. Epicardial fat in the maintenance of cardiovascular health[J]. Methodist DeBakey Cardiovasc J, 2017, 13(1): 20–24. DOI:10.14797/mdcj-13-1-20 |
| [8] | 魏育涛, 付文博, 刘诚, 等. 心外膜脂肪厚度与冠心病的相关性研究[J]. 临床心血管病杂志, 2014, 30(9): 758–761. |
| [9] | KUMADA M, KIHARA S, OUCHI N, et al. Adiponectin specifically increased tissue inhibitor of metalloproteinase-1 through interleukin-10 expression in human macrophages[J]. Circulation, 2004, 109(17): 2046–2049. DOI:10.1161/01.CIR.0000127953.98131.ED |
| [10] | LOVREN F, PAN Y, QUAN A, et al. Adiponectin primes human monocytes into alternative anti-inflammatory M2 macrophages[J]. Am J Physiol Heart Circ Physiol, 2010, 299(3): H656–663. DOI:10.1152/ajpheart.00115.2010 |
| [11] | MAHADEV K, WU X, DONNELLY S, et al. Adiponectin inhibits vascular endothelial growth factor-induced migration of human coronary artery endothelial cells[J]. Cardiovasc Res, 2008, 78(2): 376–384. |
| [12] | WANG X, PU H, MA C, et al. Adiponectin abates atherosclerosis by reducing oxidative stress[J]. Med Sci Monit, 2014, 20(1): 792–800. |
| [13] | VACCA M, DI EUSANIO M, CARIELLO M, et al. Integrative miRNA and whole-genome analyses of epicardial adipose tissue in patients with coronary atherosclerosis[J]. Cardiovasc Res, 2016, 109(2): 228–239. DOI:10.1093/cvr/cvv266 |
| [14] | WANG X, LI J, TANG W, et al. Adiponectin receptor 1-mediated micro RNA-323-3p regulates functions of the MIN6 cell line via the AMP-activated protein kinase/sirtuin-1 pathway[J]. J Int Med Res, 2018, 46(5): 1693–1708. DOI:10.1177/0300060518758584 |
| [15] | LEI L, ZHOU C, YANG X, et al. Down-regulation of microRNA-375 regulates adipokines and inhibits inflammatory cytokines by targeting AdipoR2 in non-alcoholic fatty liver disease[J]. Clin Exp Pharmacol, 2018, 22(5): e12940. |
| [16] | 刘雅青. IRS-1通过miR-143调节前脂肪细胞分化的作用与机制研究[D].长沙: 中南大学, 2014. |
| [17] | POLLAK N M, HOFFMAN M, GOLDBERG I J, et al. Kruppel-like factors:Crippling and un-crippling metabolic pathways[J]. JACC Basic Transl Sci, 2018, 3(1): 132–156. DOI:10.1016/j.jacbts.2017.09.001 |
| [18] | FERRANDI P J, FICO B G, WHITEHURST M, et al. Acute high-intensity interval exercise induces comparable levels of circulating cell-free DNA and interleukin-6 in obese and normal-weight individuals[J]. Life Sci, 2018, 20(2): 161–166. |
| [19] | LI X. The association between MCP-1, VEGF polymorphisms and their serum levels in patients with diabetic foot ulcer[J]. Medicine (Baltimore), 2018, 97(24): e10959. DOI:10.1097/MD.0000000000010959 |
| [20] | 魏育涛.心外膜脂肪内分泌紊乱诱导冠状动脉粥样硬化机制的研究[D].武汉: 华中科技大学, 2011. |
| [21] | FARR O M, GAVRIELI A, MANTZOROS C S. Leptin applications in 2015:what have we learned about leptin and obesity?[J]. Curr Opin Endocrinol Diabetes Obes, 2015, 22(5): 353–359. DOI:10.1097/MED.0000000000000184 |
| [22] | KUMARI R, KUMAR S, AHMAD M K, et al. Promoter variants of TNF-alpha rs1800629 and IL-10 rs1800871 are independently associated with the susceptibility of coronary artery disease in north Indian[J]. Cytokine, 2018, 110(1): 31–36. |
| [23] | ERSAHIN T, TUNCBAG N, CETIN-ATALAY R. The PI3K/AKT/mTOR interactive pathway[J]. Mol Bio-Systems, 2015, 11(7): 1946–1954. |
| [24] | HAN X, ZHONG Z, KOU J, et al. ROS generated by upconversion nanoparticle-mediated photodynamic therapy induces autophagy via PI3K/AKT/mTOR signaling pathway in M1 peritoneal macrophage[J]. Cell Physiol Biochem, 2018, 48(4): 1616–1627. DOI:10.1159/000492283 |
 2019, Vol. 45
2019, Vol. 45


