扩展功能
文章信息
- 李攀, 董莉萍, 张晓波, 张东晴, 任立群, 孙波, 范建华, 李馨刚, 姜晶, 张继红
- LI Pan, DONG Liping, ZHANG Xiaobo, ZHANG Dongqing, REN Liqun, SUN Bo, FAN Jianhua, LI Xingang, JING Jing, ZHANG Jihong
- 脱落细胞涂片、DNA图像倍体分析和细胞块及其联合试验对恶性胸腔积液的诊断价值
- Values of exfoliated cell smear, DNA ploidy analysis, cell block and their combined detection in diagnosis of malignant pleural effusion
- 吉林大学学报(医学版), 2019, 45(03): 639-642
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 639-642
- 10.13481/j.1671-587x.20190328
-
文章历史
- 收稿日期: 2018-09-04
2. 北华大学医学院卫生统计教研室, 吉林 吉林 132013;
3. 吉林大学药学院实验药理与毒理学教研室, 吉林 长春 130021
2. Department of Health Statistics, School of Medical Sciences, Beihua University, Jilin 132013, China;
3. Department of Experimental Pharmacology and Toxicology, School of Pharmacy, Jilin University, Changchun 130021, China
胸腔积液是临床多种疾病的常见并发症,如恶性肿瘤、结核和心力衰竭等[1],部分患者以胸腔积液为首发症状就诊,近年来全球范围内恶性肿瘤的发病率呈升高趋势[2],约20%的胸腔积液由恶性肿瘤导致[3],所以胸腔积液的良恶性诊断对于患者后续治疗至关重要。目前临床以病理诊断结果为“金标准”[4-5],以往临床病理学鉴别胸腔积液良恶性的诊断方法主要依靠脱落细胞涂片,随着科技的进步以及“精准医疗”概念的普及,更多的诊断方法被采用,如DNA图像倍体分析和离心积液制作细胞块等[6-7]。本研究探讨脱落细胞涂片、DNA图像倍体分析和细胞块3种诊断方法联合应用对恶性胸腔积液的诊断价值。
1 资料与方法 1.1 研究对象选取2016年6月—2017年11月北华大学附属医院病理科接收的胸腔积液标本300例,其中男性166例,女性134例,年龄14~91岁。纳入标准:①所有标本均为离体30 min内送检;②送检标本量均>250 mL;所有标本以免疫组织化学检测和(或)手术标本病理检查相结合作为金标准,由2名高级职称病理医师进行判定,将所有标本分为恶性组与良性组;恶性组共83例,包括肺腺癌61例、肺小细胞癌10例、恶性间皮瘤5例、大细胞神经内分泌癌2例、小B细胞淋巴瘤、乳腺癌、弥漫大B细胞淋巴瘤、卵巢腺癌和甲状腺髓样癌各1例;良性组共217例,包括结核性胸膜炎69例、心力衰竭52例、肝硬化48例、化脓性胸膜炎29例、低蛋白血症16例和间皮瘤3例。
1.2 检测方法收集适量胸腔积液于数个50 mL离心管内,3 000 r·min离心5 min,弃去上清(血性积液可先加入95%乙醇10 mL,3 000 r·min离心5 min后重复上述步骤);向沉渣内加入适量保存液混匀,制作细胞涂片,其中一张行HE染色,显微镜下观察细胞形态进行细胞学诊断;另一张行Feulgen染色,采用LD DNA-ICM2型DNA图像倍体分析系统(中国武汉兰丁医学高科技有限公司)进行DNA图像倍体分析。同时将试管内剩余混合液再次离心5 min,弃上清,采用洁净镊子刮取沉渣包于擦镜纸内(沉渣量少时可用蛋清细胞蜡块制备法),常规固定、脱水、浸蜡和包埋,制作HE染色切片。
1.3 DNA图像倍体分析结果和HE染色切片结果判定标准DNA图像倍体分析结果判定:DNA图像倍体分析系统对经过Feulgen染色的细胞核进行扫描,DNA含量>5c判定为异常细胞,异常细胞≥3个或异倍体DNA含量为2~5c形成峰值时判定为恶性。细胞涂片和细胞块HE染色切片判定方法:由2名高级职称的病理医师对所有涂片和切片进行阅片诊断。恶性胸腔积液:肿瘤细胞呈现团片状或散在分布,可见腺腔样、微乳头样及胞浆泡沫样的深染异型细胞;良性胸腔积液:细胞涂片或HE染色切片均未见异型细胞。
1.4 诊断指标2组患者均进行3种诊断方法的检测。①一般诊断指标:敏感度=恶性组检测的阳性例数/恶性组例数;特异度=良性组检测的阴性例数/良性组例数;②平行试验检测法:即并联试验,3种诊断方法中有1项为阳性即为联合试验的阳性;③系列试验检测法:即串联试验,3种诊断方法均为阳性即为联合试验的阳性。阳性预测值=恶性组检测的阳性例数/(恶性组检测的阳性例数+良性组检测的阳性例数);阴性预测值=良性组检测的阴性例数/(良性组检测的阴性例数+恶性组检测的阴性例数)。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)描述诊断的准确度,并利用DeLong(1988)法对不同指标间的曲线下面积(AUC)进行比较。
1.5 统计学分析采用MedClac15.0统计软件对数据进行统计学分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 平行试验和系列试验对恶性胸腔积液的诊断价值以敏感度为纵坐标,以特异度为横坐标绘制3种方法诊断恶性胸腔积液的ROC曲线,3种方法的诊断结果和2种联合检测诊断结果见图 1和表 1;平行试验检测法对恶性胸腔积液的敏感度较高(98.79%),特异度(97.70%)低于系列试验检测法,但均高于3种方法单独应用时的特异度,平行试验检测法对恶性胸腔积液检测的敏感度和阴性预测值(99.53%)较高;系列试验检测法对恶性腔积液诊断的特异度(99.54%)和阳性预测值(97.50%)较高,但该方法的敏感度最低(46.99%),且阳性预测值明显降低。见表 2。典型病例胸腔积液标本的HE染色和免疫组织化学染色结果见图 2和3(插页六)。
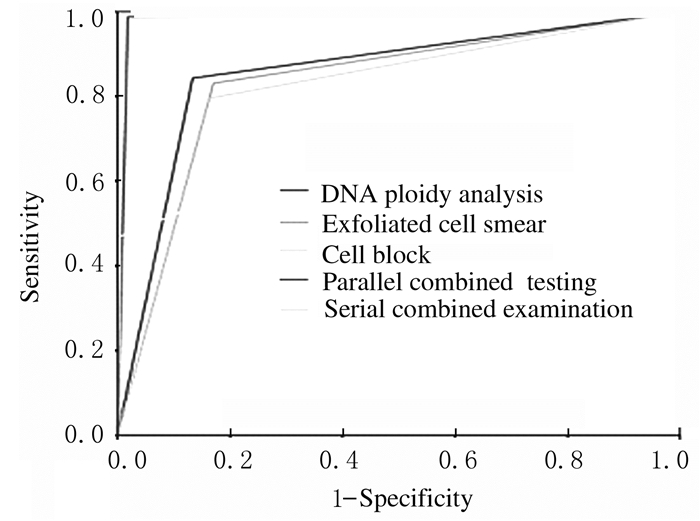
|
| 图 1 脱落细胞涂片、DNA图像倍体分析、细胞块和系列试验诊断恶性胸腔积液的ROC曲线 Fig. 1 ROC curves of exfoliated cell smear, DNA ploidyanalysis, cell block, and serial test in diagnosis of malignant pleural effusion |
|
|
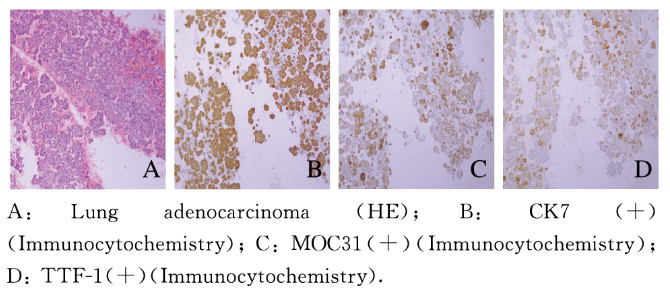
|
| 图 2 恶性胸腔积液患者肺腺癌细胞的形态表现 Fig. 2 Morphology of lung adenocarcinoma cells of patients with malignant pleural effusion |
|
|
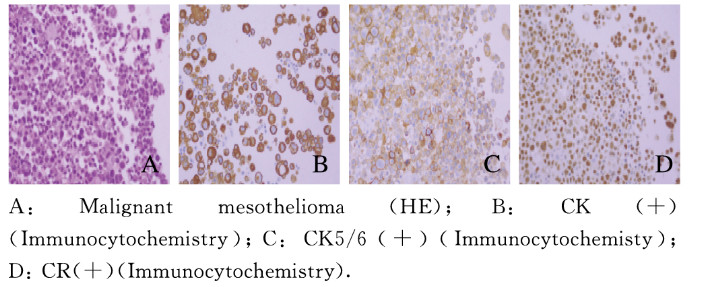
|
| 图 3 恶性胸腔积液患者恶性间皮瘤细胞的形态表现 Fig. 3 Morphology of malignant mesothelioma cells of patients with malignant pleural effusion |
|
|
| Type of pleural effusion | DNA ploidy analysis | Exfoliated cell smear | Cell block | Parallel test | Serial test | |||||||||
| + | - | + | - | + | - | + | - | + | - | |||||
| Malignant | 70 | 13 | 69 | 14 | 66 | 17 | 82 | 1 | 39 | 44 | ||||
| Benign | 29 | 188 | 37 | 180 | 35 | 182 | 5 | 212 | 1 | 216 | ||||
| Method | Positive predict value(η/%) | Negative predict value(η/%) | AUC (95%CI) | Sensitivity(η/%) | Specificity(η/%) | Z | P |
| Parallel test | 94.25 | 99.53 | 0.99 (0.972-0.998) | 98.79 | 97.70 | - | - |
| Serial test | 97.50 | 83.08 | 0.73(0.659-0.806) | 46.99 | 99.54 | 6.62 | < 0.01 |
| DNA ploidy analysis | 70.71 | 93.53 | 0.85 (0.810-0.893) | 84.44 | 86.64 | 5.78 | < 0.01 |
| Exfoliated cell smear | 65.09 | 92.78 | 0.83 (0.783-0.875) | 83.13 | 82.95 | 6.67 | < 0.01 |
| Cell block | 65.35 | 91.46 | 0.81 (0.768-0.859) | 79.52 | 83.87 | 6.88 | < 0.01 |
| “-”:No data. | |||||||
胸腔积液是临床十分常见的症状,研究[8-9]表明:包括肿瘤性疾病和感染性疾病等60余种病因均可导致积液产生,其中首要原因是炎症性疾病,其次为肿瘤,准确诊断其性质是患者得到及时治疗的前提。对于诊断性穿刺获取的胸腔积液,可以使用检验学手段检测胸腔积液内特殊酶类或抗原[10]来鉴别渗出液与漏出液,对于肿瘤性胸腔积液的确诊只能依靠细胞学检测,如果单纯依靠传统涂片诊断,由于制片时涂抹不均、细胞重叠或炎细胞过多等原因,很容易导致漏诊[11-12],将胸腔积液中的细胞沉渣制作成细胞块,有效地提高了恶性肿瘤的检出率[13]。在细胞涂片和细胞块中不同组织来源的腺癌细胞形态极为相似,并且小细胞癌的胸腔积液因其肿瘤细胞含量少,故难以诊断而导致漏诊[14]。随着科技进步,DNA图像倍体分析技术逐渐应用于临床,研究[15]显示:利用DNA图像倍体分析作为胸腔积液的诊断方法,其准确率高于脱落细胞涂片。本实验中,DNA图像倍体分析诊断的准确率高于细胞涂片和细胞块,其中3例因送检标本内细胞数量 < 800个,细胞数量未达到系统扫描的合格样本数量,导致结果呈假阴性。
既往国内外针对胸腔积液的病理诊断研究大部分采用2种方法联合应用,本研究采用3种方法相结合进行综合诊断,结果显示:DNA图像倍体分析、脱落细胞涂片和细胞蜡块3种诊断方法单一应用时敏感度及特异度均较低,与其他作者[16-17]的研究结果一致。研究[18-19]显示:单项检测只适用于恶性胸腔积液的初筛,细胞涂片和细胞块可对部分典型的腺癌及小细胞癌作出初步诊断。由于制片过程存在人为因素干扰,且小细胞肿瘤和淋巴造血系统肿瘤在诊断时鉴别困难,恶性间皮瘤和肺腺癌的细胞形态有时极为相似,单独应用一项检测技术易导致部分恶性胸水漏诊或误诊。本研究结果显示:采用平行试验方法时其敏感度明显高于单一诊断方法,采用系列试验方法时其特异度明显提高,但易漏诊。在诊断同时可对阳性病例进行免疫组织化学检测,进一步明确恶性肿瘤来源,还可针对肿瘤类型进行相关的基因检测[20],指导临床靶向治疗。该综合诊断方式比单一项目诊断具有更高的临床应用价值。如何使其更精准地为患者服务,有待结合更多病例进一步探讨。
| [1] | 伍燕兵, 杜莹, 逯勇, 等. 胸腔积液病因分析[J]. 中国呼吸与危重监护杂志, 2017, 16(5): 490–494. |
| [2] | 陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 26(1): 1–7. |
| [3] | ANTONANGELO L, SALES R K, COREÁ A P, et al. Pleural fluid tumourmarkers in malignant pleural effusion with inconclusive cytologic results[J]. Curr Oncol, 2015, 22(5): e336–e341. DOI:10.3747/co.22.2563 |
| [4] | 中国恶性胸腔积液诊断与治疗专家共识组. 恶性胸腔积液诊断与治疗专家共识[J]. 中华内科杂志, 2014, 53(3): 252–256. DOI:10.3760/cma.j.issn.0578-1426.2014.03.028 |
| [5] | 罗丽花, 张婉仪, 刘惠娟, 等. 细胞块联合免疫组化在胸腔积液诊断中的应用[J]. 临床与实验病理学杂志, 2015, 31(8): 904–907. |
| [6] | KRISHAN A, GANJEI-AZAR P, HAMELIK R, et al. Flow immunocytochemistry of marker expression in cells from body cavity fluids[J]. Cytometry A, 2010, 77(2): 132–143. |
| [7] | SAYED D M, EL-ATTAR M M, HUSSEIN A A, et al. Evaluation of flow cytometric immunophenotyping and DNA analysis for detection of malignant cells in serosal cavity fluids[J]. Diagn Cytopathol, 2009, 37(7): 498–504. DOI:10.1002/dc.v37:7 |
| [8] | CORCORAN J P, HALLIFAX R, RAHMAN N M. Advances in the management of pleural disease[J]. Expert Rev Respir Med, 2013, 7(5): 499–513. DOI:10.1586/17476348.2013.838016 |
| [9] | THOMAS R, LEE Y C. Causes and management of common benign pleural effusions[J]. Thorac Surg Clin, 2013, 23(1): 25–42. DOI:10.1016/j.thorsurg.2012.10.004 |
| [10] | 吴京, 谢惠英, 葛歆悦, 等. 腺苷脱氨酶和癌胚抗原联合检测在结核性与恶性肿瘤胸腔积液鉴别诊断上的价值[J]. 检验医学, 2014, 29(6): 688–689. |
| [11] | YANG L, HE Z, HUANG X Y, et al. Prevalence of human papillomavirus and the correlation of HPV infection with cervical disease in Weihai, China[J]. Eur J Gynaecol Oncol, 2015, 36(1): 73–77. |
| [12] | GAO K, EURASIAN M, ZHANG J Q, et al. Can genomic amplification of human telomerase gene and C-MYC in liquid-based cytological specimens be used as a method for opportunistic cervical cancer screening?[J]. Gynecol Obstet Invest, 2015, 80(3): 153–163. DOI:10.1159/000371760 |
| [13] | 黄榕芳, 何诚, 朱伟峰, 等. 细胞蜡块技术与传统涂片技术在胸腔积液病理诊断中的应用效果比较[J]. 福建医药杂志, 2016, 38(2): 94–96. |
| [14] | 刘绍霞, 郑瑞娟, 殷克勤, 等. 疑诊为恶性胸膜间皮瘤的低分化肺腺癌一例[J]. 中华肺部疾病杂志:电子版, 2016, 9(2): 221–223. |
| [15] | 蔡永芳, 邓晓红, 石新兰, 等. 脱落细胞TCT、DNA倍体分析与细胞块联合应用在胸腔积液诊断中的价值[J]. 检验医学, 2017, 32(10): 70–72. |
| [16] | UGURLUOGLU C, KURTIPEK E, UNLU Y, et al. Importance of the cell block technique in diagnosing patients with non-small cell carcinoma accompanied by pleural effusion[J]. Asian Pac J Cancer Prev, 2015, 16(7): 3057–3060. DOI:10.7314/APJCP.2015.16.7.3057 |
| [17] | 张薇, 汪键, 程越清, 等. 全自动细胞图像分析仪在胸腹腔积水诊断中的应用[J]. 中国癌症杂志, 2011, 21(4): 303–307. DOI:10.3969/j.issn.1007-3969.2011.04.014 |
| [18] | 张丽华, 王雪晴, 王国庆, 等. 细胞蜡块在晚期腺癌诊断和肺腺癌个体化治疗中的应用价值[J]. 临床与实验病理学杂志, 2014, 30(2): 166–170. |
| [19] | 权春姬, 金仁顺. 细胞蜡块结合免疫组化在小细胞癌诊断中应用价值[J]. 临床肺科杂志, 2017, 22(6): 1009–1011. DOI:10.3969/j.issn.1009-6663.2017.06.011 |
| [20] | LIU D, LU Y C, HU Z L, et al. Malignant pleural effusion supernatants are substitutes for metastatic pleural tumor tissues in EGFR mutation test in patients with advanced lung adenocarcinoma[J]. PLoS One, 2014, 9(2): e89946. DOI:10.1371/journal.pone.0089946 |
 2019, Vol. 45
2019, Vol. 45


