扩展功能
文章信息
- 金权, 郑义, 许立硕, 黄玉, 马宁, 张莉
- JIN Quan, ZHENG Yi, XU Lishuo, HUANG Yu, MA Ning, ZHANG Li
- 骨膜蛋白在慢性牙周炎患者牙龈组织中的表达及其临床意义
- Expression of periostin in gingival tissue of patients with chronic periodontitis and its clinical significance
- 吉林大学学报(医学版), 2019, 45(03): 634-638
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 634-638
- 10.13481/j.1671-587x.20190327
-
文章历史
- 收稿日期: 2019-01-18
2. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021;
3. 吉林大学口腔医院急诊科, 吉林 长春 130021
2. Key Laboratory of Tooth Development and Jaw Bone Remodeling and Regeneration, Jilin Province, Changchun 130021, China;
3. Department of Emergency, Stomatology Hospital, Jilin University, Changchun 130021, China
慢性牙周炎的病理特征之一是炎症因子可导致牙周组织细胞外基质(extracellularmatrix,ECM)的降解,从而引起牙齿支持组织的破坏。骨膜蛋白是一种由牙周韧带成纤维细胞高度表达的ECM蛋白,因其主要表达于成年小鼠的骨膜和牙周韧带而得名。骨膜蛋白在保持牙周组织的完整性以及牙齿和骨骼发育中起关键作用[1]。骨膜蛋白与牙周病的发生发展有密切关系,并且可能对牙周炎的治疗和牙周组织再生有积极作用[2]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是能够降解ECM的酶,与牙周组织的分解密切关联,其中基质金属蛋白酶8(matrix metalloproteinase-8, MMP-8)与慢性牙周病有密切关系[3]。MMPs组织抑制剂(tissue inhibitors of MMPs,TIMPs)是组织特异性MMPs抑制剂。目前已确定的TIMPs有4种,即TIMP-1、TIMP-2、TIMP-3和TIMP-4[4], 其中TIMP-2对MMP-8具有较强的抑制作用[5]。目前,骨膜蛋白在心血管疾病和肿瘤学研究领域受到广泛重视,但与牙周炎有关的研究较少。本研究采用免疫组织化学方法研究慢性牙周炎患者牙龈组织中骨膜蛋白表达情况,并分析骨膜蛋白表达与慢性牙周炎相关因子MMP-8和TIMP-2表达的相关性。
1 资料与方法 1.1 一般资料选择2016年12月—2018年6月在吉林大学口腔医院牙周科诊断为中度慢性牙周炎患者19例作为病例组,其中男性8例,女性11例,年龄28~51岁;选择行牙冠延长术和正畸需要拔除前磨牙患者23例作为对照组,其中男性11例,女性12例,年龄17~32岁。①病例组纳入标准:4 mm≤牙周探诊深度(periodontal probe depth,PD)≤6 mm;3 mm≤附着丧失(attachment loss,AL)≤4 mm;X线片显示:根长1/3≤牙槽骨吸收≤根长1/2,且需要接受牙周翻瓣手术。②对照组纳入标准:选取牙周组织健康,即PD ≤3 mm、无明显的临床炎症且无探诊后出血(bleeding on probing,BOP)。③排除标准:所有纳入对象均满足无全身系统性疾病,例如骨质疏松症、糖尿病、心血管疾病和呼吸系统疾病;接受免疫抑制化疗者;3个月内服用抗生素及非甾体类抗炎药物;妊娠妇女;吸烟者;服用任何可能影响牙周病表现的药物,如苯妥英钠、环孢菌素和全身性皮质类固醇或钙通道阻滞剂者[6]。本研究方案经吉林大学口腔医院伦理委员会批准,所有研究对象均对本研究知情同意。
1.2 主要试剂和仪器兔抗人骨膜蛋白多克隆抗体和兔抗人TIMP-2克隆抗体(北京博奥森生物技术有限公司),兔抗人MMP-8多克隆抗体(武汉博士德生物工程有限公司),免疫组织化学SP试剂盒和DAB显色剂(KIT-9710,DAB-0031,福州迈新生物技术开发有限公司)。切片机、体视显微镜(SZX16)和电子显微镜(Vanox)(日本Olympus公司)。
1.3 标本的制备和处理病例组患者牙龈取于翻瓣术中,对照组患者牙龈取于冠延长术中或正畸拔牙术中。所有组织样本经中性甲醛固定24~48 h,常规脱水、石蜡包埋,制作厚3 μm的组织切片。每组各取3张切片,采用SP免疫组织化学试剂盒以SP法进行免疫组织化学染色。切片经二甲苯和梯度乙醇脱水,脱蜡后微波热抗原修复,分别滴加骨膜蛋白、MMP-8和TIMP-2一抗。4℃过夜后滴加二抗,PBS冲洗后加入新鲜配制的DAB溶液,显微镜下观察控制显色(阳性染色为棕黄色)。显色完全后冲洗切片,苏木精复染,脱水封片。光学显微镜下分别观察2组患者牙龈组织中骨膜蛋白、MMP-8和TIMP-2阳性表达率。
1.4 结果判断标准将染色的组织切片置于200倍显微镜下,随机观察5个染色清晰的区域,分别由3位病理学专业人员采用双盲法予以判定。免疫组织化学染色强度分级采用阳性细胞百分数与阳性细胞显色强度相结合的方法[7]:①阳性细胞百分数,即阳性细胞占同类细胞的百分数。阳性细胞百分数<5%为0分,阳性细胞百分数6%~25%为1分, 阳性细胞百分数26%~50%为2分,阳性细胞百分数>50%时为3分。②染色强度评分。无显色、浅黄色、棕黄色和棕褐色分别为0、1、2和3分。按照上述标准,将两项得分相加即为每张组织切片最终免疫组织化学阳性表达水平。2项合计分值<2为阴性表达,2项合计分值≥2为阳性表达。
1.5 统计学分析采用SPSS 21.0统计软件进行统计学分析。对照组和病例组患者牙龈组织中骨膜蛋白、MMP-8和TIMP-2阳性表达率比较采用χ2检验,骨膜蛋白与MMP-8、骨膜蛋白与TIMP-2的阳性表达相关性分析采用Spearman相关分析法。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者牙龈组织中骨膜蛋白、MMP-8和TIMP-2阳性表达率对照组患者牙龈组织中骨膜蛋白表达主要位于上皮-结缔组织连接处和富含胶原蛋白的结缔组织中,23例对照组患者牙龈组织中,15例患者骨膜蛋白呈阳性表达,阳性表达率为65.2%;病例组患者牙龈组织中骨膜蛋白低表达或基本无表达,19例病例组患者牙龈组织中,6例患者骨膜蛋白呈阳性表达,阳性表达率(31.6%)低于对照组(P < 0.05)。对照组患者牙龈组织中MMP-8呈低表达,23例对照组患者牙龈组织中,7例患者MMP-8呈阳性表达,阳性表达率为30.4%;病例组患者牙龈组织的上皮及上皮下结缔组织中MMP-8高表达,牙龈上皮细胞呈棕褐色染色,固有层中可见大量炎症细胞浸润,19例病例组患者牙龈组织中,15例患者MMP-8呈阳性表达,阳性表达率为78.9%(15/19)。对照组患者牙龈组织中TIMP-2主要位于上皮层和上皮-结缔组织界面,牙龈上皮细胞呈棕褐色染色,在23例对照组牙龈组织中,18例患者TIMP-2呈阳性表达,阳性表达率为78.3%;19例病例组患者牙龈组织中,7例患者TIMP-2呈阳性表达,阳性表达率(36.8%)低于对照组(P < 0.05)。见图 1(插页六)和表 1。
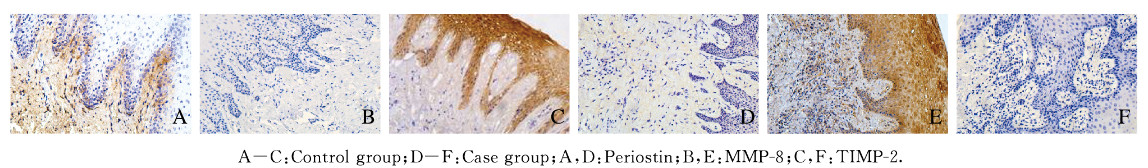
|
| 图 1 对照组和病例组患者牙龈组织中骨膜蛋白、MMP-8和TIMP-2的表达(HE, ×200) Fig. 1 Expressions of periostin, MMP-8 and TIMP-2 in gingival tissue of patients in control group and case group (HE, ×200) |
|
|
| Group | n | Periostin | Positive expression rate(η/%) | χ2 | P | |
| + | - | |||||
| Control Case | 23 19 |
15 6 |
8 13 |
65.2 31.6 |
4.71 |
0.030 |
| Group | n | MMP-8 | Positive expression rate(η/%) | χ2 | P | |
| + | - | |||||
| Control Case | 2319 | 7 15 |
16 4 |
30.4 78.9 |
9.82 | 0.002 |
| Group | n | TIMP-2 | Positive expression rate(η/%) | χ2 | P | |
| + | - | |||||
| Control Case | 2319 | 18 7 |
5 12 |
78.3 36.8 |
7.41 |
0.006 |
对照组患者牙龈组织中骨膜蛋白与MMP-8表达呈负相关关系(r=-0.51,P < 0.05),与TIMP-2表达呈正相关关系(r=0.50,P < 0.05)。病例组患者牙龈组织中骨膜蛋白表达与MMP-8表达呈负相关关系(r=-0.482,P < 0.05),骨膜蛋白表达与TIMP-2表达呈正相关关系(r=0.655,P < 0.05)。见表 2。
| Periostin | Control | Case | ||||||||||||||
| MMP-8 | r | P | TIMP-2 | r | P | MMP-8 | r | P | TIMP-2 | r | P | |||||
| + | - | + | - | + | - | + | - | |||||||||
| + - |
2 5 |
13 3 |
-0.510 |
0.013 | 14 4 |
1 4 |
0.500 | 0.015 | 3 12 |
3 1 |
-0.482 |
0.036 | 5 2 |
1 11 |
0.655 |
0.002 |
骨膜蛋白作为炎症性疾病的生物标志物受到很多关注,并在肿瘤学和心血管疾病研究中受到广泛重视[8]。骨膜蛋白与口腔鳞癌关系的研究[9]显示:骨膜蛋白在结缔组织和上皮细胞之间的双向相互作用中可能发挥作用。有学者[10]提出骨膜蛋白可能作为上皮-间质转化的驱动因子,促进口腔鳞状细`胞癌的侵袭和血管生成,并可作为预测口腔鳞状细胞癌转移的标志物。本研究结果也表明:骨膜蛋白在正常牙龈的上皮-结缔组织连接处高表达,而在炎症牙龈组织中弱表达。但骨膜蛋白在上皮与结缔组织之间如何发挥作用尚未明确,有待进一步研究。
以往关于骨膜蛋白的研究主要集中在心血管疾病和肿瘤学方面,近几年才开始有研究报道骨膜蛋白与牙周炎的关系。在人骨膜蛋白与牙周炎关系的研究[11]中所收集的样本主要是患者的血清或龈沟液,而以牙周炎症损害组织为样本的研究较少。本研究以炎症牙龈组织和正常牙龈组织作为样本检测发现:骨膜蛋白在对照组牙龈组织中呈高表达,而在病例组患者牙龈组织中呈低表达。随着牙周炎的加重,骨膜蛋白表达水平降低的主要原因[12]:①牙周致病菌的侵入可能改变骨膜蛋白的表达;②炎症反应能破坏牙周韧带细胞。研究[13]显示:牙周韧带细胞是产生骨膜蛋白的重要细胞之一,这可能是导致骨膜蛋白水平降低的原因之一。关于牙周炎与骨膜蛋白关系的研究结果仍然存在争议。有研究[14]表明慢性炎症反应中骨膜蛋白表达水平明显降低,另一项研究[15]显示牙周炎患者来源的牙周膜干细胞(periodontal ligament stem cells,PDLSCs)中骨膜蛋白表达水平明显高于非牙周炎患者。
在牙周病炎症反应中释放的MMPs可以破坏牙槽骨的完整性和参与ECM的重塑和降解, 其中MMP-8与牙周病严重程度密切相关[3]。本研究结果表明:在对照组和病例组患者牙龈组织中,骨膜蛋白与MMP-8水平均呈负相关关系。骨膜蛋白在正常牙龈组织中呈高表达,在炎症牙龈组织中低表达,表明骨膜蛋白可能在牙龈结构稳定和组织完整性中发挥其特定作用。研究[16]表明:TIMP-2和骨膜蛋白均为分泌蛋白,可能与ECM有关。在小鼠牙龈组织的研究[16]发现:TIMP-2和骨膜蛋白的分布可能与牙龈组织发育有关,但其在牙龈组织中的发育机制尚未明确。本研究结果显示:无论是在炎症组织或正常组织中骨膜蛋白与TIMP-2表达均呈正相关关系。目前,骨膜蛋白的研究热点是其与牙周组织再生方面的关系。研究[17]表明:在伤口愈合初期骨膜蛋白表达水平升高,随着伤口成熟,骨膜蛋白表达水平降低至基线水平。由于骨膜蛋白在稳定ECM和促进牙周组织细胞活性方面的性质,能改善牙周伤口愈合和再生。有学者[18]提出了在牙周手术后,通过增加骨膜蛋白表达水平或防止其减少的方法使组织附着增多以致愈合更快的假设。
随着精准医疗的广泛推行和分子靶向治疗的发展,寻找靶向治疗的生物学标志物成为各种疾病治疗的主要研究方向之一。对骨膜蛋白的进一步研究有助于将骨膜蛋白作为靶向治疗的生物学标志物用于慢性牙周炎的诊断和治疗以及牙周支持组织的再生。
| [1] | PADIAL-MOLINA M, VOLK S L, RODRIGUEZ J C, et al. Tumor necrosis factor-α and Porphyromonas gingivalis lipopolysaccharides decrease periostin in human periodontal ligament fibroblasts[J]. J Periodontol, 2013, 84(5): 694–703. DOI:10.1902/jop.2012.120078 |
| [2] | 刘倩, 黄萍, 郭淑娟. 骨膜蛋白与牙周病关系的研究进展[J]. 华西口腔医学杂志, 2018, 36(6): 681–685. |
| [3] | DE MORAIS E F, PINHEIRO J C, LEITE R B, et al. Matrix metalloproteinase-8 levels in periodontal disease patients:A systematic review[J]. J Periodontal Res, 2018, 53(2): 156–163. DOI:10.1111/jre.2018.53.issue-2 |
| [4] | WOESSNER J F JR. MMPs and TIMPs-an historical perspective[J]. Mol Biotechnol, 2002, 22(1): 33–49. |
| [5] | KUBOTA T, MATSUKI Y, NOMURA T, et al. In situ hybridization study on tissue inhibitors ofmetalloproteinases (TIMPs) mRNA-expressing cells in human inflamed gingival tissue[J]. J Periodontal Res, 1997, 32(5): 467–472. DOI:10.1111/jre.1997.32.issue-5 |
| [6] | ARAL C A, KOSEOGLU S, SAGLAM M, et al. Gingival crevicular fluid and salivary periostin levels in non-smoker subjects with chronic and aggressive periodontitis:periostin levels in chronic and aggressive periodontitis[J]. Inflammation, 2016, 39(3): 986–993. |
| [7] | JIA W, WANG W, JI C S, et al. Coexpression of periostin and EGFR in patients with esophageal squamous cell carcinoma and their prognostic significance[J]. Onco Targets Ther, 2016, 18(9): 5133–5142. |
| [8] | CONWAY S J, IZUHARA K, KUDO Y, et al. The role of periostin in tissue remodeling across health and disease[J]. Cell Mol Life Sci, 2014, 71(7): 1279–1288. DOI:10.1007/s00018-013-1494-y |
| [9] | COBO T, OBAYA A, CAL S, et al. Immunohistochemical localization of periostin in human gingiva[J]. Eur J Histochem, 2015, 59(3): 2548. |
| [10] | SIRIWARDENA B S, KUDO Y, OGAWA I, et al. Periostin is frequently overexpressed and enhances invasion and angiogenesis in oral cancer[J]. Br J Cancer, 2006, 95(10): 1396–1403. DOI:10.1038/sj.bjc.6603431 |
| [11] | JMMESHA F I, MARADI A P, CHITHRESAN K, et al. Comparison of gingival crevicular fluid periostin levels in healthy, chronic periodontitis, and aggressive periodontitis[J]. J Indian Soc Periodontol, 2018, 22(6): 480–486. DOI:10.4103/jisp.jisp_266_18 |
| [12] | AKMAN A C, BUYUKOZDEMIR ASKIN S, GUNCU G N, et al. Evaluation of gingival crevicular fluid and peri-implant sulcus fluid levels of periostin:A preliminary report[J]. J Periodontol, 2018, 89(2): 195–202. |
| [13] | RIOS H F, MA D, XIE Y, et al. Periostin is essential for the integrity and function of the periodontal ligament during occlusal loading in mice[J]. J Periodontol, 2008, 79(8): 1480–1490. DOI:10.1902/jop.2008.070624 |
| [14] | PADIAL-MOLINA M, VOLK S L, TAUT A D, et al. Periostin is down-regulated during periodontal inflammation[J]. J Dent Res, 2012, 91(11): 1078–1084. DOI:10.1177/0022034512459655 |
| [15] | TANG H N, XIA Y, YU Y, et al. Stem cells derived from "inflamed" and healthy periodontal ligament tissues and their sheet functionalities:a patient-matched comparison[J]. J Clin Periodontol, 2016, 43(1): 72–84. DOI:10.1111/jcpe.2016.43.issue-1 |
| [16] | YOSHIBA N, YOSHIBA K, HOSOYA A, et al. Association of TIMP-2 with extracellular matrix exposed to mechanical stress and its co-distribution with periostin during mouse mandible development[J]. Cell Tissue Res, 2007, 330(1): 133–145. DOI:10.1007/s00441-007-0439-x |
| [17] | PADIAL-MOLINA M, VOLK S L, RIOS H F. Preliminary insight into the periostin leverage during periodontal tissue healing[J]. J Clin Periodontol, 2015, 42(8): 764–772. DOI:10.1111/jcpe.12432 |
| [18] | BALLI U, KELES Z P, AVCI B, et al. Assessment of periostin levels in serum and gingival crevicular fluid of patients with periodontal disease[J]. J Periodontol Res, 2015, 50(6): 707–713. DOI:10.1111/jre.2015.50.issue-6 |
 2019, Vol. 45
2019, Vol. 45


