扩展功能
文章信息
- 王丹, 宋紫绮, 李怡飞, 历春, 董志恒, 董营, 盖晓东
- WANG Dan, SONG Ziqi, LI Yifei, LI Chun, DONG Zhiheng, DONG Ying, GAI Xiaodong
- 人结直肠癌和肿瘤引流淋巴结组织中Foxp3+调节性T细胞和髓样树突状细胞的表达及其意义
- Expressions of Foxp3+ regulatory T cells and myeloid dentritic cells in human colorectal cancer and tumor draining lymph node tissues and their significances
- 吉林大学学报(医学版), 2019, 45(03): 621-626
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 621-626
- 10.13481/j.1671-587x.20190325
-
文章历史
- 收稿日期: 2018-08-21
2. 吉林省吉林市中心医院骨关节科, 吉林 吉林 132011
2. Department of Orthopaedics, Jilin Central Hospital, Jilin Province, Jilin 132011, China
结直肠癌(colorectal cancer, CRC)是最常见的胃肠道肿瘤之一,在全球范围内其发病率居恶性肿瘤的第3位。随着外科技术的进步和放疗及化疗药物的使用,CRC患者的预后明显改善,但仍有40%~50%的CRC患者存在复发和转移。在影响CRC的诸多因素中,CRC微环境中的多种免疫细胞和肿瘤引流淋巴结(tumor draining lymph nodes, TDLN)起重要作用,其对CRC的早期诊断和治疗具有重要意义。
调节性T细胞(regulatory T cells, Tregs)代表调节自身免疫反应的CD4+辅助T细胞亚群[1]。Foxp3是Tregs特异且可靠的标志[2-3]。Foxp3+Tregs通过抑制抗肿瘤免疫来促进肿瘤生长和转移[4]。特别是在CRC中,Tregs被认为在控制促肿瘤慢性炎症中发挥有益作用[5]。本课题组的前期工作证实:CRC组织中的Tregs浸润明显高于癌旁正常组织。目前,Tregs在TDLN中的表达及其与其他免疫细胞的关系国内外尚未见相关报道。树突状细胞(dentritic cells, DCs)是一种功能强大的抗原呈递细胞,T细胞与DCs的相互作用是肿瘤有效免疫应答的基础。DCs由髓样树突状细胞(myeloid dentritic cells, mDCs)和浆细胞样树突状细胞(plasmacytoid dentritic cells, pDCs)组成。pDCs在保护性免疫和免疫耐受中发挥作用[6-7]。mDCs是功能最强的专职抗原呈递细胞,是机体免疫应答的始动者[8]。mDCs与肿瘤的发生发展有密切关联[9]。研究[10]显示:mDCs对Tregs在胸腺的选择及在外周淋巴样组织中分化、增殖的功能具有重要的调节作用。目前CRC患者癌组织中CD11c+ mDCs和Foxp3+ Tregs是否对CRC患者的临床进展和预后有影响尚不清楚。
本研究分析Foxp3+ Tregs和CD11c+ mDCs在原发肿瘤和TDLN组织中的浸润情况,探讨其与CRC临床病理参数的相关性,旨在阐明其在免疫中的潜在作用。
1 资料与方法 1.1 临床资料收集2008—2011年吉化集团公司总医院CRC患者手术切除的标本52例;均取癌组织和癌旁正常组织(距离肿瘤边缘>5 cm处)。所有病例均经病理诊断证实,且术前未经放疗或化疗,其中男性29例,女性23例,年龄47~82岁,平均年龄为64岁。患者及其家属均知情同意,本研究经吉化集团公司总医院伦理委员会批准。临床病理报告中包括性别、年龄、位置、组织学类型、肿瘤淋巴结转移(TNM)、肿瘤浸润深度、淋巴结是否转移和肿瘤分化程度等临床病理指标。根据2000年WHO关于CRC的诊断标准进行分类:47例标本为管状腺癌,5例为黏膜癌。肿瘤分化:6例样本分化良好,41例样本分化程度较低。52例患者中20例有淋巴结转移,32例无淋巴结转移。根据国际癌症控制联盟(UICC 2002)标准,14例患者为T1+T2组,38例为T3+T4组。根据2002 UICC分期系统的TNM分期标准,30例为Ⅰ+Ⅱ期组,22例为Ⅲ+Ⅳ期组。
1.2 主要试剂和仪器小鼠抗人Foxp3单克隆抗体(武汉博士德公司),小鼠抗人CD11c单克隆抗体(北京杉木金桥生物技术公司),即用型免疫组织化学超敏SP试剂盒、DAB显色试剂盒和多聚赖氨酸均为福州迈新生物技术公司产品,其他为国产分析纯。包埋机和切片机(LEICA RM-2245,德国隆合实业公司),生物显微镜(日本Olympus公司)。
1.3 免疫组织化学染色所有标本经固定、脱水、透明、包埋后制成4 μm厚连续切片,按照免疫组织化学SP试剂盒说明书进行操作。组织切片常规脱蜡、水化,3% H2O2室温下孵育10 min,阻断内源性过氧化物酶活性,热诱导抗原修复2 min。室温冷却,PBS冲洗,非免疫动物血清封闭10 min。切片分别滴加Foxp3抗体和CD11c单克隆抗体4℃过夜,PBS洗涤切片, 滴加辣根过氧化物酶二抗,室温20 min。PBS洗涤3次后,DAB显色,切片脱水,清洗和中性树胶封片。每个样本重复检测2次。检测CDC患者癌组织和癌旁组织中Foxp3+Tregs和CD11C+mDCS的表达频数。
1.4 结果判定标准采用双盲法评估所有载玻片。高倍镜(×400)下随机选取10个视野,每个视野计数100个细胞,计数阳性细胞数,取阳性细胞数的平均值。阳性细胞数≤ 20为低表达,阳性细胞数>20为高表达。
1.5 统计学分析采用SPSS 20.0统计软件进行统计学分析。CRC患者癌组织和癌旁组织中Foxp3+Tregs和CD11c+mDCs表达频数以x ±s表示,其与患者临床病理特征的关系分析采用t检验;CRC组织和TDLN中Foxp3+ Tregs和CD11c+mDCs的浸润及相关性分析采用Spearman秩相关性分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 CRC患者癌组织和癌旁正常组织中Foxp3+Tregs和CD11c+mDCs的表达Foxp3+ Tregs阳性表达呈棕黄色颗粒,主要定位于肿瘤细胞的细胞核中,Foxp3+Tregs散在分布于CRC肿瘤组织和周围正常黏膜中,其在CRC组织中的表达频数(8.07 /HPF)明显高于相邻正常黏膜组织(0.96 /HPF) (P < 0.01),见图 1A(插页五)。CD11c+ mDCs阳性表达为棕黄色颗粒,主要定位于细胞膜中。CRC患者癌组织中CD11c+ mDCs主要分布于肿瘤细胞边缘或者肿瘤基质中,其形状不规则,大小不一,常伴有淋巴细胞浸润。在CRC肿瘤组织中的表达频数(6.72/HPF)明显增加,与癌旁正常黏膜组织(2.32/HPF)比较差异有统计学意义(P < 0.01),见图 1B(插页五)。
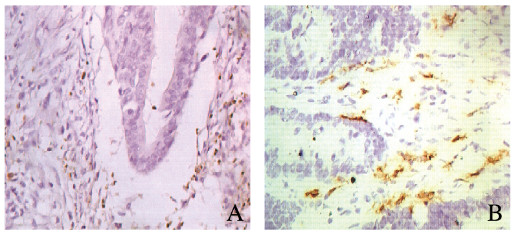
|
| A: Foxp3 Tregs; B: CDllc+mDCs. 图 1 CRC患者癌组织中Foxp3+Tregs和 CD11c+mDCs的表达(HE, ×400) Fig. 1 Expressions of Foxp3+Tregs and CD11c+mDCs in cancer tissue of CRC patients (HE, ×400) |
|
|
TNM分期Ⅰ+Ⅱ期组患者癌组织中Foxp3+Tregs表达频数明显高于TNM分期Ⅲ+Ⅳ期组(P < 0.01),淋巴结转移阳性组CRC患者癌组织中Foxp3+Tregs表达频数明显高于淋巴结转移阴性组(P < 0.01),Foxp3+Tregs表达频数与患者年龄、肿瘤类型、肿瘤浸润深度和肿瘤分化程度无关联(P> 0.05)。
肿瘤浸润深度T3+T4组患者CD11c+mDCs表达频数明显低于肿瘤浸润深度T1+T2组(P < 0.05);CD11c+mDCs在CRC患者癌组织中的表达频数随着TNM分期的递增而降低,组间比较差异有统计学意义(P < 0.01);淋巴结转移阴性组CRC患者癌组织中CD11c+mDCs的表达频数明显高于淋巴结转移阳性组(P < 0.01)。见表 1。
| (x ±s) | |||||
| Clinicopathological characteristic | n | Foxp3+Tregs | P | CD11c+mDCs | P |
| Age(year) | |||||
| ≥60 < 60 |
33 19 |
7.77±2.47 8.59±3.49 |
0.165 | 6.81±4.30 6.58±4.31 |
0.430 |
| Histology | |||||
| Tubular adenocarcinoma Mucious carcinoma |
47 5 |
8.11±3.51 7.52±5.53 |
0.369 | 6.97±4.25 4.72±4.07 |
0.135 |
| Invasion depth | |||||
| T1+T2 T3+T4 |
14 38 |
7.25±2.82 8.37±2.88 |
0.109 | 8.51±4.39 5.81±3.88 |
< 0.05 |
| Differentiation | |||||
| Well-moderate Moderately-poorly |
6 41 |
8.12±3.96 8.07±2.87 |
0.485 | 8.26±4.61 6.52±4.23 |
0.198 |
| Lymph node metastasis | |||||
| Yes No |
20 32 |
9.72±3.16 7.04±2.17 |
< 0.01 | 3.73±1.55 8.99±4.26 |
< 0.01 |
| TNM stage | |||||
| Ⅰ+Ⅱ Ⅲ+Ⅳ |
30 22 |
6.97±2.18 9.56±3.10 |
< 0.01 | 9.69±4.01 3.75±1.56 |
< 0.01 |
Foxp3+Tregs分布于淋巴结的副皮质区。在mTDLN组织中Foxp3+Trges的表达频数(8.2/HPF)明显高于mfTDLN组织(5.5/HPF) (P < 0.01)。CD11c+ mDCs主要分布在淋巴结的副皮质区和癌巢。mTDLN组织中mDCs表达频数(3.55/HPF)明显低于mfTDLN组织(9.03/HPF) (P < 0.01)。见图 2(插页五)。

|
| 图 2 CRC患者mTDLN和mfTDLN组织中Foxp3+Tregs和CD11c+mDCs的表达(HE,×400) Fig. 2 Expressions of Foxp3+Tregs and CD11c+mDCs in mTDLN and mfTDLN tissuesof CRC patients(HE,×400) |
|
|
CRC患者癌组织中Foxp3+Tregs表达和CD11c+mDCs表达的Spearman相关系数为-0.29,无明显相关性(P=0.063);TDLN组织中Foxp3+Tregs和CD11c+mDCs表达的Spearman相关系数为-0.30,无明显相关性(P=0.137)。
3 讨论由于肿瘤的免疫逃避机制对抗机体的免疫系统,免疫治疗逐渐成为肿瘤综合治疗的组成部分。Foxp3的特异性表达对Tregs的分化发育和功能至关重要[1, 11]。研究[12-15]显示:CD4+CD25+Tregs在多种肿瘤的CD4+T细胞中的比例异常升高,例如肺癌、乳腺癌、卵巢肿瘤和淋巴结转移性黑色素瘤等。研究[16-17]显示:Tregs可抑制CD4+ T细胞增殖,抑制肿瘤特异性抗原激活的CD4+效应T细胞分泌IL-2。SATO等[18]发现:卵巢癌患者CD8+ T细胞在肿瘤组织中的显著增加可以提高患者的生存率,Tregs对效应CD8+T细胞介导的抗肿瘤免疫反应有抑制作用,提示提高肿瘤特异性CD8+ T细胞和减少Tregs细胞可有效地改善癌症患者的预后。因此,在以细胞为主的肿瘤免疫过程中,Tregs处于关键环节,决定了免疫反应是趋向于诱导耐受还是免疫激活。本研究结果显示:CRC患者癌组织中Foxp3+Tregs的表达频数明显高于邻近的癌旁组织,Foxp3+Tregs表达与淋巴结转移和TNM分期有密切关联。淋巴结转移和TNM分期是判断肿瘤患者预后和存活时间的重要指标。本研究结果提示:Foxp3+Tregs表达与CRC转移及预后不良有关。随着肿瘤转移,Tregs介导的免疫抑制有增强趋势,肿瘤细胞可能有更多的机会直接或间接地与免疫细胞接触。
mDCs是一种专门启动和调节免疫的抗原呈递细胞,可有效诱导原发性T细胞反应,从而启动机体的免疫反应,产生抗肿瘤免疫[19]。研究[20]显示:CRC患者癌组织中mDCs数比正常黏膜组织中增加大约3倍,该现象的机制尚不清楚,可能与mDCs抗肿瘤的免疫反应有关。本文作者推测:在CRC肿瘤抗原刺激的作用下,mDCs从机体的其他部分迁移到肿瘤组织中。以往研究认为在肿瘤组织中每高倍视野大于等于20个mDCs即可认定是高度浸润,根据这一标准,在CRC癌组织中6.72 /HPF并未达到抗肿瘤免疫反应的程度,这可能是CRC局部组织免疫缺陷的原因之一。由于表达频数和功能的降低,mDCs被认为是抗肿瘤免疫中的负性因素[21],本文作者研究CD11c+mDCs表达与患者临床病理参数关系结果显示:有淋巴结转移患者CD11c+mDCs表达频数明显低于无淋巴结转移患者,CD11c+mDCs表达水平随TNM分期的增加而降低。因此,在CRC癌组织中CD11c+mDCs的表达水平通常可以反映肿瘤的免疫状态。在肿瘤免疫中,TDLN是肿瘤细胞沿淋巴管所能到达的淋巴结,是肿瘤发生免疫反应的主要场所。同时,TDLN也是肿瘤发生免疫耐受的主要场所[22]。在TDLN组织中,由于肿瘤免疫耐受而非诱导免疫攻击,从而促进肿瘤的进展,即mfTDLN和mTDLN组织均受肿瘤免疫耐受的影响。在mTDLN组织中,由于肿瘤细胞产生致瘤因子作用,肿瘤免疫耐受更加明显。本文作者观察mTDLN是否由于暴露于致瘤因子中从而比mfTDLN更容易受到免疫抑制,分析了Foxp3+Tregs和D11c+mDCs的表达情况,结果显示:mTDLN组织中Foxp3+Tregs的表达频数较高,而mTDLN组织中CD11c+mDCs的表达频数明显低于mfTDLN组织。本研究结果表明:在mTDLN中存在肿瘤细胞可以降低原位抗肿瘤免疫应答,促进肿瘤的进展。
上述结果表明:Foxp3+Tregs表达和CD11c+mDCs表达均与CRC中的恶性肿瘤生物表型有关。研究[10-11]显示:mDCs与胸腺Tregs的选择、外周淋巴组织的分化和增殖及功能调节有关。研究[23]显示mDCs具有主动免疫抑制和诱导肿瘤免疫耐受的作用。但目前对肿瘤部位mDCs与Tregs相互作用的关系、对不同DCs亚型的活性和功能调控的认识尚不明确。本研究结果显示:CRC癌组织和TDLN组织中Foxp3+Tregs表达与CD11c+mDCs表达无相关性。本文作者推测肿瘤组织中DCs亚群的转移可能打破抗肿瘤免疫应答的平衡,促进肿瘤细胞的生存。
综上所述,Foxp3+Tregs在CRC癌组织和TDLN组织中表达频数较高。而随着CRC的进展,CD11c+mDCs在TDLN组织和肿瘤间质中的表达频数减少,两者均与恶性肿瘤生物表型密切相关。Foxp3+Tregs和CD11c+mDCs在抑制肿瘤微环境的细胞免疫中发挥作用。
| [1] | HORI S, NOMURA T, SAKAGUCHI S. Control of regulatory T cell development by the transcription factor Foxp3[J]. Science, 2003, 299(5609): 1057–1061. DOI:10.1126/science.1079490 |
| [2] | FONTENOT J D, GAVIN M A, RUDENSKY A Y. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells[J]. Nat Immunol, 2003, 4(4): 330–336. DOI:10.1038/ni904 |
| [3] | KHATTRI R, COX T, YASAYKO S A, et al. An essential role for Scurfin in CD4+CD25+ T regulatory cells[J]. Nat Immunol, 2003, 4(4): 337–342. DOI:10.1038/ni909 |
| [4] | TANAKA A, SAKAGUCHI S. Regulatory T cells in cancer immunotherapy[J]. Cell Res, 2017, 27(1): 109–118. DOI:10.1038/cr.2016.151 |
| [5] | ELEONORA T, ILENIA P, VALERIA S, et al. Regulatory T cells with multiple suppressive and potentially pro-tumor activities accumulate in human colorectal cancer Oncoimmunology[J]. Oncoimmunology, 2016, 5(7): e1175800. DOI:10.1080/2162402X.2016.1175800 |
| [6] | GILLIET M, LIU Y J. Human plasmacytoid-derived dendritic cells and the induction of T-regulatory cells[J]. Hum Immunol, 2002, 63(12): 1149–1155. DOI:10.1016/S0198-8859(02)00753-X |
| [7] | MOSEMAN E A, LIANG X Q, DAWSON A J, et al. Human plasmacytoid dendritic cells activated by CpG oligodeoxynucleotides induce the generation of CD4+CD25+ regulatory T cells[J]. J Immunol, 2004, 173(7): 4433–4442. DOI:10.4049/jimmunol.173.7.4433 |
| [8] | SUN C M, HALL J A, BLANK R B, et al. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 Treg cells via retinoic acid[J]. J Exp Med, 2007, 204(8): 1775–1785. DOI:10.1084/jem.20070602 |
| [9] | PALUCKA K, UENO H, FAY J, et al. Dendritic cells and immunity against cancer[J]. J Intern Med, 2011, 269(1): 64–73. DOI:10.1111/jim.2010.269.issue-1 |
| [10] | TARBELL K V, PETIT L, ZUO X, et al. Dendritic cell-expanded, islet-specific CD4+CD25+CD62L+regulatory T cells restore normoglycemia in diabetic NOD mice[J]. J Exp Med, 2007, 204(1): 191–201. DOI:10.1084/jem.20061631 |
| [11] | LIU Y J. A unified theory of central tolerance in the thymus[J]. Trends Immunol, 2006, 27(5): 215–221. DOI:10.1016/j.it.2006.03.004 |
| [12] | SHI C, ZHANG Y, YANG H, et al. Ultrasound-targeted microbubble destruction-mediated Foxp3 knockdown may suppress the tumor growth of HCC mice by relieving immunosuppressive Tregs function[J]. Exp Ther Med, 2018, 15(1): 31–38. |
| [13] | WOO E Y, CHU C S, GOLETZ T J, et al. Regulatory CD4+CD25+ T cells in tumors from patients with early-stage non-small cell lung cancer and late-stage ovarian cancer[J]. Cancer Res, 2001, 61(12): 4766–4772. |
| [14] | LIYANAGE U K, MOORE T T, JOO H G, et al. Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma[J]. J Immunol, 2002, 169(5): 2756–2761. DOI:10.4049/jimmunol.169.5.2756 |
| [15] | YAMAZAKI S, PATEL M, HARPER A, et al. Effective expansion of alloantigen-specific Foxp3+ CD25+ CD4+ regulatory T cells by dendritic cells during the mixed leukocyte reaction[J]. Proc Natl Acad Sci U S A, 2006, 103(8): 2758–2763. DOI:10.1073/pnas.0510606103 |
| [16] | YU A X, SNOWHITE I, VENDRAME F, et al. Selective IL-2 responsiveness of regulatory T cells through multiple intrinsic mechanisms supports the use of low-dose IL-2 therapy in type 1 diabetes[J]. Diabetes, 2015, 64(6): 2172–2183. DOI:10.2337/db14-1322 |
| [17] | SHI C Y, ZHANG Y, YANG H C, et al. Ultrasound-targeted microbubble destruction-mediated Foxp3 knockdown may suppress the tumor growth of HCC mice by relieving immunosuppressive Tregs function[J]. Exp Ther Med, 2018, 15(1): 31–38. |
| [18] | SATO E, OLSON S H, AHN J, et al. Intraepithelial CD8+ tumor-infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer[J]. Proc Natl Acad Sci U S A, 2005, 102(51): 18538–18543. DOI:10.1073/pnas.0509182102 |
| [19] | TROJANDT S, BELLINGHAUSEN I, RESKE-KUNZ A B, et al. Tumor-derived immuno-modulators induce overlapping pro-tolerogenic gene expression signatures in human dendritic cells[J]. Hum Immunol, 2016, 77(12): 1223–1231. DOI:10.1016/j.humimm.2016.08.014 |
| [20] | LEGITIMOA, CONSOLINI R, FAILL A, et al. Dendritic cell defects in the colorectal cancer[J]. Human vaccines Immunotherapeut, 2014, 10(11): 3224–3235. DOI:10.4161/hv.29857 |
| [21] | LOHELA M, CASBON A J, OLOW A, et al. Intravital imaging reveals distinct responses of depleting dynamic tumor-associated macrophage and dendritic cell subpopulations[J]. Proc Natl Acad Sci U S A, 2014, 111(47): E5086–E5095. DOI:10.1073/pnas.1419899111 |
| [22] | THOMAS S N, VOKALI E, LUND A W, et al. Targeting the tumor-draining lymph node with adjuvanted nanoparticles reshapes the anti-tumor immune response[J]. Biomaterials, 2014, 35(2): 814–824. DOI:10.1016/j.biomaterials.2013.10.003 |
| [23] | BRACAMONTE-BARAN W, FLORENTIN J, ZHOU Y, et al. Modification of host dendritic cells by microchimerism-derived extracellular vesicles generates split tolerance[J]. Proc Natl Acad Sci U S A, 2017, 114(5): 1099–1104. DOI:10.1073/pnas.1618364114 |
 2019, Vol. 45
2019, Vol. 45


