扩展功能
文章信息
- 王志静, 苏荣健, 杜晓媛
- WANG Zhijing, SU Rongjian, DU Xiaoyuan
- 葡萄糖调节蛋白78对非小细胞肺癌患者吉西他滨化疗敏感性的影响
- Effects of GRP78 on sensibility of gemcitabine on patients with NSCLC
- 吉林大学学报(医学版), 2019, 45(03): 595-600
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 595-600
- 10.13481/j.1671-587x.20190321
-
文章历史
- 收稿日期: 2018-08-23
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最常见的类型,占肺癌患者的75%~80%,具有恶性程度高、增殖速率快、易复发和易耐药的特点[1],其常用化疗药物之一为吉西他滨,以吉西他滨为基础的单药化疗或联合化疗能有效提高NSCLC患者的生存率,但其耐药性限制了临床疗效,并且目前缺乏有效的指标来预测NSCLC对吉西他滨的耐药性。NSCLC的耐药是一个复杂的过程,涉及大量基因异常表达以及相关信号通路的异常。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号传导通路在NSCLC细胞增殖、侵袭和耐药中扮演重要角色[2-3]。葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)在恶性肿瘤细胞中过表达,而在正常细胞中低表达甚至不表达。研究[4]表明:过表达GRP78能导致Akt和PI3K的磷酸化水平增加,进而增加肿瘤细胞活力。研究[5]表明:GRP78过表达可以导致肿瘤细胞对多种化疗药物耐药,但其机制尚不明确,并且其是否与NSCLC对吉西他滨的耐药有关目前尚未见报道。本研究分析GRP78在经吉西他滨治疗的NSCLC患者癌组织中的表达水平和治疗效果,并在此基础上在过表达GRP78的肺腺癌SPCA1细胞中应用RNA干扰技术下调GRP78的表达,观察GRP78对吉西他滨化疗敏感性的影响,进一步探讨其作用机制,从而为临床上吉西他滨治疗NSCLC提供新的线索。
1 资料与方法 1.1 一般资料收集2015年1月—2017年1月于锦州医科大学附属第一医院手术切除并经病理证实的NSCLC石蜡包埋组织标本35例,患者的中位年龄为60岁,均为采用吉西他滨单药化疗治疗者的标本。35例患者中能评价疗效者32例,均在化疗2个周期后给予全面检查,进行疗效评估,另外3例仅行化疗1个周期,未进行疗效评估。治疗方案:成人推荐吉西他滨剂量为1 000 mg·m-2,静脉滴注30 min,每周1次,连续3周,随后休息1周,每4周重复1次,依据患者的毒性反应相应减少剂量。疗效评价:采用实体瘤疗效评价法(RECIST)对患者的化疗效果进行评价,疗效评价分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),缓解包括CR和PR,未缓解包括SD和PD。
1.2 细胞和主要试剂人肺癌细胞系SPCA1、A549和H3255由北京生命科学研究院陈良研究员惠赠。RPMI 1640培养液和胎牛血清购于美国Gibco公司,SP试剂盒和DAB试剂盒均购于北京中杉金桥生物技术有限公司,GRP78-shRNA和对照载体购于上海吉玛基因公司,Lipofectamine2000购于美国Invitrogen公司,吉西他滨购于美国Selleck Chemicals公司(批号:S171403),GRP78、Akt、p-Akt、PI3K、p-PI3K和β-actin抗体购于美国CST公司,HRP标记的二抗和ECL发光试剂购于上海碧云天公司。
1.3 免疫组织化学染色二甲苯和梯度乙醇脱蜡、枸橼酸钠缓冲液高压修复,过氧化氢孵育封闭内源性过氧化酶,GRP78兔抗人单克隆抗体1:200稀释,4℃过夜。次日,滴加HRP标记的羊抗兔二抗,37℃孵育40 min,DAB显色,苏木精复染,分化,脱水,封片。GRP78在细胞质中表达,以抗体在细胞质中出现棕黄色或棕褐色判定为阳性反应,对结果进行半定量分析。染色强度评分:0分为无着色,1分为淡黄色,2分为棕黄色,3分为棕褐色;染色阳性率评分:0分为阴性,1分为≤25%,2分为25%~50%,3分为51%~75%,4分为≥75%。以染色强度评分和染色阳性率评分的乘积作为总评分并进行分组,0~5分为低表达组,6~12分为高表达组。染色结果由2名资深病理科医生进行评分与核准。
1.4 细胞培养和转染将SPCA1、A549和H3255细胞培养于含10% FBS和1%青霉素/链霉素的RPMI 1640培养液中,培养条件为37℃、5% CO2。转染按Lipofectamine2000说明书进行操作。将细胞接种于6孔细胞培养板中,转染前12 h更换为不含抗生素的完全培养液中。当细胞密度达到80%时,开始转染,转染后48 h应用Western blotting法检测转染效率。转染体系为500 μL,质粒DNA与转染试剂的比例为2:5,其中质粒用量为6 μg,Lifectamine2000试剂体积为15 μL,将SPCA1细胞分为对照组(给予shNC)和干扰组(给予shGRP78),shGRP78序列为5′-GCCTAAATGTTATGAGGATCA-3′,同时设计shNC序列为5′-GTTCTCCGAACGTGTCACG- T-3′。
1.5 Western blotting法检测SPCA1、A549和H3255细胞中GRP78表达量将处理后的细胞采用RIPA缓冲液(含1% NP-40、0.5%脱氧胆酸钠、1% SDS和0.1% PMSF)裂解,BCA法定量,SDS-PAGE电泳,转膜,3% BSA封闭,加入GRP78兔抗人单克隆抗体(1:1 000稀释),4℃过夜,TBST洗膜后加入HRP标记羊抗兔二抗室温孵育1 h,ECL显色,得到GRP78条带,内参采用β-actin。
1.6 MTT实验检测各组细胞活力将对照组和干扰组中SPCA1细胞按每孔5 000个细胞的密度接种于96孔细胞培养板,12 h后,采用含有吉西他滨的0.5%血清的培养液处理细胞后继续培养48 h,加入MTT试剂继续培养4 h后,DMSO溶解沉淀,采用酶标仪于490 nm处测定各孔的吸光度(A)值,计算各组细胞活力。细胞活力=给药组A值/空白组A值×100%,实验重复3次,绘制细胞活力图。
1.7 克隆形成实验检测各组细胞克隆形成率设立阴性对照组、干扰组、对照+吉西他滨组和干扰+吉西他滨组,各组SPCA1细胞按每孔1 000个细胞的密度接种于6孔细胞培养板,按分组情况给予药物,药物作用时间约为2周,待阴性对照组细胞即将长满则终止培养,甲醛固定30 min,结晶紫染色15 min,洗去染色液,空气风干,照相,计算克隆形成率。克隆形成率=处理组细胞数/阴性对照组细胞数×100%。
1.8 Western blotting法检测各组细胞中Akt、p-Akt、PI3K和p-PI3K表达量分组同1.7中。将各组处理后的细胞用RIPA缓冲液(含1% NP-40、0.5%脱氧胆酸钠、1% SDS和0.1% PMSF)裂解,BCA法定量,SDS-PAGE电泳,转膜,3% BSA封闭,加入Akt、p-Akt、PI3K和p-PI3K兔抗人单克隆抗体(1:1 000稀释),4℃过夜,TBST洗膜后加入HRP标记羊抗兔二抗,室温孵育1 h,ECL显色,分别得到Akt、p-Akt、PI3K和p-PI3K条带,内参采用β-actin。
1.9 统计学分析采用SPSS13.0统计软件进行统计学分析。各组细胞活力和克隆形成率均以x±s表示,计量资料数据符合正态分布,多组间比较采用单因素方差分析。NSCLC患者手术切除组织中GRP78阳性表达率组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 经吉西他滨治疗的NSCLC患者手术切除组织中GRP78的表达免疫组织化学染色结果显示:在32例经吉西他滨治疗的NSCLC患者手术切除组织中,GRP78主要表达于NSCLC组织的细胞质内,呈棕黄色或棕褐色;其中12例经吉西他滨治疗缓解患者中,5例GRP78表达为强阳性;而20例吉西他滨治疗未缓解的患者中,17例GRP78表达为强阳性;故经吉西他滨治疗未缓解患者NSCLC组织中GRP78阳性表达率(85%)治疗明显高于缓解者(41.7%)(P < 0.05)。见图 1(插页四)。

|
| A-B:Lung squamous cell carcinoma tissue; C-D : Lung adenocarcinoma tissue; A, C:Remission after treated with gemcitabine; B, D:No remission after treated with gemcitabine 图 1 经吉西他滨治疗缓解和未缓解NSCLC患者癌组织中GRP78的表达(免疫组织化学,×200) Fig. 1 Expressions of GRP78 in cancer tissue in remission and no remission NSCLC patients after treated with gemcitabine(Immunohistochemistry, ×200) |
|
|
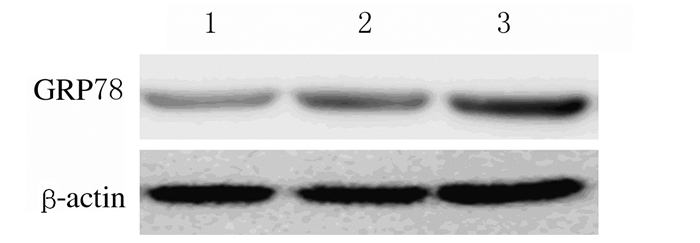
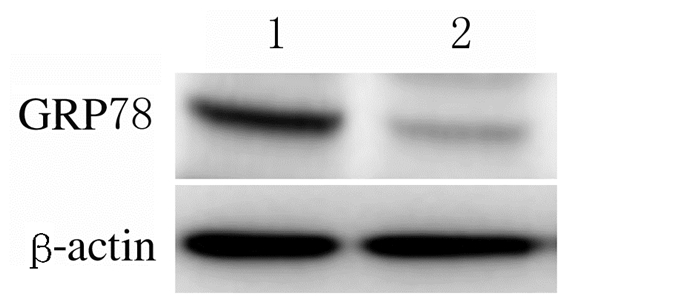
Western blotting法检测A549、H3255和SPCA1细胞中GRP78表达情况结果显示:在这3种细胞中GRP78均有表达,其中在SPCA1细胞中GRP78表达量最高,因此选定SPCA1细胞用于后续研究,见图 2。RNA干扰实验结果显示:与对照组比较,干扰组SPCA1细胞中GRP78表达量明显降低,见图 3。
|
| Lane 1:A549 cells; Lane 2:H3255 cells; Lane 3:SPCA1 cells. 图 2 Western blotting法检测A549、H3255和SPCA1细胞中GRP78表达电泳图 Fig. 2 Electrophoregram of expressions of GRP78 in A549, H3255 and SPCA1 cells detected by Western blotting method |
|
|
|
| Lane 1:Control group; Lane 2:Interference group. 图 3 Western blotting法检测RNA干扰后SPCA1细胞中GRP78表达电泳图 Fig. 3 Electrophoregram of expressions of GRP78 in SPCA1 cells after RNA interference detected by Western blotting method |
|
|
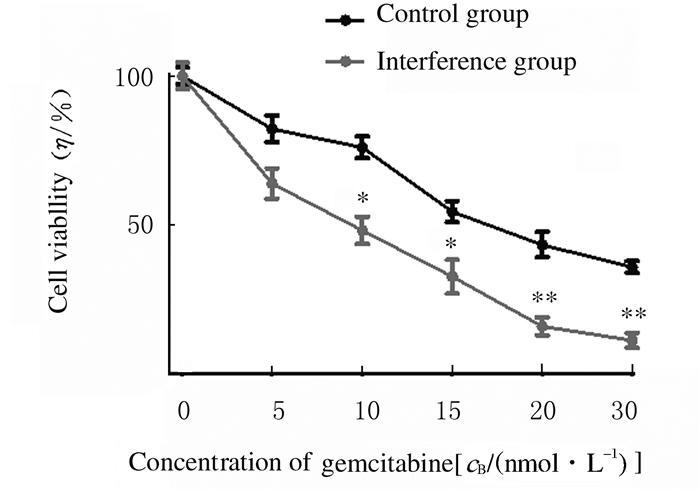
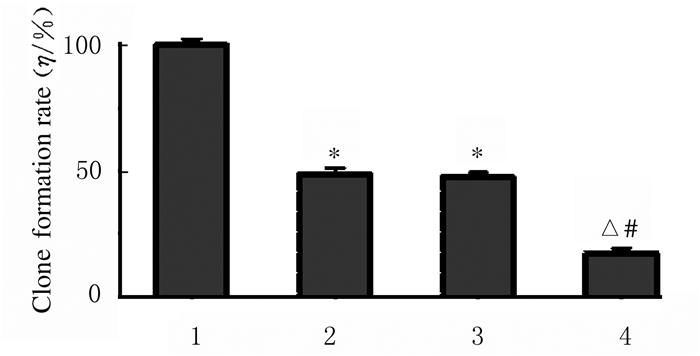
与对照组比较,干扰组细胞活力明显降低,随着吉西他滨浓度的增加,细胞活力随之明显降低,呈现明显的浓度依赖性(P < 0.05),见图 4。克隆形成实验结果显示各组SPCA1细胞呈克隆形成形态表现,见图 5(插页四)。与阴性对照组(100%)比较,干扰组SPCA1细胞克隆形成率(47.60%±1.70%)明显降低(P < 0.05),而干扰+吉西他滨组SPCA1细胞克隆形成率(17.30%±1.95%)降低更明显(P < 0.05)。见图 6。
|
| *P < 0.05 compared with control group. 图 4 MTT法检测不同浓度吉西他滨作用下各组SPCA1细胞活力 Fig. 4 Viabilities of SPCA1 cells in various groups after treated with different concentrations of gemcitabine detected by MTT assay |
|
|

|
| A:Control group; B:Interference group; C:Control + gemcitabine group; D:Interference + gemcitabine group 图 5 各组SPCA1细胞克隆形态表现 Fig. 5 Morphology of SPCA1 cell clones in various groups |
|
|
|
| 1:Negative control group; 2:Interference group; 3:Control + gemcitabine group; 4:Interference + gemcitabine group.*P < 0.05 compared with negative control group; △P < 0.05 compared with interference group; #P < 0.05 compared with control + gemcitabine group. 图 6 各组SPCA1细胞克隆形成率 Fig. 6 Clone formation rates of SPCA1 cells in various groups |
|
|
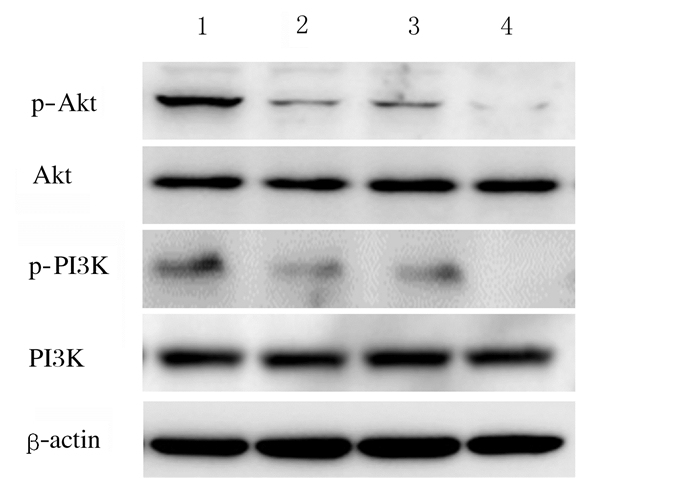
与阴性对照组比较,干扰组SPCA1细胞中p-Akt和p-PI3K表达量降低,而干扰+吉西他滨组SPCA1细胞中p-Akt和p-PI3K表达量降低更加明显。见图 7。
|
| Lane 1:Negative control group; Lane 2:Interference group; Lane 3:Control +gemcitabine group; Lane 4:Interference + gemcitabine group. 图 7 各组SPCA1细胞中Akt、p-Akt、PI3K和p-PI3K表达电泳图 Fig. 7 Electrophoregram of expressions of Akt, p-Akt, PI3K, and p-PI3K in SPCA1 cells in various groups |
|
|
NSCLC在肺癌中占比较高,外科手术切除肿瘤组织后,以化学治疗手段为主,吉西他滨作为NSCLC一线化疗药物,近年来其治疗NSCLC的有效率越来越低,这与肿瘤细胞对吉西他滨耐药有密切关系[6-7]。吉西他滨在肿瘤细胞内耐药的机制相对复杂,多种相关蛋白和因子参与其中,因而其耐药性的产生可由多种原因所致[8-9],BRD4在三阴乳腺癌中可增加吉西他滨的抵抗性[10]。
GRP78是一种多功能蛋白质,属于热休克蛋白70家族[11]。GRP78在肿瘤细胞中过表达,对肿瘤细胞的增殖、侵袭和转移等生物学特性具有重要的调节作用,在NSCLC中,过表达GRP78可促进肺癌细胞的转移[12]。研究[13-14]显示:GRP78在多种肿瘤中可以导致肿瘤细胞对化学药物治疗抵抗,在肝细胞癌细胞中过表达GRP78可以导致肿瘤细胞对sorafenib产生获得性耐药[15-16]。因此GRP78与肿瘤耐药性存在密切关系,其独特的生物学特性和功能使之在肿瘤治疗中受到关注[17]。本研究结果显示:GRP78在经吉西他滨治疗耐药的NSCLC患者手术切除的肿瘤组织中呈高表达,提示GRP78过表达可能与NSCLC对吉西他滨的耐药性有关。本研究进一步通过RNA干扰内源性高表达GRP78的肺腺癌SPCA1细胞,观察其对吉西他滨药物敏感性的影响来验证假设,结果显示:沉默GRP78可降低SPCA1细胞活力,并且增强吉西他滨对SPCA1细胞的敏感性,提示沉默GRP78可以增加NSCLC细胞对吉西他滨的反应性。
PI3K/Akt信号通路广泛存在于人体细胞中,稳定的PI3K/Akt信号通路参与正常的细胞生理活动过程,但在恶性肿瘤细胞中,PI3K/Akt信号通路处于一种过度激活的状态[18-19]。过度激活的PI3K/Akt信号通路通过调节肿瘤细胞的增殖、迁移、侵袭和耐药性等,维持肿瘤细胞的恶性程度[20-22]。本研究结果表明:通过沉默GRP78部分抑制了PI3K/Akt信号通路,降低了肺腺癌SPCA1细胞的活力。沉默GRP78增加了吉西他滨对PI3K/Akt信号通路的抑制作用,提示GRP78可以通过PI3K/Akt途径导致NSCLC对吉西他滨耐药。
综上所述,靶向GRP78可能是潜在、高效的治疗NSCLC手段,本研究结果为临床实践中吉西他滨耐药提供了新的思路,但具体机制和应用价值还需进一步研究。
| [1] | ULIVI P, ZOLI W, CAPELLI L, et al. Target therapy in NSCLC patients:Relevant clinical agents and tumour molecular characterisation[J]. Mol Clin Oncol, 2013, 1(4): 575–581. DOI:10.3892/mco.2013.100 |
| [2] | FAES S, DORMOND O. PI3K and AKT:unfaithful partners in cancer[J]. Int J Mol Sci, 2015, 16(9): 21138–21152. DOI:10.3390/ijms160921138 |
| [3] | TUYA N, WANG Y, TONG L, et al. Trichosanthin enhances the antitumor effect of gemcitabine in non-small cell lung cancer via inhibition of the PI3K/AKT pathway[J]. Exp Ther Med, 2017, 14(6): 5767–5772. |
| [4] | FU R, YANG P, WU H L, et al. GRP78 secreted by colon cancer cells facilitates cell proliferation via PI3K/Akt signaling[J]. Asian Pac J Cancer Prev, 2014, 15(17): 7245–7249. DOI:10.7314/APJCP.2014.15.17.7245 |
| [5] | GIFFORD J, HILL R. GRP78 influences chemoresistance and prognosis in cancer[J]. Current Drug Targets, 2018, 19(6): 701–708. DOI:10.2174/1389450118666170615100918 |
| [6] | 王立文, 沈晓洁, 林彬. 非小细胞肺癌中lncRNA MVIH与吉西他滨耐药的相关性研究[J]. 重庆医学, 2017, 46(7): 946–948. DOI:10.3969/j.issn.1671-8348.2017.07.026 |
| [7] | CHEN Y, HUANG Y, CHEN D M, et al. RRM1 expression and the clinicopathological characteristics of patients with non-small cell lung cancer treated with gemcitabine[J]. OncoTargets Ther, 2018, 11: 5579–5589. DOI:10.2147/OTT |
| [8] | XU C, YU Y, DING F. Microarray analysis of circular RNA expression profiles associated with gemcitabine resistance in pancreatic cancer cells[J]. Oncol Rep, 2018, 40(1): 395–404. |
| [9] | XIONG G, HUANG H, FENG M, et al. MiR-10a-5p targets TFAP2C to promote gemcitabine resistance in pancreatic ductal adenocarcinoma[J]. J Exp Clin Cancer Res, 2018, 37(1): 76–87. DOI:10.1186/s13046-018-0739-x |
| [10] | WANG Y, SUI Y, YAN K, et al. BRD4 promotes pancreatic ductal adenocarcinoma cell proliferation and enhances gemcitabine resistance[J]. Oncol Rep, 2015, 33(4): 1699–1706. DOI:10.3892/or.2015.3774 |
| [11] | LEE J, YOON Y, LEE S. GRP78 regulates apoptosis, cell survival and proliferation in 5-Fluorouracil-resistant SNUC5 colon cancer cells[J]. Anticancer Res, 2017, 37(9): 4943–4951. |
| [12] | LIZARDO M, MORROW J, MILLER T, et al. Upregulation of glucose-regulated protein 78 in metastatic cancer cells is necessary for lung metastasis progression[J]. Neoplasia, 2016, 18(11): 699–710. DOI:10.1016/j.neo.2016.09.001 |
| [13] | WANG Y, WANG J H, ZHANG X L, et al. Endoplasmic reticulum chaperone glucose-regulated protein 78 in gastric cancer:An emerging biomarker[J]. Oncol Lett, 2018, 15(5): 6087–6093. |
| [14] | DANESHMAND S, QUEK M L, LIN E, et al. Glucose regulated protein GRP78 is up-regulated in prostate cancer and correlates with recurrence and survival[J]. Hum Pathol, 2007, 38(10): 1547–1552. DOI:10.1016/j.humpath.2007.03.014 |
| [15] | RUI L, GU Y, HE W, et al. Secreted GRP78 activates EGFR-SRC-STAT3 signaling and confers the resistance to sorafeinib in HCC cells[J]. Oncotarget, 2017, 8(12): 19354–19364. |
| [16] | CHIOU J F, TAI C J, HUANG M T, et al. Glucose-regulated protein 78 is a novel contributor to acquisition of resistance to sorafenib in hepatocellular carcinoma[J]. Ann Surg Oncol, 2010, 17(2): 603–612. DOI:10.1245/s10434-009-0718-8 |
| [17] | JENIFER B, HUANG W, ZELENIAK A E. Expression of GRP78 master regulator of the unfolded protein response increases chemoresistance in pancreatic ductal adenocarcinoma[J]. Am Associat Cancer Res, 2016, 15(5): 1043–1052. |
| [18] | ZHANG Z, ZHANG M, LIU H, et al. AZD9291 promotes autophagy and inhibits PI3K/Akt pathway in NSCLC cancer cells[J]. J Cell Biochem, 2018, 120(1): 756–767. |
| [19] | CHEN Y, HUANG W, SUN W, et al. LncRNA MALAT1 promotes cancer metastasis in osteosarcoma via activation of the PI3K-Akt signaling pathway[J]. Cell Physiol Biochem, 2018, 51(3): 1313–1326. |
| [20] | 胡丽娜, 彭兴春, 郭显智, 等. 抑制Notch和PI3K/Akt信号通路对食管腺癌细胞增殖、侵袭及迁移的影响[J]. 肿瘤防治研究, 2016, 43(8): 653–658. DOI:10.3971/j.issn.1000-8578.2016.08.001 |
| [21] | ZHENG Z, ZHOU X, CAI Y, et al. TEKT4 promotes papillary thyroid cancer cell proliferation, colony formation, and metastasis through activating PI3K/Akt pathway[J]. Endocr Pathol, 2018, 29(4): 310–316. DOI:10.1007/s12022-018-9549-0 |
| [22] | 苏宝安, 许之晨, 李艾恩. 3.0T MR弥散加权成像评价中晚期食管鳞癌放化疗的早期疗效[J]. 中国医学物理学杂志, 2018, 35(12): 1452–1456. DOI:10.3969/j.issn.1005-202X.2018.12.016 |
 2019, Vol. 45
2019, Vol. 45


