扩展功能
文章信息
- 李刚, 王建生, 秦思达, 孙欣, 任宏, 张靖, 李保成
- LI Gang, WANG Jiansheng, QIN Sida, SUN Xin, REN Hong, ZHANG Jing, LI Baocheng
- 循环肿瘤细胞和外泌体miR-21检测在肺磨玻璃样病变诊断中的应用
- Application of detection of circulating tumor cells and exosome miR-21 in diagnosis of lung ground glass opacity
- 吉林大学学报(医学版), 2019, 45(03): 587-594
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 587-594
- 10.13481/j.1671-587x.20190320
-
文章历史
- 收稿日期: 2018-03-01
2. 陕西省渭南市第一医院普外科, 陕西 西安 714000
2. Department of Surgery, First Hospital, Weinan City, Shaanxi Province, Xi'an 714000, China
肺癌是在我国甚至在全球发病率和死亡率最高的恶性肿瘤,由于其隐匿性的发病特点,大量肺癌患者直到晚期才被诊断,导致患者5年生存率不到15%[1]。基于此,常规的低剂量CT(LDCT)筛查被引入到临床检查中[2-3],因此大量肺磨玻璃样病变(ground glass opacity,GGO)患者被筛查出来。肺癌确诊的金标准为病灶组织的穿刺活检,可协同使用的常用实验室检测指标包括癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(cytokeratin-19-fragment,CYFRA21-1)和鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC)等[4-5]。但GGO的穿刺活检难度相当大,往往不能在术前作出准确的判断,影响外科医生作出正确治疗决策,同时当前已有的肺癌标记物诊断方法的灵敏度和特异度均难以满足临床需要,所以急需更有效的肺癌诊断标志物来提高对肺癌尤其是GGO的诊断水平。针对这一情况,研究者提出了液体活检的概念,其中循环肿瘤细胞(circulating tumor cell,CTC)和外泌体的检测备受关注[6-8]。近年来CTC已经成为了早期发现恶性肿瘤转移和复发的关键因子[9]。外泌体可以反映其源细胞的病理状态,目前被认为是一种具有潜力的新型诊断标志物,适用于各种恶性疾病的诊断[10]。微小RNA(miRNA)是一种小型的非编码RNA,主要通过抑制转录和(或)促进靶miRNA的降解来调控基因表达,同时参与调控转录、翻译和细胞信号传递过程的非规范机制。研究[11-12]表明:肿瘤细胞的外泌体miRNA表达可以改变,而肿瘤患者血清miRNA的表达特别是miR-21表达水平明显升高。本研究观察GGO患者CTC和血清外泌体miR-21表达水平,计算外泌体miR-21的受试者工作特征(receiver operating characteristic curve,ROC)曲线和ROC曲线下面积(area under curve,AUC),评估CTC及外泌体miR-21检测在肺癌早期诊断中的有效性。
1 资料与方法 1.1 一般资料收集2014年8月—2017年8月于西安交通大学第一附属医院就诊的GGO患者的血液标本,GGO的诊断标准参照《美国胸科医师协会肺癌诊疗指南》及《中国肺部结节分类、诊断与治疗指南》[13-14]。本研究纳入标准:年龄30~76岁;男女不限;根据诊断标准经术前影像学诊断为GGO者;初发初治者;无肿瘤家族史。排除标准:拒绝进行手术治疗的患者;年龄较大或无法耐受手术者;术前拒绝进行CTC和(或)外泌体检测者。纳入患者肺部GGO标本经手术切除组织病理学确诊为肺癌的患者为病例组(n=24),病理证实为良性病变的患者为对照组(n=46)。本研究经西安交通大学第一附属医院伦理委员会审核,患者签署知情同意书。所有患者经由肘前静脉采集2管血液样本,血清样品分别采用EDTA采血管(BD Diagnostics, Sparks, MD)采血3 mL。血液标本在24 h内进行CTC和外泌体miR-21表达水平检测,整个过程避免溶血且隐去患者的信息达到单盲的目的。
1.2 CTC表达水平检测CytoploRare®叶酸受体阳性循环肿瘤细胞检测试剂盒由格诺思博生物科技(上海)有限公司提供。按试剂盒方法进行检测,首先采用免疫磁珠法负向富集叶酸受体阳性循环肿瘤细胞,后通过配体-靶向PCR定量检测CTC表达水平。引物序列:反转录引物(一段寡核苷酸用来偶联肿瘤特异性叶酸配体),5′-CTCAACTGGTGTCGTGGAGTCGGCAAT TCAGTTGAGGG- TTCTAA-3′;前引物,5′-TATGATTATGAGGCAT-GA-3′;后引物,5′-GGTGTCGTGGAGTCG-3′;TaqMan探针,5′-FAM-CAGGAGGGC-MGB-3′[15]。全血样本中加入红细胞裂解液(体积:体积=1:4),4℃裂解15 min,去除红细胞,加入150 μL抗CD45磁珠和50 μL抗CD14磁珠,4℃孵育30 min,分别去除白细胞和巨噬细胞。富集的CTC加入10 μL含有肿瘤特异性叶酸配体-寡核苷酸偶合物的探针标记液,室温孵育40 min。再加入1 mL洗涤缓冲液,4℃离心10 min,去除未结合的探针。加入120 μL洗脱缓冲液,4℃孵育2 min,洗脱下已结合的探针,离心收集,加入24 μL中和缓冲液,用于荧光定量PCR扩增分析。PCR信号与数据的收集通过ABI7300(Life Technologies, Carlsbad, CA)完成。ABI7300仪器的反应条件:95℃变性2 min,40℃退火30 s,72℃延伸30 s,8℃冷却5 min;40个循环,95℃变性10 s,35℃退火30 s,72℃延伸10 s[16]。本研究设定一个自我定义的测量单位“Folate Unit”,即血液中检测到的CTC水平,如果3 mL血液中检测到1个CTC,就定义为1 Folate Unit[17]。设定cutoff值为8.70FU/3mL,灰区定义为(cutoff,95%健康人检测位值),即(8.70,10.08),其结果≥10.08判定为阳性,< 8.70判定为阴性,8.70~10.08判定为灰区,进行复检并结合临床判断是否患有肿瘤[18]。实验组GGO患者病理类型包括细支气管肺泡癌(bronchioloalveolar carcinoma,BAC)、不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位癌(adenocarcinoma in situ,AIS)和微浸润腺癌(minimally invasive adenocarcinoma,MIA);对照组患者病理类型包括局灶性间质纤维化、出血和机化性肺炎及炎症。
1.3 血清外泌体提取和鉴定采用ExoQuick(美国System Biosciences公司)试剂提取血清外泌体,按4:1的比例在血清中加入ExoQuick试剂混匀,4℃静置30 min,1500 g离心30 min,管底可见沉淀,100 μL PBS重悬沉淀[19]。所得的外泌体被磷钨酸染色10 min后置于电子显微镜下观察其形态并照相。采用Western blotting法检测外泌体表面蛋白标志物,将其分别与CD63(ab134045,美国Abcam公司)、TSG101(ab133586, 美国Abcam公司)、CD9(ab134792,美国Abcam公司)、calnexin(BS1438,美国Bioworld公司)及羊抗兔二抗(bs-0295G,北京博奥森公司) 4℃孵育,加入化学发光底物显色观察。采用Nanosight NS300颗粒密度分析仪(NTA)检测外泌体样品颗粒密度,将样品的颗粒密度调至108 ~109mL-1。保持Nanosight的检测阈值为5,检测过程中测试参数保持不变。
1.4 外泌体中miR-21表达水平的检测采用Trizol-LS(美国Ambion公司)裂解外泌体悬液,采用硅胶模吸附柱纯化外泌体RNA。采用加尾法对提取的外泌体miRNA进行逆转录,获得cDNA样品。采用SYBR法对外泌体miRNA进行定量检测。实验采用相对定量法,在TRIzol裂解后迅速加入秀丽线虫的cel-miR-39作为外参基因,应用△Ct进行数据分析(△Ct=miR-21的Ct值-miR-39的Ct值),以△Ct代表miR-21表达水平。
1.5 CTC和外泌体miR-21对GGO患者的诊断效能采用MedCalc 15.0软件绘制ROC曲线来确定CTC和外泌体miR-21对GGO患者的诊断效能。区别癌症与非癌症患者的最佳截域值(cutoff)通过ROC曲线分析得出,计算CTC和外泌体miR-21的AUC、灵敏度和特异度。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。患者的病史,患不同疾病百分比、吸烟率和CTC阳性率组间比较采用χ2检验或Fisher确切概率法,应用K-S检验对数据进行正态性检验;患者的平均年龄、体质量指数(BMI)、手术时间、失血量和术后住院时间以x±s表示,组间比较采用t检验,对于不满足正态分布的CTC及外泌体miR-21表达水平以中位数(95%可信区间)表示,组间比较采用秩和检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者的基线特征2组患者平均年龄、BMI、手术时间、失血量、术后住院时间和患肺部疾病、心脏疾病百分比及患者吸烟率等方面比较,差异无统计学意义(P>0.05),具有可比性。2组患者基线特征见表 1。
| Group | n | Age (year) |
BMI(kg·m-2) | Diabetesn [n(η/%)] |
Pulmonary history [n(η/%)] |
Cardiac history [n(η/%)] |
n | Smoking history [n(η/%)] | Working outside home[n(η/%)] | Operating time (t/min) | Blood loss (V/mL) | Postoperative hospital stay(t/d) |
| Control | 46 | 45.68±7.74 | 26.13±5.21 | 5(10.87) | 1(2.17) | 1(2.17) | 46 | 18(39.13) | 5(10.87) | 74.54±9.01 | 40.18±10.82 | 4.21±1.87 |
| Case | 24 | 49.48±10.64 | 24.53±5.28 | 3(12.50) | 0(0) | 0(0) | 24 | 10(41.67) | 6(25.00) | 80.98±10.31 | 32.36±15.58 | 4.46±1.33 |
| χ2 / t | 0.327 | 0.702 | 0.041 | 0.529 | 0.529 | 0.042 | 2.378 | 1.135 | 0.655 | 0.542 | ||
| P | 0.607 | 0.436 | 0.839 | 0.467 | 0.467 | 0.837 | 0.123 | 0.259 | 0.514 | 0.589 |
2组不同病理类型患者CTC阳性率比较差异无统计学意义(P>0.05),其中病例组患者CTC阳性率(75.00%)与对照组患者CTC阳性率(4.34%)比较差异有统计学意义(χ2=38.579,P < 0.05),见表 2。对照组和病例组患者CTC中位值分别为9.18(6.12~14.39)和14.57(12.01~17.15),肺癌患者CTC水平高于良性病变患者(P < 0.05)。
| Group | n | CTC positive rate(η/%) | χ2 /t | P |
| Control | 46 | 4.34(2/46) | ||
| Focal interstitial fibrosis | 39 | 5.13(2/39) | 0.356 | 0.837 |
| Machine pneumonia | 5 | 0(0/5) | ||
| Bleeding | 2 | 0(0/5) | ||
| Case | 24 | 75.00(18/24) | ||
| BAC | 14 | 85.71(12/14) | 1.097 | 0.778 |
| AAH | 1 | 0 | ||
| AIS | 4 | 50.00(2/4) | ||
| MIA | 5 | 80.00(4/5) |
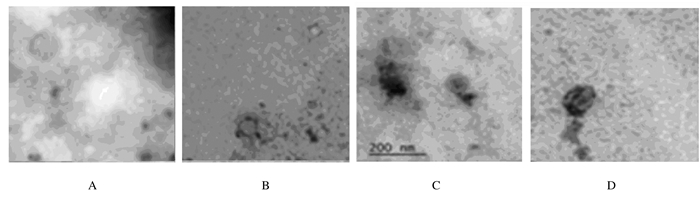
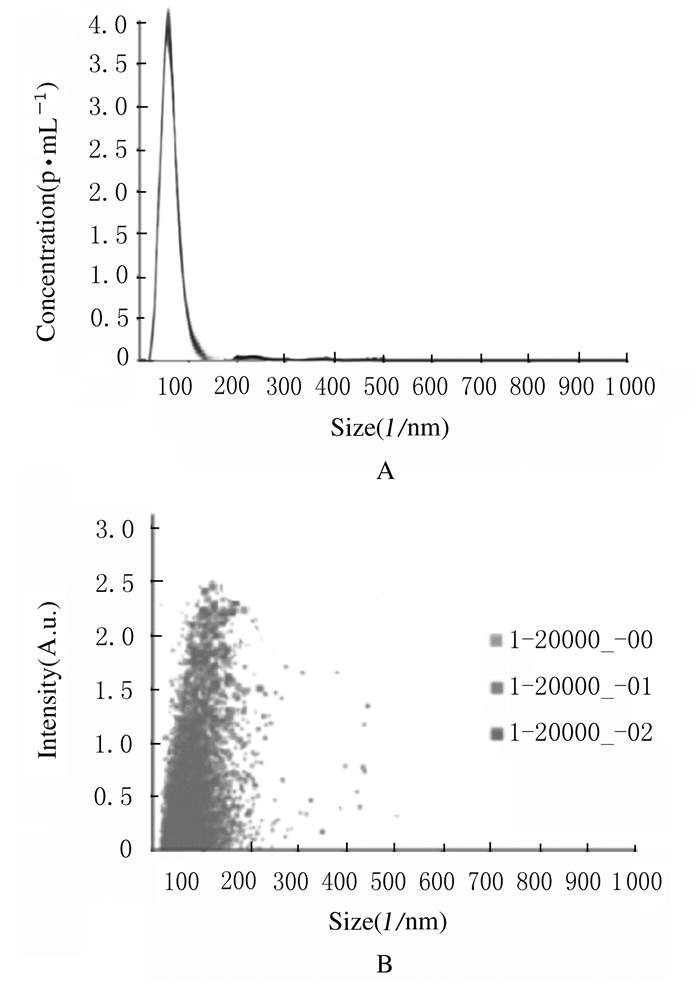
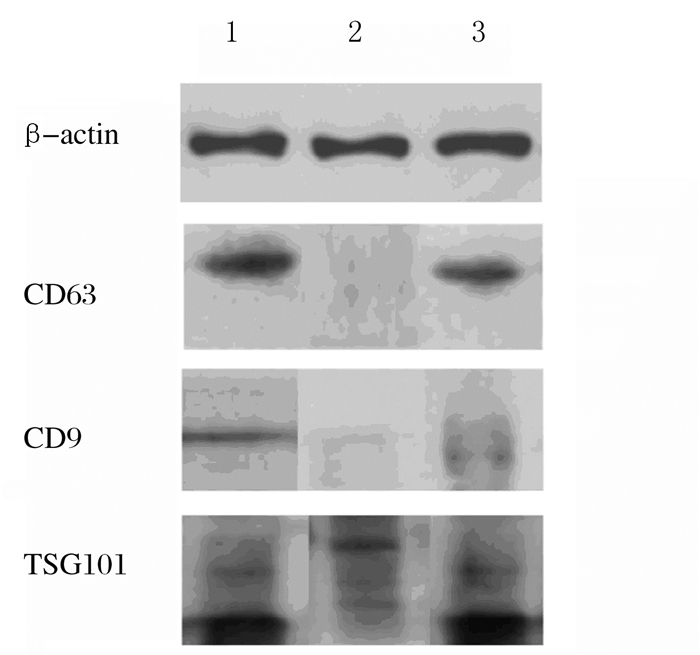
磷钨酸负染外泌体后,电镜下观察可见视野内直径约为100 nm的圆形具有脂质双层膜囊状的颗粒,见图 1。颗粒直径呈单峰正态分布曲线,峰值约为61 nm,颗粒主要分布于40~150 nm,颗粒浓度分散均匀,见图 2。Western blotting法检测结果显示:血清外泌体3种表面标志蛋白CD63、TSG101和CD9均有表达,见图 3。本实验中样品具有外泌体的典型特性,样品中含有大量外泌体颗粒。
|
| A:Round particles(Diameter=100 nm); B:Nueven particle size; C:Clear double-layer structure; D:Double-layer cystic granules. 图 1 电镜下观察外泌体颗粒的形态表现(Bar=200 nm) Fig. 1 Morphology of exosome particles observed under electron microscope(Bar=200 nm) |
|
|
|
| 图 2 NTA检测样品中颗粒的直径(A)和颗粒散布情况(B) Fig. 2 Particle diameter (A) and particle dispersion(B) of samples detected by NTA test |
|
|
|
| Lane 1, 3: Exocrine samples; Lane 2: Blank control. 图 3 Western blotting法检测外泌体样品中外泌表面标志蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of surface marker proteins in exosome samples detected by Western blotting method |
|
|
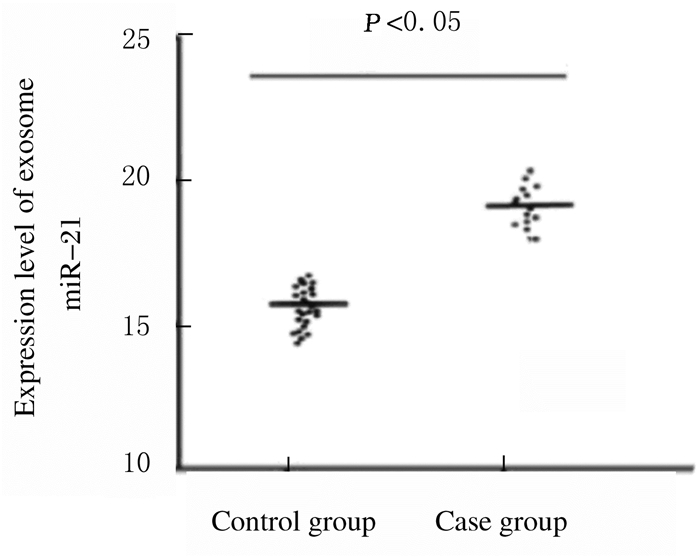
与对照组比较,病例组患者血清外泌体miR-21表达水平明显升高(P < 0.05)。见图 4。
|
| 图 4 2组患者血清外泌体miR-21的表达水平 Fig. 4 Expression levels of exosome miR-21 in serum of patients in two groups |
|
|
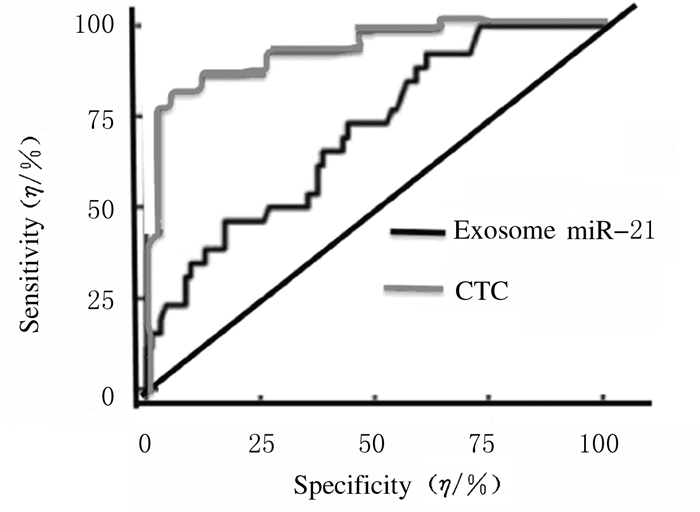
CTC的AUC为0.891, 外泌体miR-21的AUC为0.711,具有较好的特异性,见图 5。CTC和外泌体miR-21联合检测试验的灵敏度和特异度见表 3。本研究中的患者均于本科室门诊进行随访观察,未发现异常情况。
|
| 图 5 病例组患者CTC和外泌体miR-21的AUC Fig. 5 AUC of CTC and miR-21 of patients in case group |
|
|
| Group | AUC | Sensitivity(η/%) | Specificity(η/%) | PV+(η/%) | PV-(η/%) | YI | P |
| CTC | 0.891(0.786-0.962) | 76.34 | 90.23 | 85.51 | 70.34 | 0.6657 | 0.00 1 |
| miR-21 | 0.711(0.654-0.793) | 80.97 | 75.43 | 70.56 | 75.56 | 0.5640 | 0.00 2 |
| Combined detection | 0.803(0.763-0.873) | 85.64 | 86.79 | 85.31 | 84.57 | 0.7243 | 0.00 1 |
| PV+:Positive predict value; PV-:Negative predict value; YI: Youden index. | |||||||
尽管最近科学研究进展迅速,但非小细胞肺癌(non-small cell lung cancer,NSCLC)仍然是一种毁灭性的疾病,整体预后不良;影响预后主要的因素包括在无症状期早期诊断疾病的障碍、其生物学的多样性和复杂性以及肿瘤的进展。由于肺肿瘤组织很难获得无创和潜在危险的过程,因此很难通过连续组织活检监测治疗反应。无创但可靠的血液肿瘤标志物的开发已成为一个重要的研究领域。近年来被发现的循环生物标志物包括CTC、循环的无细胞核酸(循环肿瘤DNA和microRNA)和其他生物标记物(基因组和蛋白质组特征)。这些生物标记物不仅具有预测价值,还可以通过监测肿瘤负担、检测最小残留病和(或)复发性疾病以及在整个治疗过程中监测基因改变来帮助制订治疗决策。近年来,有关液体活检的研究很多,但仍无一种比较特异的诊断方法能在临床得到满意的效果,尤其在早期肺癌的诊断方面[5]。由于GGO的发病率在逐步升高,而且其中大部分均为早期肺癌,所以本研究着重研究了GGO的液体活检方法。
CTC是由原发肿瘤脱落并在血流中循环的癌细胞。CTC是澳大利亚医生ASHWOTH首次提出的,是指从原发肿瘤或转移瘤迁移出基底膜并通过组织基质进入血管的肿瘤细胞的统称,其在肺癌的诊断、治疗和预后评估方面起重要作用[20-21]。CTC作为“肿瘤液体活检”的一种形式,为肿瘤转移的机制研究、肿瘤的治疗和肿瘤基因型的演变提供了重要的信息。然而,CTC在外周血中含量极低,CTC的异质性是其分离和表征的重大技术挑战。敏感的CTC检测将进行广泛的临床应用,包括早期疾病检测、治疗反应和疾病进展评估[22]。液体活检,尤其是外泌体,携带肿瘤特异性分子,并在肿瘤的诊断和“实时监测”过程中提供有用的信息。外泌体是由细胞自主产生、自主分泌、具有脂质双层膜结构、直径为40~100 nm的盘状小囊泡;其可像“通信船”一样包裹、传递miRNA及蛋白质等多种重要物质[23]。外泌体经常由多种细胞释放,包括大量的癌细胞产物,并广泛存在于体液中。肿瘤外泌体可以通过与靶细胞的交叉对话来重塑肿瘤支持的微环境。最近的研究[24]主要集中在体外的miRNA和少量的蛋白质。细胞外分泌的miRNA存在于复杂的特殊蛋白质中或被封装在称为外泌体的微囊中,作为细胞间通讯的手段在细胞间传递。鉴于miRNA在体液中的稳定性以及其在解开癌症相关遗传途径方面的良好记录作用,其对开发分泌miRNA作为检测、诊断和预测癌症的液体活检生物标志物有重要意义[25]。其中miR-21是研究较多的一种致癌的miRNA,存在于大量肿瘤组织中,如肺癌、肝癌、大肠癌、胃癌、乳腺癌、膀胱癌和脑胶质瘤组织[26-27]。miR-21已被证实可控制多种肿瘤抑制基因,如PDCD4、BCL2和CCL20等,从而发挥其致癌作用[28-30]。CTC是由原发肿瘤脱落并在血流中循环的癌细胞,但本研究结果显示:CTC在对照组患者血清中也存在,只是数量有差异。本文作者认为:免疫细胞化学技术、RT-PCR和流式细胞术等方法相结合,可提高检测CTC的敏感度和特异度。当然这一结果的出现也不排除一部分隐匿性癌的存在,这可能会导致本研究存在不足,未来需要大样本量及长期的观察随访进一步确定。在某些情况下,非肿瘤标志物的表达以及手术或采血均会造成假阳性结果;而分离过程中CTC的丢失和循环中的肿瘤细胞高度异质性等因素则会造成假阴性结果[31]。
目前,单独使用CTC或外泌体miR-21检测来进行恶性肿瘤尤其是早期肺癌的诊断均未大规模应用于临床。因此本课题组试图通过将二者联合进行检测以期达到更加准确的诊断早期恶性疾病的效果,尤其是为GGO的临床处理策略提供更加真实有效的参考,从而避免过度医疗或者医疗不足的发生。本研究结果显示:病例组患者CTC阳性率(75.00%)与对照组(4.34%)比较差异具有统计学意义。进一步分析不同病理类型患者CTC检测结果提示:同是恶性疾病的不同病理类型间CTC阳性率比较差异无统计学意义,同是良性疾病的不同病理类型间CTC阳性率比较差异无统计学意义,说明CTC检测的特异性较好;同时对外泌体的分析显示:纯化样品具有外泌体的典型特性,样品中含有大量外泌体颗粒,病例组患者外泌体miR-21表达水平升高,与对照组比较差异有统计学意义。CTC的AUC为0.891,外泌体miR-21的AUC为0.711,均具有良好的特异性。二者联合检测可有效提高GGO患者的诊断特异度,有效地避免了应用单一检测方法而带来的漏诊率。
尽管有研究[32-33]表明CTC或血清外泌体miRNA有更高的灵敏度和特异度,但二者联合检测研究尚未出现,仍需更多研究对于GGO的诊断效能进行验证。本研究的不足之处在于缺乏对CTC和血清外泌体miRNA检测结果的一致性的对比研究。本课题组将继续在这一领域进行探索,包括进一步扩大病例数,对本实验中被诊断为良性GGO的患者进行长期跟踪随访验证,进一步观察其能否提高现有肺癌实验室诊断方法的诊断效能,辅助GGO患者的临床诊断和鉴别诊断。
| [1] | JAKOBSEN K R, PAULSEN B S, BAEK R, et al. Exosomal proteins as potential diagnostic markers in advanced non-small cell lung carcinoma[J]. J Extra Cell Vesicles, 2015, 2(4): 26659. |
| [2] | FAIELLA E, FRAUENFELDER G, SANTUCCI D, et al. Percutaneous low-dose CT-guided lung biopsy with an augmented reality navigation system:validation of the technique on 496 suspected lesions[J]. Clin Imaging, 2018, 49(5): 101–105. |
| [3] | NADEALIAN Z, NAZARI B, SADRI S, et al. Detection of pulmonary nodules in low-dose computed tomography using localized active contours and shape features[J]. J Med Signals Sens, 2017, 7(4): 203–212. |
| [4] | PENG Y, WANG Y, HAO X, et al. Utility of multiple increased lung cancer tumor markers in treatment of patients with advanced lung adenocarcinoma[J]. Chin J Lung Cancer, 2017, 20(10): 690–694. |
| [5] | XU-WELLIVER M, CARBONE D P. Blood-based biomarkers in lung cancer:prognosis and treatment decisions[J]. Transl Lung Cancer Res, 2017, 6(6): 708–712. DOI:10.21037/tlcr |
| [6] | MANICONE M, SCAINI M C, RODRIQUENZ M G, et al. Liquid biopsy for monitoring anaplastic lymphoma kinase inhibitors in non-small cell lung cancer:two cases compared[J]. J Thorac Dis, 2017, 9(Suppl 13): S1391–S1396. |
| [7] | TARTARONE A, LEROSE R, RODRIQUENZ M G, et al. Molecular characterization and prognostic significance of circulating tumor cells in patients with non-small cell lung cancer[J]. J Thorac Dis, 2017, 9(Suppl 13): S1359–S1363. |
| [8] | RECLUSA P, TAVERNA S, PUCCI M, et al. Exosomes as diagnostic and predictive biomarkers in lung cancer[J]. J Thorac Dis, 2017, 9(Suppl 13): S1373–S1382. |
| [9] | RⅡHIMAKI M, THOMSEN H, HEMMINKI A, et al. Comparison of survival of patients with metastases from known versus unknown primaries:survival in metastatic cancer[J]. BMC Cancer, 2013, 13(1): 36–44. DOI:10.1186/1471-2407-13-36 |
| [10] | HARRIS D A, PATEL S H, GUCEK M, et al. Exosomes released from breast cancer carcinomas stimulate cell movement[J]. PLoS One, 2015, 10(3): e0117495. DOI:10.1371/journal.pone.0117495 |
| [11] | MOREAU F, SEYFRITZ E, TOTI F, et al. Early effects of liver regeneration on endocrine pancreas:in vivo change in islet morphology and in vitro assessment of systemic effects on betacell function and viability in the rat model of two-thirds hepatectomy[J]. Horm Metab Res, 2014, 46(13): 921–926. DOI:10.1055/s-00000025 |
| [12] | YOO C E, KIM G, KIM M, et al. A direct extraction method for microRNAs from exosomes captured by immunoaffinity beads[J]. Anal Biochem, 2012, 431(2): 96–98. DOI:10.1016/j.ab.2012.09.008 |
| [13] | 周清华, 范亚光, 王颖, 等. 中国肺部结节分类、诊断与治疗指南(2016年版)[J]. 中国肺癌杂志, 2016, 19(12): 793–798. DOI:10.3779/j.issn.1009-3419.2016.12.12 |
| [14] | 刘春全, 崔永. 肺结节评估四大指南比较分析[J]. 中国肺癌杂志, 2017, 20(7): 490–498. |
| [15] | XIAO F, JIANG M Y, DU D S, et al. Orexin A regulates cardiovascular responses in stress-induced hypertensive rats[J]. Neuropharmacology, 2013, 67: 16–24. DOI:10.1016/j.neuropharm.2012.10.021 |
| [16] | JIANG M Y, WANG Q, KARASAWA T, et al. Sodium-glucose transporter-2(SGLT2; SLC5A2) enhances cellular uptake of aminoglycosides[J]. PLoS One, 2014, 9(9): e108941. DOI:10.1371/journal.pone.0108941 |
| [17] | 连欢欢, 丁志丹, 袁东风, 等. 应用FR靶向PCR法检测CTC在肺癌诊断中的临床价值:初步研究[J]. 中国肺癌杂志, 2016, 19(12): 813–820. DOI:10.3779/j.issn.1009-3419.2016.12.03 |
| [18] | WANG L, WU C Y, QIAO L H, et al. Clinical significance of folate receptor-positive circulating tumor cells detected by ligand-targeted polymerase chain reaction in lung cancer[J]. J Cancer, 2017, 8(1): 104–110. DOI:10.7150/jca.16856 |
| [19] | RODRÍGUEZ M, SILVA J, LÓPEZ-ALFONSO A, et al. Different exosome cargo from plasma/bronchoalveolar lavage in non-small-cell lung cancer[J]. Genes Chromosomes Cancer, 2014, 53(9): 713–724. |
| [20] | LI J, YANG F, LI X, et al. Characteristics, survival, and risk factors of Chinese young lung cancer patients:the experience from two institutions[J]. Oncotarget, 2017, 8(51): 89236–89244. |
| [21] | GHOSSEIN R A, CARUSONE L, BHATTACHERYA S. Review:poly-merase chain reaction detection of micrometastase and circulating tumor cells:application to melanoma, prostate, and thyroid carcinomas[J]. Diagn Mol Pathol, 1999, 8(4): 165–175. DOI:10.1097/00019606-199912000-00001 |
| [22] | HUANG Q Q, WANG Y, CHEN X X, et al. Nanotechnology-Based strategies for early cancer diagnosis using circulating tumor cells as a liquid Biopsy[J]. Nanotheranostics, 2018, 2(1): 21–41. DOI:10.7150/ntno.22091 |
| [23] | TKACH M, THÉRY C. Communication by extracellular vesicles:where we are and where we need to go[J]. Cell, 2016, 164(6): 1226–1232. DOI:10.1016/j.cell.2016.01.043 |
| [24] | LI A C, ZHANG T B, ZHENG M, et al. Exosomal proteins as potential markers of tumor diagnosis[J]. J Hematol Oncol, 2017, 10(1): 175–184. DOI:10.1186/s13045-017-0542-8 |
| [25] | KAI K, DITTMAR R L, SEN S. Secretory microRNAs as biomarkers of cancer[J]. Semin Cell Dev Biol, 2018, 78: 22–36. |
| [26] | LI M, WANG Y, SONG Y, et al. MicroRNAs in renal cell carcinoma:A systematic review of clinical implications (Review)[J]. Oncol Rep, 2015, 33(4): 1571–1578. DOI:10.3892/or.2015.3799 |
| [27] | PFEFFER S R, YANG C H, PFEFFER L M. The role of miR- 21 in cancer[J]. Drug Dev Res, 2015, 76(6): 270–277. DOI:10.1002/ddr.v76.6 |
| [28] | GAUR A B, HOLBECK S L, COLBURN N H, et al. Downregulation of Pdcd4 by mir-21 facilitates glioblastoma proliferation in vivo[J]. Neurol-oncology, 2011, 13(6): 580–590. DOI:10.1093/neuonc/nor033 |
| [29] | XU L, WU Z, CHEN Y, et al. MicroRNA-21(miR-21) regulates cellular proliferation, invasion, migration, and apoptosis by targeting PTEN, RECK and Bcl-2 in lung squamous carcinoma, Gejiu City, China[J]. PLoS One, 2014, 9(8): e103698. DOI:10.1371/journal.pone.0103698 |
| [30] | VICINUS B, RUBIE C, STEGMAIER N, et al. miR-21 and its target gene CCL20 are both highly overexpressed in the microenvironment of colorectal tumors:Significance of their regulation[J]. Oncol Rep, 2013, 30(3): 1285–1292. DOI:10.3892/or.2013.2580 |
| [31] | 褚佩英. 肿瘤转移相关标志物:循环肿瘤细胞(CTC)[J]. 临床检验杂志电子版, 2014, 3(3): 675–677. |
| [32] | ZHOU B, XU J W, CHENG Y G, et al. Early detection of pancreatic cancer:Where are we now and where are we going?[J]. Int J Cancer, 2017, 141(2): 231–241. DOI:10.1002/ijc.30670 |
| [33] | 徐亚楠, 赵伟, 李铭, 等. 基于支持向量机的肺CT图像三维磨玻璃结节的提取和识别[J]. 中国医学物理学杂志, 2019, 36(4): 425–430. DOI:10.3969/j.issn.1005-202X.2019.04.011 |
 2019, Vol. 45
2019, Vol. 45


