扩展功能
文章信息
- 焦光美, 单海雷, 窦志杰, 赵亮, 张晓璇, 康玲伶, 马征, 杨宁
- JIAO Guangmei, SHAN Hailei, DOU Zhijie, ZHAO Liang, ZHANG Xiaoxuan, KANG Lingling, MA Zheng, YANG Ning
- 神经生长因子对脑梗死大鼠脑组织中生长分化因子15表达水平的影响
- Effect of nerve growth factor on expression level of growth differentiation factor-15 in brain tissue of rats with cerebral infarction
- 吉林大学学报(医学版), 2019, 45(03): 572-576
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 572-576
- 10.13481/j.1671-587x.20190317
-
文章历史
- 收稿日期: 2018-08-08
急性脑血管病具有发病率高、复发率高和致残率高的特点,主要由脑血栓引起缺血所导致。脑梗死是急性脑血管病中最常见的一种疾病,对急性脑血管疾病尤其是脑梗死的预防与治疗是临床研究的焦点[1-2]。神经生长因子(nerve growth factor, NGF)作为神经营养因子之一,能够改善脑梗死患者的神经功能,对脑梗死导致的神经损伤起保护作用。国内外研究[3-4]表明NGF或诱导因子不足将影响脑卒中后神经功能的进一步恢复。NGF是具有神经元营养和促突起生长双重生物学功能的一种神经细胞生长调节因子,对中枢神经元的发育、分化、生长以及周围神经元损伤修复均具有重要的调控作用,但其作用靶点尚未清楚。生长分化因子15(growth differentiation factor-15,GDF-15)是转化生长因子β超家族成员之一,具有抗炎、抗肿瘤和保护心脑血管的作用,在心脑血管疾病中调控细胞反应[5-6]。本研究通过观察大鼠脑组织中GDF-15表达和神经功能缺损评分的变化,探讨NGF对脑梗死大鼠脑组织中GDF-15表达水平的影响及其可能的作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康成年SD大鼠54只,雄性,8周龄,体质量(250±25)g,由河北省实验动物中心提供,动物合格证号:SXYK(冀)2013-0026。饲养于正常昼夜环境,自由摄食及饮水。NGF[舒泰神(北京)生物制药股份有限公司],DAB试剂盒(北京诺博莱德科技有限公司),免疫组织化学染色试剂盒(北京博奥森生物技术有限公司),GDF-15抗体(美国Santa Cruz公司),GDF-15 ELISA检测试剂盒(英国Abcam公司)。Olympus光学显微镜STM6(日本奥林巴斯公司),THERMO FISHER Multiskan FC酶标仪(美国Thermo公司)。
1.2 实验动物模型的制备参考文献[7]方法制备一侧大脑中动脉阻塞(MCAO)动物模型。将54只SD大鼠随机分为假手术组、模型组和NGF组,每组18只。NGF组大鼠腹腔注射NGF(50 μg·kg-1),每天1次,连续给药7 d。假手术组和模型组大鼠腹腔注射等体积的生理盐水。各组大鼠术前禁食12 h,腹腔注射10%水合氯醛(0.32 mL·kg-1)麻醉,于颈正中切口,钝性分离皮下组织,暴露左侧胸锁乳突肌,分离颈总动脉(CCA),分离皮下组织,游离左侧CCA、颈外动脉(ECA)及颈内动脉(ICA)。采用线栓法(线栓为日本鱼线,将头端烧成一光滑圆球,直径约为0.36 mm)结扎ECA与CCA近心端以血管夹夹闭ICA;于CCA结扎远心端,剪1个小切口,将线栓缓慢导入,松开ICA动脉夹,栓线经CCA顺利进入ICA,于ECA和ICA交汇处稍遇阻力停止,长度约为2 cm,采用缝合线固定栓塞线,缝合皮肤,伤口外用青霉素。假手术组大鼠仅分离各动脉,不结扎栓线。以模型组大鼠苏醒后提尾时左前肢内收屈曲、右眼Horner征、爬行时向左侧划圈和爬行时向左侧倾倒为造模成功[8]。各组大鼠在造模后第1、3和7天分别断头处死6只。
1.3 各组大鼠神经功能评分采用LONGA等[7]的5分法,对大鼠神经功能进行评分,0分:行为正常,神经功能无损伤;1分:左侧前肢不能完全伸展,左侧前肢屈曲;2分:自发行走时向左侧转圈;3分:爬行时向左侧倾倒;4分:不能自发爬行或昏迷。分别于造模后1、3和7 d进行评分,分数越高表明大鼠的神经功能缺损越严重。
1.4 HE染色和免疫组织化学染色法检测各组大鼠脑组织神经元病理形态表现和GDF-15阳性细胞数各组大鼠在相应时间点深度麻醉后,打开胸腔,心脏快速相继灌注温生理盐水,待大鼠前肢和两肺变白,流出液澄清无血色,改用体积分数为4%的多聚甲醛灌注固定,断头取脑,取梗死区(假手术组取全脑组织)进行常规固定、石蜡包埋,连续切片,切片厚度为5 μm。分别进行HE染色和GDF-15免疫组织化学染色。切片在Olympus光学显微镜下观察并采集图像,免疫组织化学染色阳性细胞抗原呈棕褐色,采用图像分析软件Image-Pro Plus 6.0 Software计算各组大鼠脑组织中GDF-15阳性细胞数。
1.5 ELISA法检测各组大鼠脑组织中GDF-15表达水平取大鼠脑组织,分离出脑梗死组织(假手术组大鼠取全脑组织)。冰浴下将脑组织液氮研磨,加入全细胞裂解液裂解细胞,超声破碎,匀浆器研磨,使细胞完全破碎,4℃、12 000r·min-1离心10 min,取上清液,按质量与体积比为1:9加入预冷生理盐水,制备成体积分数为10%的脑组织匀浆液。于反应孔中加入100 μL配制好的样品和标准品,37℃孵育2 h,弃去孔内液体,每孔加检测液A 100 μL,摇匀,37℃下孵育60 min,弃去孔内液体,洗涤液洗板5次,加检测液B 100 μL,37℃孵育60 min,加入90 μL底物。避光37℃孵育30 min。加入50 μL终止液,于酶标仪450 nm波长下测量各孔的吸光度(A)值。计算出相应的浓度,浓度乘以稀释倍数即为脑组织中GDF-15表达水平。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠神经功能评分、脑组织中GDF-15阳性细胞数和脑组织中GDF-15表达水平以x±s表示,对数据进行正态分布检验,符合正态分布的资料多组间比较采用单因素方差分析;各组大鼠神经功能评分、脑组织中GDF-15阳性细胞数和脑组织中GDF-15表达水平组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠神经功能评分假手术组大鼠术后神经功能评分为0分,神经功能无缺损状况。与假手术组比较,模型组和NGF组大鼠各时间点神经功能评分均明显升高(P < 0.05),在术后2 d内分别有1和2只大鼠死亡,随机补充符合造模标准的大鼠。与模型组比较,NGF组大鼠在造模后3和7 d时神经功能评分明显降低(P < 0.05)。见表 1。
| (n=18, x±s) | |||
| Group | Neurological function score | ||
| (t/d) 1 | 3 | 7 | |
| Sham operation | 0 | 0 | 0 |
| Model | 3.33±0.52* | 2.50±0.55* | 2.00±0.63* |
| NGF | 3.00±0.63* | 2.00±0.63*△ | 1.50±0.55*△ |
| *P < 0.05 compared with sham operation group; △P < 0.05 compared with model group. | |||
与假手术组比较,模型组大鼠出现神经元变性、坏死,神经元脱失,脑组织稀疏,胶质细胞增生等。与模型组比较,造模后7 d时NGF组大鼠神经元坏死程度较低,细胞间质水肿、胶质细胞增生程度均较轻。见图 1(插页四)。
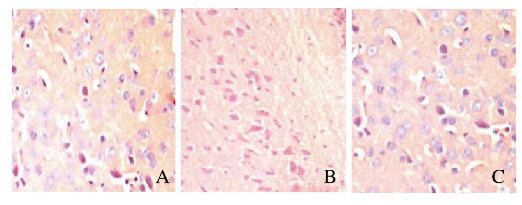
|
| A: Sham operation group; B: Model group; C: NGF group 图 1 各组大鼠脑组织中神经元形态表现(HE,×200) Fig. 1 Morphology of neurons in brain tissue of rats in various groups (HE, ×200) |
|
|
假手术组大鼠脑组织神经元中GDF-15少量表达,阳性细胞胞浆呈棕褐色颗粒。与假手术组比较,模型组和NGF组大鼠术后1、3和7 d时脑组织神经元中GDF-15阳性细胞数明显升高(P < 0.05),随着时间延长,GDF-15阳性细胞数呈逐渐降低趋势。与模型组比较,NGF组大鼠各时间点脑组织神经元中GDF-15阳性细胞数明显升高(P < 0.05)。见图 2(插页四)和表 2。
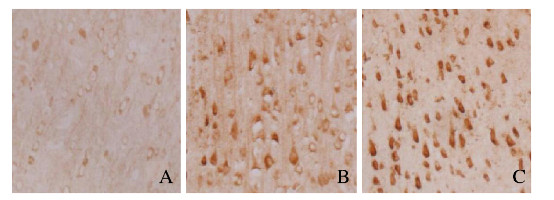
|
| A: Sham operation group; B: Model group; C: NGF group 图 2 造模后7d各组大鼠脑组织神经元中GDF-15的表达(免疫组织化学,×200) Fig. 2 Expressions of GDF-15 in neurons in brain tissue of rats in various groups 7 d after modeling (Immunohistochemisty, ×200) |
|
|
| (n=18, x±s) | |||
| Group | Number of GDF-15 positive cells | ||
| (t/d) 1 | 3 | 7 | |
| Sham operation | 2.67±0.82 | 2.33±0.52 | 2.17±0.75 |
| Model | 30.83±2.79* | 26.67±3.98* | 19.17±3.43* |
| NGF | 41.50±4.32*△ | 31.67±4.41*△ | 28.00±3.29*△ |
| *P < 0.05 compared with sham operation group; △P < 0.05 compared with model group. | |||
与假手术组比较,模型组和NGF组大鼠造模后1、3和7 d脑组织中GDF-15表达水平明显升高(P < 0.05),随着时间延长,GDF-15表达水平呈逐渐降低趋势。与模型组比较,NGF组大鼠造模后1、3和7 d脑组织中GDF-15表达水平均明显升高(P < 0.05)。见表 3。
| [n=18, x±s,ρB/(ng·L-1)] | |||
| Group | Expression level of GDF-15 | ||
| (t/d) 1 | 3 | 7 | |
| Sham operation | 45.83±6.24 | 37.83±5.27 | 44.50±5.01 |
| Model | 127.83±9.09* | 120.17±9.45* | 112.00±6.60* |
| NGF | 140.00±7.04*△ | 131.67±11.74*△ | 123.83±9.15*△ |
| *P < 0.05 compared with sham operation group; △P < 0.05 compared with model group. | |||
随着人们生活水平提高,急性缺血性心脑血管疾病的患病率每年均升高[9]。血液中的各种栓子(心脏内的附壁血栓、动脉粥样硬化的斑块、脂肪、肿瘤细胞、纤维软骨或空气等)随血流进入脑动脉而阻塞血管,当侧支循环不能代偿时,该动脉供血区脑组织缺血性坏死,出现局灶性神经功能缺损。中枢神经细胞的死亡是急性脑梗死神经功能缺损的主要原因[10]。NGF是一种能够促进神经细胞生长发育的因子,具有调节神经损伤、平衡交感神经和感觉神经功能,以此维持大脑发育和保护人体神经系统[11]。NGF在神经元的分化、生长和功能维持中起重要作用,最初将其作为治疗神经系统疾病的药物[12]。研究[13]表明NGF可增强脑组织中小胶质细胞的神经保护和抗炎功能。已有研究[14]表明各种中枢神经损伤后应用外源性NGF可维持神经元生存,促进神经纤维增生及神经功能的恢复。研究[15]证实:NGF不仅可以启动促进细胞存活的信号,同时也可以抑制P75诱导的神经细胞凋亡信号,从而促进神经元的再生和功能恢复。
GDF-15是转化生长因子β超家族成员,具有较高的特异性,一般情况下在前列腺和胎盘中处于高表达,而在心脏以及一些外周器官中有少量表达。作为一种新型应激蛋白,在机体应激状态下发挥重要作用。脑梗死患者外周血GDF-15水平明显升高,其水平动态变化可反映脑血管病的发生发展,反映脑损伤的严重程度,对脑血管疾病具有指导意义[16-17]。有文献[18-21]报道:GDF-15又称为心脏保护因子,在心肌细胞缺血再灌注和其他可触发氧化应激的心血管事件如心脏负荷过大、心力衰竭和冠状动脉粥样硬化等情况下,脑组织中GDF-15表达水平可快速上调。最新研究表明:GDF-15对胚胎和受损的中脑多巴胺能神经元有较强的神经元保护作用。本研究检测结果显示:造模后模型组大鼠脑组织中GDF-15表达水平明显升高,与相关研究[21]结果一致,说明GDF-15在脑梗死的发生发展中发挥重要作用,GDF-15表达水平随着时间缓慢降低,说明其与脑梗死的严重程度有关。
本研究结果显示:造模后7 dNGF组大鼠的神经元变性、坏死,神经元脱失,脑组织稀疏,胶质细胞增生情况明显减缓。脑梗死大鼠给予NGF后其神经功能评分较模型组升高,NGF组大鼠脑组织中GDF-15表达水平明显高于假手术组和模型组,说明NGF给药后能迅速发挥神经保护作用,改善神经功能。造模后1 d模型组和NGF组大鼠脑组织中GDF-15表达水平最高,随着时间推移,GDF-15表达水平呈下降趋势。造模后1、3和7 d NGF组大鼠神经功能评分下调,脑组织中GDF-15表达水平均明显升高,与假手术组和模型组比较差异均有统计学意义。
综上所述,NGF可通过上调脑梗死模型大鼠脑组织中GDF-15表达水平,改善大鼠神经行为学,对神经起保护作用,具有进一步的临床研究价值。
| [1] | SHI J, HUANG X X, LI G H, et al. Cerebral venous sinus thrombosis in Behcet's disease:A retrospective case-control study[J]. Clin Rheumatol, 2018, 37(1): 51–57. DOI:10.1007/s10067-017-3718-2 |
| [2] | 张川荛, 俞志成, 李树清, 等. 缺血后适应减轻树鼩缺血性脑水肿及脑梗死的机制[J]. 解剖学报, 2017, 48(2): 135–141. |
| [3] | 陈奋伟. 注射用鼠神经生长因子对急性脑梗死患者神经功能康复的影响[J]. 中国医药科学, 2017, 7(5): 65–67. DOI:10.3969/j.issn.2095-0616.2017.05.018 |
| [4] | WANG Y, ZHANG H, WANG Z, et al. Therapeutic effect of nerve growth factor on canine cerebral infarction evaluated by MRI[J]. Oncotarget, 2018, 9(3): 3741–3751. |
| [5] | LEE J, LEE H, CHOI J, et al. Abstract 5147:Tumor angiogenesis-promoting activity of a hypoxia-inducible cytokine, growth differentiation factor-15(GDF-15)[J]. Cancer Res, 2011, 71(8): 5147–5148. |
| [6] | SUBRAMANIAN P, MITROULIS I, HAJISHENGALLIS G, et al. Regulation of tissue infiltration by neutrophils:role of integrin α3β1 and other factors[J]. Curr Opin Hematol, 2016, 23(1): 36–43. DOI:10.1097/MOH.0000000000000198 |
| [7] | LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84–91. DOI:10.1161/01.STR.20.1.84 |
| [8] | 张振国, 李雪峰, 朱淑珍, 等. 介入法建立大鼠冠状动脉微栓塞模型[J]. 重庆医科大学学报, 2018, 43(3): 338–342. |
| [9] | 孔增梅. 心脑血管疾病临床分析及治疗[J]. 世界最新医学信息文摘, 2017, 17(27): 46–47. |
| [10] | GUO Y B, JI T F, ZHOU H W, et al. Effects of microRNA-21 on nerve cell regeneration and neural function recovery in diabetes mellitus combined with cerebral infarction rats by targeting PDCD4[J]. Mol Neurobiol, 2018, 55(3): 2494–2505. DOI:10.1007/s12035-017-0484-8 |
| [11] | LEWIN G R, LECHNER S G, SMITH E S. Nerve growth factor and nociception:from experimental embryology to new analgesic therapy[J]. Handb Exp Pharmacol, 2014, 220: 251–282. DOI:10.1007/978-3-642-45106-5 |
| [12] | 鲁基永, 龚玉竹, 米忠友, 等. 神经生长因子治疗急性颅脑损伤的效果及对患者神经功能的影响[J]. 现代生物医学进展, 2017, 17(14): 2714–2717. |
| [13] | RIZZI C, TIBERI A, GIUSTIZIERI M, et al. NGF steers microglia toward a neuroprotective phenotype[J]. Glia, 2018, 66(7): 1395–1416. DOI:10.1002/glia.v66.7 |
| [14] | HEED T, BEURZE S M, TONI I, et al. Functional rather than effector specific organinaztion of human posterior parietal cortex[J]. Neurosci, 2011, 31: 3066. DOI:10.1523/JNEUROSCI.4370-10.2011 |
| [15] | ZHOU Z, CHEN H S, ZHANG K C, et al. Protective effect of nerve growth factor on neurons after traumatic brain injury[J]. J Basic Clin Physiol Pharmacol, 2003, 14: 217. |
| [16] | 郎志峰. 急性脑梗死病人外周血GDF-15的动态观察及其与脑梗死关系的研究[J]. 中西医结合心脑血管病杂志, 2016, 14(24): 2959–2961. DOI:10.3969/j.issn.1672-1349.2016.24.037 |
| [17] | SCHINDOWSKI K, VON BOHLEN UND HALBACH O, STRELAU J, et al. Regulation of GDF-15, a distant TGF-β superfamily member, in a mouse model of cerebral ischemia[J]. Cell Tissue Res, 2011, 343(2): 399–409. DOI:10.1007/s00441-010-1090-5 |
| [18] | 田立超.生长分化因子-15与冠心病冠脉病变程度的相关性分析[D].唐山: 华北理工大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10081-1016784065.htm |
| [19] | 周静, 罗勇, 姚珊, 等. 急性缺血性脑卒中患者血清HCY、GDF-15、GFAP水平与神经功能及预后的关系[J]. 山东医药, 2017, 57(18): 46–48. DOI:10.3969/j.issn.1002-266X.2017.18.016 |
| [20] | 刘琳, 魏丽萍. 急性脑梗死患者血液中GDF-15、CRP水平及相关性研究[J]. 临床和实验医学杂志, 2016, 15(8): 739–741. DOI:10.3969/j.issn.1671-4695.2016.08.007 |
| [21] | 刘文, 张欢, 钱琳. 丹红注射液对大鼠脑缺血再灌注后GDF-15表达的影响研究[J]. 中南药学, 2014, 12(9): 876–879. |
| [22] | 栗先增, 顾伯林, 周红, 等.项针治疗对脑梗死患者吞咽功能的影响[L].解放军医学杂志: 2019, 44(4): 322-326. |
 2019, Vol. 45
2019, Vol. 45


