扩展功能
文章信息
- 李叙颖, 张兰, 王琳, 武佳琦, 范思有, 刘佳
- LI Xuying, ZHANG Lan, WANG Lin, WU Jiaqi, FAN Siyou, LIU Jia
- 软坚消瘿颗粒对肝郁脾虚型桥本甲状腺炎模型大鼠Treg和Th17细胞因子表达的影响
- Effects of RuanJianXiaoYing Granule on expressions of Treg and Th17 cytokines in Hashimoto thyroiditis model rats with liver depression and spleen deficiency
- 吉林大学学报(医学版), 2019, 45(03): 558-565
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 558-565
- 10.13481/j.1671-587x.20190315
-
文章历史
- 收稿日期: 2018-08-21
2. 辽宁中医药大学附属医院内分泌科, 辽宁 沈阳 110032
2. Department of Endocrinology, Affiliated Hospital, Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China
桥本甲状腺炎(Hashimoto’ s thyroiditis,HT)是一种以体内出现甲状腺特异性自身抗体和甲状腺淋巴细胞浸润为主要特征,最终导致甲状腺组织结构破坏的一种慢性炎症性自身免疫疾病,也是临床中最常见的导致甲状腺功能减退症的原因。
HT属于中医学“瘿病”范畴,《济生方·瘿瘤论治》中云:“夫瘿瘤者,多由喜怒不节,忧思过度而成斯疾焉”。传统医学认为本病发病主要与情志内伤、饮食失调等因素关系密切,从而导致肝郁脾虚,机体脏腑功能失调,气滞、痰凝和血瘀等搏结于颈前而发病。本课题组前期研究[1-2]已证实:基于疏肝健脾法组方的软坚消瘿颗粒,可以通过调节Th1/Th2相关细胞因子的平衡,起到降低甲状腺球蛋白抗体(thyroglobulin antibody, TGAb)和甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)水平,减轻甲状腺病理损伤,调节机体自身免疫功能的作用。近年来,调节性T细胞(regulatory T cells,Treg)和辅助性T细胞17(helper T cells 17,Th17)相继被发现。在正常情况下两者保持动态平衡,病理情况下二者失衡,免疫应答出现异常,可导致多种自身免疫性疾病的发生[3]。最近关于甲状腺疾病的研究[4-6]表明:Treg和Th17及其相关细胞因子的平衡在HT发生发展和病程演变中起重要作用。目前国内外关于HT动物实验研究中尚未见有关采用病证结合造模法,再以疏肝健脾法进行治疗的报道。本研究从Treg与Th17细胞特异性转录因子和相关细胞因子的表达角度,探讨软坚消瘿颗粒对肝郁脾虚型HT大鼠的治疗作用机制。
1 材料与方法 1.1 实验动物、药品、主要试剂和仪器SPF级雌性SD大鼠,同批次体质量为160~180g,购于辽宁长生生物技术有限公司,动物许可证号:SCXK(辽)2015-0001,适应环境7d后开始实验。软坚消瘿颗粒:由柴胡、白芍、茯苓、白术、当归、海藻和昆布等药物组成(江阴天江药业有限公司);雷公藤多苷片(国药准字:Z32021007,江苏美通制药有限公司)。无水碘化钠和甲状腺球蛋白(thyroglobulin,Tg)(货号:AQ032244、QA052105,安徽酷尔生物工程有限公司),弗氏不完全佐剂(Freund’ s Adjuvant,incomplete IFA)和弗氏完全佐剂(Freund’ s Adjuvant,complete CFA)(货号:F5506、F5881,美国Sigma公司),TPO-Ab和TGAb酶联免疫分析试剂盒(货号:m1048720、m1003044,上海酶联生物科技有限公司),血清游离三碘甲腺原氨酸(free triiodothyronine, FT3)、游离甲状腺素(free thyroxine, FT4)、促甲状腺激素释放激素(thyrotropin-releasing hormone, TRH)和促甲状腺激素(thyrotropin, TSH)酶联细胞免疫分析试剂盒(货号:CEA186Ge、CEA185Ge、CEA839Ra、CEA463Ra,武汉优尔生商贸有限公司),白细胞介素10(IL-10)、IL-17和IL-23酶联细胞免疫分析试剂盒(货号:SEA056Ra、SEA063Ra、SEA384Ra,武汉优尔生商贸有限公司),BCA蛋白浓度测定试剂盒(货号:P0010S,上海碧云天生物技术有限公司),ECL发光试剂盒(货号:PE0010,北京索莱宝生物科技有限公司),双头叉转录因子p3(Foxp3)抗体(货号:BA2032-2,武汉博士德生物技术有限公司),维甲酸相关核孤儿受体γt (retinoic acid related nuclear orphan receptor γt, RORγt)抗体(货号:ab113434,美国Abcam公司),HRP标记的二抗(北京中杉金桥公司)。酶标仪(MultiskanMK3型,上海赛默飞世尔仪器有限公司),低温高速离心机(D37520型,德国),数显电子恒温水浴锅(SHA-B型,常州国华电器有限公司),石蜡切片机(LEICARM2235型)、组织石蜡包埋机(EG1150型)和全自动脱水机(LEICA300型)(德国莱卡公司),数码显微镜(BX41型,日本Olympus公司),电泳仪(EPS300型,上海天能科技有限公司),全自动数码凝胶图像分析系统(Tanon-4200SF型,上海天能科技有限公司),垂直板电泳装置(VE-180型,上海天能科技有限公司)。
1.2 造模和模型评价 1.2.1 造模药物配制高碘水:将0.64 g碘化钠晶体与1 L蒸馏水混合,配成浓度为0.64 g·L-1的高碘水。抗原溶液:将甲状腺球蛋白(1 g·L-1)溶于磷酸盐缓冲液(PBS)中。初次免疫乳化剂:将弗氏完全佐剂和抗原溶液以1:1体积比分别吸入2个注射器中,2个注射器之间以1个细胶管相连,交替推动针管,直至形成黏稠的乳化剂为止,使其最终浓度达500 mg·L-1,现配现用。加强免疫乳化剂:将弗氏不完全佐剂和抗原溶液以1:1体积比,如同初次免疫乳化剂制备方法,制备成500 mg·L-1的油包水乳状液。
1.2.2 HT模型的制备适应性喂养1周后,采用随机数字法将大鼠分为正常组(12只)和造模组(36只)。实验开始第2周起,造模组大鼠饮用高碘水,正常组大鼠给予蒸馏水;第4周的第1天和第4天,造模组大鼠于双后足皮下多点注射初次免疫乳化剂,每只给予0.2 mL;第5~8周,造模组大鼠后背皮下多点注射加强免疫乳化剂,每次0.2 mL,每周1次。
1.2.3 肝郁脾虚证模型的制备实验第5周起,造模组大鼠采用慢性束缚应激、过度疲劳和饮食失节等复合方法造模,首先采用自制束缚筒限制大鼠活动,每天1 h;单日令其游泳至耐力极限,同时喂饲甘蓝;双日喂饲正常颗粒饲料,同时给予猪油脂(1 mL·100 g-1)经口灌胃,连续4周。
1.2.4 模型制备成功的评价标准造模后即实验第9周第1天,各组大鼠经球后静脉丛穿刺采集全血2 mL,分离血清,检测血清中甲状腺自身抗体TGAb和TPOAb水平。将正常组和造模组大鼠血清中甲状腺自身抗体TGAb和TPOAb水平进行对比,评价模型是否制备成功。将正常组和造模组大鼠血清中甲状腺自身抗体TGAb和TPOAb水平进行比较,造模组大鼠TGAb和TPOAb水平高于正常组均值2倍及以上视为造模成功。
1.3 动物分组和给药将成模后的大鼠随机分为模型组、雷公藤组和软坚消瘿组。所有大鼠每日灌胃2次,上午9:00和下午3:00各1次,给药周期为8周。大鼠给药剂量参考徐叔云等[7]主编的《药理实验方法学》,并根据每周大鼠体质量的变化来计算。正常组和模型组大鼠每次给予2 mL蒸馏水;以雷公藤作为阳性对照药,将雷公藤多苷片研磨后溶于蒸馏水配成混悬液,给药剂量以9.45 mg·kg-1·d-1的生药量计算,分2次灌胃;软坚消瘿组,将配方颗粒用开水冲化调匀后,按16.17 g·kg-1·d-1的生药量计算,分2次灌胃。
1.4 标本采集治疗后所有大鼠禁食不禁水24 h,再给予3.5 mL·kg-110%水合氯醛腹腔注射麻醉;沿腹白线剪开腹腔,行腹主动脉釆血,分离血清,-80 ℃冻存备用。从大鼠头颈部气管处迅速取出甲状腺,分为2份,一份置于冻存管中,放入液氮中速冻,再转至-80℃低温冰箱中储存备用;另一份置于10%中性甲醛溶液中固定,常温保存,用于石蜡切片制作。
1.5 一般情况检测观察大鼠毛色、精神状态、摄食、质量、活动情况、造模期间的束缚反应和大便质地等情况的变化。
1.6 ELISA法检测各组大鼠血清甲状腺抗体、甲状腺功能指标和相关细胞因子水平采用ELISA法检测大鼠血清中TGAb、TPOAb、FT3、FT4、TRH、TSH、IL-10、IL-17和IL-23水平。操作方法按照试剂盒中说明书步骤进行。
1.7 HE染色法检测各组大鼠甲状腺组织病理形态表现HE染色:取固定后的甲状腺组织,经过乙醇梯度脱水,梯度二甲苯透明,石蜡包埋,制作成4 μm厚的切片,烤片,二甲苯脱蜡,梯度乙醇浸泡,于光镜下观察各组大鼠甲状腺滤泡的形态和淋巴细胞的浸润程度,拍照。
1.8 Western blotting法检测各组大鼠甲状腺组织中Foxp3和RORγt蛋白表达水平取100 mg甲状腺组织,加入RIPA裂解液1 mL,冰上研磨、匀浆,4℃离心取上清,根据BCA蛋白浓度测定试剂盒说明书操作方法检测样品蛋白含量,确定上样量,将配置好的分离胶和浓缩胶加到胶板中聚合,将煮沸后的样品加入电泳凝胶上,电泳分离蛋白,电转移蛋白至PVDF膜上,采用5%脱脂奶粉封闭,加入一抗(Foxp31:1 000、RORγt1:500、β-actin1:2 000),4℃孵育过夜,TBST洗膜3次,加入二抗(Goat anti- Mouse IgG-HRP1:1 000,Goat anti Rabbit IgG-HRP1:1 000),37℃孵育1 h,TBST洗膜3次,ECL发光试剂盒显影,图像分析软件分析结果。蛋白表达水平=Foxp3或RORγt蛋白条带灰度值/β-actin条带灰度值。
1.9 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠血清TGAb、TPOAb、FT3、FT4、TRH、TSH、IL-10、IL-17和IL-23水平以及甲状腺组织中Foxp3和RORγt蛋白表达水平均以x±s表示,组间比较采用独立样本t检验,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠的一般情况考虑实验过程中出现大鼠死亡,血标本溶血,组织标本不完整等情况,故每组留取10只大鼠完整标本进行相应指标的检测。正常组大鼠外观行为等未见异常。造模组大鼠造模前期表现为易怒,束缚时强烈反抗、挣扎,解除束缚后迅速躲避、背毛竖立。造模后期造模组大鼠从易怒逐渐出现抑郁表现,活动减少、喜扎堆拱背、对束缚反应减弱、背毛粗糙蓬松易脱落、暗黄乏泽,嗜睡,倦怠、体质量增长缓慢、食少、时有稀便。治疗后,雷公藤组和软坚消瘿组大鼠上述一般情况明显改善。
2.2 正常组和造模组大鼠血清TGAb和TPOAb水平与正常组比较,造模组大鼠血清甲状腺抗体TGAb和TPOAb水平均升高(P < 0. 05)。见表 1。
| [x±s,λB/(IU·mL-1)] | |||
| Group | n | TGAb | TPOAb |
| Normal | 12 | 3.75±0.38 | 3.65±0.31 |
| Modeling | 36 | 11.16±2.69* | 10.82±2.64* |
| *P < 0.05 vs normal group. | |||
与正常组比较,模型组、雷公藤组和软坚消瘿组大鼠血清TGAb和TPOAb水平均升高(P < 0.05);与模型组比较,雷公藤组和软坚消瘿组大鼠血清TGAb和TPOAb水平降低(P < 0.05);与雷公藤组比较,软坚消瘿组大鼠血清TGAb和TPOAb水平降低(P < 0.05)。见表 2。
| [n=10, x±s, λB/(IU·mL-1)] | ||
| Group | TGAb | TPOAb |
| Normal | 3.69±0.45 | 3.50±0.41 |
| Model | 10.91±2.13* | 10.23±2.64* |
| Tripterygium wilfordii | 6.26±0.90*△ | 7.40±1.16*△ |
| RuanJianXiaoYing | 4.74±0.55*△# | 4.33±0.59△# |
| *P < 0.05 vs normal group;△P < 0.05 vs model group;#P < 0.05 vs Tripterygium wilfordii group. | ||
与正常组比较,模型组、雷公藤组和软坚消瘿组大鼠血清FT3、FT4和TRH水平均降低(P < 0.05),TSH水平升高(P < 0.05);与模型组比较,雷公藤组和软坚消瘿组大鼠血清FT3、FT4和TRH水平升高(P < 0.05),TSH水平降低(P < 0.05);与雷公藤组比较,软坚消瘿组大鼠血清FT3、FT4和TRH水平升高(P < 0.05),TSH水平降低(P < 0.05)。见表 3。
| [n=10, x±s,ρB/(ng·L-1)] | ||||
| Group | FT3 | FT4 | TRH | TSH |
| Normal | 32.03±8.93 | 104.85±29.04 | 572.93±157.69 | 2358.63±633.98 |
| Model | 9.61±2.76* | 24.03±5.81* | 129.32±22.24* | 8865.90±1833.92* |
| Tripterygium wilfordii | 16.78±3.78*△ | 47.35±8.97*△ | 276.49±57.81*△ | 6663.33±1735.84*△ |
| RuanJianXiaoYing | 26.85±5.77*△# | 74.56±14.66*△# | 383.51±46.23*△# | 3997.94±798.59*△# |
| *P < 0.05 vs normal group;△P < 0.05 vs model group;# P < 0.05 vs Tripterygium wilfordii group. | ||||
正常组大鼠甲状腺滤泡形态规则,结构完整,无淋巴细胞浸润;模型组大鼠甲状腺滤泡腔扩大,滤泡结构大量破坏,滤泡腔内及周围可见大量淋巴细胞浸润;雷公藤组大鼠甲状腺滤泡腔扩大,部分滤泡结构破坏,滤泡腔内及周围有少量淋巴细胞浸润,其程度轻于模型组;软坚消瘿组大鼠甲状腺病理形态学改变与雷公藤组类似,滤泡腔内及周围亦有少量淋巴细胞浸润。见图 1(插页四)。
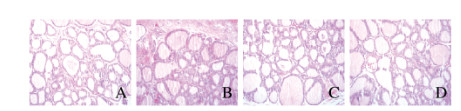
|
| A:Normal group; B: Model group; C: Tripterygium wilfordii group; D: RuanJianXiaoYing group 图 1 各组大鼠甲状腺组织病理形态表现(HE,×200) Fig. 1 Pathomorphology of thyroid tissue of rats in various groups(HE, ×200) |
|
|
与正常组比较,模型组、雷公藤组和软坚消瘿组大鼠甲状腺组织中Foxp3蛋白表达水平降低,RORγt蛋白表达水平升高(P < 0.05);与模型组比较,雷公藤组和软坚消瘿组大鼠Foxp3蛋白表达水平升高,RORγt蛋白表达水平降低(P < 0.05);与雷公藤组比较,软坚消瘿组大鼠甲状腺组织中Foxp3蛋白表达水平升高,RORγt蛋白表达水平降低,但组间比较差异无统计学意义(P>0.05)。见表 4和图 2。
| (n=6, x±s) | ||
| Group | Foxp3 | RORγt |
| Normal | 0.604±0.065 | 0.261±0.041 |
| Model | 0.276±0.059* | 0.615±0.078* |
| Tripterygium wilfordii | 0.436±0.051*△ | 0.434±0.075*△ |
| RuanJianXiaoYing | 0.455±0.060*△ | 0.404±0.068*△ |
| *P < 0.05 vs normal group;△P < 0.05 vs model group. | ||

|
| Lane 1:Normal group; Lane 2:Model group; Lane 3:Tripterygium wilfordii group; Lane 4:RuanJianXiaoYing group. 图 2 各组大鼠甲状腺组织中Foxp3和RORγt蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of Foxp3 and RORγt proteins in thyroid tissue of rats in various groups |
|
|
与正常组比较,模型组、雷公藤组和软坚消瘿组大鼠IL-10水平均降低(P < 0.05),IL-17(除软坚消瘿组)和IL-23水平均明显升高(P < 0.05);与模型组比较,软坚消瘿组大鼠血清IL-10水平升高(P < 0.05),雷公藤组和软坚消瘿组大鼠血清IL-17和IL-23水平降低(P < 0.05);与雷公藤组比较,软坚消瘿组大鼠血清IL-10水平升高(P < 0.05),IL-17和IL-23水平降低(P < 0.05)。见表 5。
| [n=10, x±s,ρB/(ng·L-1)] | |||
| Group | IL-10 | IL-17 | IL-23 |
| Normal | 61.80±14.35 | 32.48±6.88 | 22.92±6.34 |
| Model | 13.67±3.54* | 101.17±20.00* | 89.64±21.16* |
| Tripterygium wilfordii | 15.22±3.48* | 60.56±10.57*△ | 68.48±9.32*△ |
| RuanJianXiaoYing | 27.59±5.39*△ | 37.55±8.61△# | 36.47±7.70*△ |
| *P < 0.05 vs normal group;△P < 0.05 vs model group;#P < 0.05 vs Tripterygium wilfordii group. | |||
软坚消瘿颗粒是张兰教授以《太平惠民和剂局方》中逍遥散为基础方化裁,结合多年临床实践总结出的具有疏肝健脾、软坚消瘿功效的中药复方。本课题组前期实验[1-2]已证实了本复方具有能明显降低HT动物模型甲状腺自身抗体水平、减轻甲状腺组织淋巴细胞浸润和抑制甲状腺细胞凋亡等作用。为了更加明确软坚消瘿颗粒对HT的治疗作用及其作用机制,本研究基于中医辨证论治理论,建立病证结合动物模型,结果显示:经软坚消瘿颗粒治疗后,肝郁脾虚型HT模型大鼠血清甲状腺特异性自身抗体TGAb和TPOAb水平明显降低,甲状腺功能明显改善,甲状腺组织病理损伤减轻,提示软坚消瘿颗粒对肝郁脾虚型HT大鼠的疗效确切。从现代药理研究来分析软坚消瘿颗粒的作用机制,本复方组成中一些药物主要成分有抗炎和免疫调节作用。如本方中柴胡的主要成分柴胡皂苷具有抗炎作用,其抗炎作用是通过刺激肾上腺、促进肾上腺皮质系统功能所致;此外,柴胡皂苷对许多生物学过程包括致炎因子的释放、白细胞游走、渗出、毛细血管通透性、结缔组织增生等均有影响。白芍总苷通过影响白三烯B4的产生起到抗炎和免疫调节作用。当归有促进非特异性免疫功能的作用,当归水煎液能明显抑制多种致炎剂引起的急、慢性炎症,可以显著增强动物腹腔巨噬细胞吞噬功能;当归中性油总酸有增强巨噬细胞的吞噬功能和促进淋巴细胞转化的作用,且总酸部分尚有促进特意抗体IgG产生的作用;当归多糖能明显促进机体的免疫功能。白术有强壮作用和提高机体抗病能力的作用,能增强网状内皮系统的吞噬功能,提高淋巴细胞转化率,促进细胞免疫功能,且能增加IgG含量。茯苓多糖灌胃能增强小鼠巨噬细胞吞噬功能,羧甲基茯苓多糖还有免疫调节作用。海藻和昆布可以通过其中所含的碘和碘化物成分,使甲状腺功能恢复正常,腺肿缩小[8]。
HT是一种慢性无菌性炎症。研究[9]显示:HT患者Treg百分比、Treg/Th17比例均明显降低,Treg/Th17比例与HT患者的血清TPOAb、TgAb和TSH水平呈负相关关系。Th17主要通过分泌促炎因子诱导多种前炎症细胞因子和趋化因子的产生,继而参与机体炎症反应和免疫防御。Th17是最近发现的CD4+T辅助淋巴细胞,Th17产生的细胞因子对许多免疫细胞和非免疫细胞有影响,包括上皮细胞、自然杀伤(NK)细胞、B细胞、巨噬细胞和中性粒细胞[10]。当Treg通过细胞接触和分泌大量抑制性细胞因子主动发挥免疫抑制作用。Treg能够抑制CD4+T细胞、CD8+T细胞和NK细胞等免疫效应细胞的活化和增殖,能够抑制B细胞、树突状细胞和巨噬细胞的功能,促进一些抑制性细胞因子的分泌等,从而能高效调控自身反应性T细胞的功能,限制过度及错误的免疫效应,在预防自身免疫性疾病的发生和维持机体免疫稳定方面发挥作用[11-13]。最近国内外研究[14-16]表明:Foxp3/ RORγt失衡可能会导致T细胞的分化失衡,诱发主要由Th17参与的致炎T淋巴细胞反应,这可能是Treg/Th17失衡的重要机制。Foxp3作为Treg的标志物,是Treg发育和功能维持的关键转录因子[17]。RORγt是调节Th17分化的特异性转录因子,同时也是Th17的特异性标志物、关键的转录激活因子。本研究结果显示:与正常组比较,模型组大鼠甲状腺组织中Foxp3蛋白表达水平明显降低,而RORγt蛋白表达水平明显升高,提示在HT发生过程中,伴随着Treg/Th17的失衡,T细胞的分化逐渐失衡,诱发炎症反应。软坚消瘿颗粒干预后大鼠甲状腺组织中Foxp3蛋白表达水平明显升高,而RORγt蛋白表达水平明显降低,二者比值恢复,提示软坚消瘿颗粒对Treg/Th17失衡状态下的HT大鼠免疫功能具有调控作用,其调控靶点可能是通过调节Foxp3和RORγt蛋白表达水平而实现的。
Treg分为天然型调节性T细胞(nTreg)和诱导型调节性T细胞(iTreg)2种,nTreg与靶细胞直接接触发挥抑制其活性的功能,对免疫反应产生负面的调节作用,并将其限制在适当的范围内;iTreg通过分泌IL-10来发挥作用[18-19]。研究[20-21]表明:Th17与不同的感染、各种炎症和癌症的发展有牵连。在Th17分化增殖过程中,IL-23对其增殖存活起重要作用,而IL-17是Th17主要的效应分子。因此,IL-17和IL-23是Th17发挥作用的2个重要促炎细胞因子。本研究结果显示:HT大鼠血清IL-10水平明显低于正常组,而经过软坚消瘿颗粒干预后,IL-10水平明显升高。这一变化可能是因为HT发生过程中过度失衡的Treg/Th17所致,Treg数量明显减少,从而导致IL-10的分泌不足;而软坚消瘿颗粒干预纠正了Treg/Th17失衡,使Treg数量恢复,从而增加了IL-10的分泌量;同理,IL-17和IL-23水平变化机制与之相反,HT大鼠由于过度活化和增殖的Th17分泌IL-17和IL-23增多,使血清水平IL-17和IL-23水平明显升高;而软坚消瘿颗粒干预纠正了Treg/Th17失衡,抑制了Th17的过度活化和增殖,从而减少了IL-17和IL-23的分泌,进而发挥抗炎作用。
综上所述,软坚消瘿颗粒对肝郁脾虚型HT大鼠具有一定的治疗作用,其机制可能与软坚消瘿颗粒对Treg/Th17平衡的调控作用有密切关联,进而减轻了IL-17和IL-23所介导的炎症反应。
| [1] | 王家红.软坚消瘿颗粒治疗自身免疫性甲状腺炎大鼠的实验研究[D].沈阳: 辽宁中医药大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10162-1014149413.htm |
| [2] | 王家红, 张兰. 软坚消瘿颗粒对AIT大鼠细胞因子Th1/Th2及凋亡蛋白Fas/FasL、Bcl-2/Bax的影响[J]. 辽宁医学院学报, 2015, 36(2): 9–12. |
| [3] | KRISTENSEN B, HEGEDUS L, MADSEN H O, et al. Altered balance between self-reactive T helper (Th)17 cells and Th10 cells and between full-length forkhead box protein 3(FoxP3) and FoxP3 splice variants in Hashimoto's thyroiditis[J]. Clin Exp Immunol, 2015, 180(1): 58–69. |
| [4] | XUE H, YU X, MA L, et al. The possible role of CD4+CD25(high)Foxp3+/CD4+IL-17A+ cell imbalance in the autoimmunity of patients with Hashimoto thyroiditis[J]. Endocrine, 2015, 50(3): 665–673. DOI:10.1007/s12020-015-0569-y |
| [5] | LIU YZ, TANG XY, TIAN J, et al. Th17/Treg cells imbalance and GITRL profile in patients with Hashimoto's thyroiditis[J]. Int J Mol Sci, 2014, 15(12): 21674–21686. DOI:10.3390/ijms151221674 |
| [6] | BOSSOWSKI A, MONIUSZKO M, IDZKOWSKA E, et al. Decreased proportions of CD4+IL17+/CD4+CD25+CD127and CD4+IL17+/CD4+CD25+CD127-FoxP3+ T cells in children with autoimmune thyroid diseases[J]. Autoimmunity, 2016, 49(5): 320–328. DOI:10.1080/08916934.2016.1183654 |
| [7] | 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 2版. 北京: 人民卫生出版社,1982: 1535. |
| [8] | 马清钧, 王淑玲. 临床实用中药学[M]. 南昌: 江西科学技术出版社,2002. |
| [9] | 杨成, 金剑虹, 唐成坤, 等. 自身免疫性甲状腺炎中西医研究进展[J]. 浙江中西医结合杂志, 2018, 28(4): 335–338. DOI:10.3969/j.issn.1005-4561.2018.04.032 |
| [10] | Kristensen B. Regulatory B and T cell responses in patients with autoimmune thyroid disease and healthy controls[J]. Dan Med J, 2016, 63(2): B5177. |
| [11] | 关溪, 赵亮, 刘力, 等. 消瘿合剂对自身免疫性甲状腺炎大鼠调节性T细胞/Th17细胞轴的影响[J]. 医药导报, 2017, 36(2): 136–140. |
| [12] | 曾蓉.桥本氏甲状腺炎-甲状腺乳头状癌的免疫微环境及基因关联性初步研究[D].昆明: 昆明理工大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10674-1017220361.htm |
| [13] | 梅沉成, 张云璧, 陈曦, 等. Treg/Th17平衡偏移与寻常型银屑病中医三证型的相关性研究[J]. 中华中医药杂志, 2017, 32(6): 2717–2720. |
| [14] | 苏斯佳.桥本甲状腺炎患者血清25-(OH)D3水平与Th17/Treg细胞因子失衡的相关性研究[D].石家庄: 河北医科大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10089-1016146923.htm |
| [15] | 杜建超, 冯淬灵, 葛东宇, 等. 清金化痰汤对慢性阻塞性肺疾病急性加重期模型大鼠肺组织Foxp3和RORγt表达的影响[J]. 北京中医药大学学报, 2016, 39(12): 1006–1012. DOI:10.3969/j.issn.1006-2157.2016.12.007 |
| [16] | SAFDARI V, ALIJANI E, NEMATI M, et al. Imbalances in T cell-related transcription factors among patients with Hashimoto's thyroiditis[J]. Sultan Qaboos Univ Med J, 2017, 17(2): e174–e180. |
| [17] | 毕建华, 郝兰香, 黄飞, 等. 桥本甲状腺炎患者外周血CD4+ CD25+ Foxp3+调节性T细胞及IL-10的检测及临床意义[J]. 临床和实验医学杂志, 2017, 16(1): 38–40. DOI:10.3969/j.issn.1671-4695.2017.01.012 |
| [18] | LI C, YUAN J H, ZHU Y F, et al. Imbalance of Th17/Treg in different subtypes of autoimmune thyroid diseases[J]. Cell Physiol Biochem, 2016, 40(1/2): 245–252. |
| [19] | 任志华, 王婵, 邓俊良, 等. 中药组方对腹腔注射大肠杆菌小鼠血清Th17、Treg型细胞因子的影响[J]. 中国兽医学报, 2017, 37(12): 2378–2383. |
| [20] | 刘岳花, 卢凤艳, 陆东庆, 等. 白细胞介素-17和23在湿疹患者血清中的表达及其临床意义[J]. 临床皮肤科杂志, 2018, 47(3): 157–159. |
| [21] | 冯勤, 李忠武, 刘卉, 等. 免疫组化检测63例原发甲状腺癌中BRAF(V600E)突变及其价值研究[J]. 中国实用内科杂志, 2018, 38(12): 1188–1190. |
 2019, Vol. 45
2019, Vol. 45


